
丝安大字 物理化学游穑 第九章 可逆电池的电动势及其应用 (12学时) 物理化学教研室
1 物理化学讲稿 第九章 可逆电池的电动势及其应用 (12 学时) 物理化学教研室
第九章可逆电池的电动势及其应用(教学方案) 章节名称 第九章 可逆电池的电动势及其应用 备注 理论课(√);实验课( 授课方式 );实习 () 教学时数 12 1、掌握形成可逆电池的必要条件、可逆电极的类型和电池的书 面表示方法, 教学目的 2、了解对消法测电动势的基本原理和标准电池的作用 3、学会所给电池、电极写出有关的化学反应方程, 以及根据所 给化学反应设计原电池。 4、掌握热力学与电化学之间的联系,了解电动势产生的原因。 求 5、熟悉电极电势的一套惯用符号和掌握标准电极电势表的应用。 6、掌握能斯特方程及其应用.熟悉电动势测定的主要应用 7、理解浓差电池产生的机理及盐桥的作用。 教学内容提要 时间分配 9.1、可逆电池和可逆电极 9.2、电动势的测定:对消法测电动势、标准电池 1 9.3、可逆电池的书写方法及电动势的取号 1.5 9.4、可逆电池的热力学:能斯特方程、可逆电池热力学 2 9.5、电动势产生的机理 2 9.6、电极电势和电池的电动势 1 标准氢电极与参比电极可逆电池电动势的计算 2.5 9.7、电动势测定的应用:电解质平均活度系数的计算、微 溶盐的活度积、溶液PH值的测定、电势滴定、电势-pH图的 2 绘制及应用 重点:1.可逆电池的条件:2.电极反应、电池反应与电池表示式 的互译 重点 难点 3.电极电势、电池电动势的数值、符号的规定,标准电极电势、 标准电池电动势的意义;4.能斯特方程:5.电动势测定的应用 难点:1.电池电动势和电极电势的符号:2.双电层理论 讨论题目:1、可逆电池的条件是什么?为什么要提出可逆电池 来讨论? 讨论 2、电池反应与电池表示式之间的互相转化?3、可逆电池的设 思考 计方法? 作业 思考题目:为什么不能用伏特计直接测量电池的电动势? 练习作业:习题:1(2、4、6、8)、2(2、4、6、8、10)、5、 6、8(1、3、5)、9、11、13、14、16、21、(2、4、6)、25、 26、28、29、32、34、37、38 教学手段 课堂讲授 参考 1.王绪。物理化学学习指导。陕西人民教育出版社,1992 文献 2.物理化学一一概念辨析解题方法。中国科学技术大学出版 社.2002
2 第九章 可逆电池的电动势及其应用(教学方案) 章节名称 第九章 可逆电池的电动势及其应用 备 注 授课方式 理论课(√);实验课( );实习 ( ) 教学时数 12 教 学 目 的 及 要 求 1、掌握形成可逆电池的必要条件、可逆电极的类型和电池的书 面表示方法, 2、了解对消法测电动势的基本原理和标准电池的作用 3、学会所给电池、电极写出有关的化学反应方程,以及根据所 给化学反应设计原电池。 4、掌握热力学与电化学之间的联系,了解电动势产生的原因。 5、熟悉电极电势的一套惯用符号和掌握标准电极电势表的应用。 6、掌握能斯特方程及其应用.熟悉电动势测定的主要应用 7、理解浓差电池产生的机理及盐桥的作用。 教学内容提要 时间分配 9.1、可逆电池和可逆电极 9.2、电动势的测定: 对消法测电动势、标准电池 9.3、可逆电池的书写方法及电动势的取号 9.4、可逆电池的热力学:能斯特方程、可逆电池热力学 9.5、电动势产生的机理 9.6、电极电势和电池的电动势 标准氢电极与参比电极 可逆电池电动势的计算 9.7、电动势测定的应用: 电解质平均活度系数的计算、微 溶盐的活度积、溶液 PH 值的测定、电势滴定、电势-pH 图的 绘制及应用 1 1.5 2 2 1 2.5 2 重点 难点 重点:1.可逆电池的条件;2.电极反应、电池反应与电池表示式 的互译 3.电极电势、电池电动势的数值、符号的规定,标准电极电势、 标准电池电动势的意义;4.能斯特方程;5.电动势测定的应用 难点:1.电池电动势和电极电势的符号;2.双电层理论 讨论 思考 作业 讨论题目:1、可逆电池的条件是什么?为什么要提出可逆电池 来讨论? 2、电池反应与电池表示式之间的互相转化? 3、可逆电池的设 计方法? 思考题目:为什么不能用伏特计直接测量电池的电动势? 练习作业:习题:1(2、4、6、8)、2(2、4、6、8、10)、5、 6、8(1、3、5)、9、11、13、14、16、21、(2、4、6)、25、 26、28、29、32、34、37、38 教学手段 课堂讲授 参考 文献 1.王绪。物理化学学习指导。陕西人民教育出版社,1992 2.物理化学——概念辨析解题方法。中国科学技术大学出版 社.2002

第九章可逆电池的电动势及其应用 引言: 在这一章中的电池指的是原电池,使电解质和电极自发的反应向外放电,如果是在等温,等压时,该 体系的吉布斯自由能的减少等于体系对外作的最大非体积功:即 表示不可能发生的过程 如果该非体积功只有电功的情况下,有:(△,G)r,p≤Wmx=-nEF 当反应进度为1摩尔时:(△,Ghp≤-EF:= 5 可见:当电池中的反应为可逆过程(热力学可逆)时(△,Gm)p=-EF 当电池中的反应为不可逆过程(热力学不可逆)时(△,Gm)h,p<-EF 电化学与热力学的联系 热力学 电化学 虽然实际工作的电池并不可能是可逆的,但是只有可逆时E与△G有直接相等的关系,因此,研究可 逆电池和可逆电极是很重要的,为了从理论上弄清楚它的重要性,必须了解可逆电池,可逆电极、电动势 及产生的原理、理论计算方法和他们在实际中的应用。 重要公式:(△,G)r,pR=Wmx=-nEF 如何把化学反应转变成电能? 1、该化学反应是氧化还原反应,或包含有氧化还原的过程: 2、有适当的装置,使化学反应分别通过在电极上的反应来完成: 3、有两个电极和与电极建立电化学平衡的相应电解质: 4、有其他附属设备,组成一个完整的电路。 本章基本要求 1、明确掌电动势与△Gm的关系,掌握电极电势、电池的书面表示的一套符号: 2、熟悉标准电极电势表的应用: 3、掌握写出所给电池的电极反应和电池反应,能根据所给化学反应设计原电池: 4、熟悉热力学与电化学之间的联系: 5、熟练掌握能斯特方程及其应用以及电动势的计算: 6、明确温度对电动势的影响,了解△Hm和△rSm的计算; 7、了解电动势产生的原因及电动势测定的一些应用
3 第九章 可逆电池的电动势及其应用 引言: 在这一章中的电池指的是原电池,使电解质和电极自发的反应向外放电,如果是在等温,等压时,该 体系的吉布斯自由能的减少等于体系对外作的最大非体积功:即 r , , f,max ( ) G W T p R = 表示自发过程 表示自发性可逆 表示不可能发生的过程 如果该非体积功只有电功的情况下,有: r , f,max ( ) = − G W nEF T p 当反应进度为 1 摩尔时: r , ( ) − G zEF m T p n z = 可见:当电池中的反应为可逆过程(热力学可逆)时 r , ( ) = − G zEF m T p 当电池中的反应为不可逆过程(热力学不可逆)时 r , ( ) − G zEF m T p < 电化学与热力学的联系 虽然实际工作的电池并不可能是可逆的,但是只有可逆时 E 与△G 有直接相等的关系,因此,研究可 逆电池和可逆电极是很重要的,为了从理论上弄清楚它的重要性,必须了解可逆电池,可逆电极、电动势 及产生的原理、理论计算方法和他们在实际中的应用。 重要公式:: r , , f,max ( ) = = − G W nEF T p R 如何把化学反应转变成电能? 1、该化学反应是氧化还原反应,或包含有氧化还原的过程; 2、有适当的装置,使化学反应分别通过在电极上的反应来完成; 3、有两个电极和与电极建立电化学平衡的相应电解质; 4、有其他附属设备,组成一个完整的电路。 本章基本要求 1、明确掌电动势与△rGm 的关系,掌握电极电势、电池的书面表示的一套符号; 2、熟悉标准电极电势表的应用; 3、掌握写出所给电池的电极反应和电池反应,能根据所给化学反应设计原电池; 4、熟悉热力学与电化学之间的联系; 5、熟练掌握能斯特方程及其应用以及电动势的计算; 6、明确温度对电动势的影响,了解△rHm 和△rSm 的计算; 7、了解电动势产生的原因及电动势测定的一些应用

§9.1可逆电池和可逆电极 一、可逆电池和不可逆电池 热力学指出,体系经过某一变化后,当沿着相反方向回到原来到状态,环境也同时恢复到原态,则原 过程是热力学可逆过程否则就是不可逆过程,根据这一性质,电池可分为可逆电池和不可逆电池两种。如 电池:是与一个外电源并联。 当外加电势V比电池的电动势E小8V时,电池放电,反应为: 在Zn极上:Zn-2e→Zn2+ Zn Ag 在AgC1-Ag极上:2AgCI(s)+2e→2Ag(s)+2CI AgCI 总反应:2AgCl(s)+Zn→2Ag(s)+2CT+Zn2 、 ZnCl2 当外加电势V比电池的电动势E大δV时,电池充电,反应为: 在Zn极上:Zn2++2e→Zn 在AgC1-Ag极上:2Ag(s)+2CT-2e→2AgCl(s) 总反应:2Ag(s)+2CI+Zn2+→2AgCl(s)+Zn 0.810V ZnSo 化学反应可逆 能量变化可逆 Zn(s)|ZnS0I |HCI|AgC1(s)Ag(s) 作原电池 (-)Zn(s)→Zn2++2e (+)2AgCI(s)+2e-->2Ag(s)+2CI- 净反应 Zn(s)+2AgCI(s)->2Ag(s)+2CI+Zn2 作电解池阴极:Zn2++2e→Zn(s) 阳极2Ag(s)+2CI→2AgCl(s)+2e 净反应:2Ag(s)+ZnCl2→Zn(s)+2AgCl(s)
4 §9.1 可逆电池和可逆电极 一、可逆电池和不可逆电池 热力学指出,体系经过某一变化后,当沿着相反方向回到原来到状态,环境也同时恢复到原态,则原 过程是热力学可逆过程否则就是不可逆过程,根据这一性质,电池可分为可逆电池和不可逆电池两种。如 电池:是与一个外电源并联。 当外加电势 V 比电池的电动势 E 小δV 时,电池放电,反应为: 在 Zn 极上: 2 Zn e Zn 2 + − → 在 AgCl-Ag 极上: 2 ( ) 2 2 ( ) 2 AgCl s e Ag s Cl− + → + 总反应: 2 2 ( ) 2 ( ) 2 AgCl s Zn Ag s Cl Zn − + + → + + 当外加电势 V 比电池的电动势 E 大δV 时,电池充电,反应为: 在 Zn 极上: 2 Zn e Zn 2 + + → 在 AgCl-Ag 极上: 2 ( ) 2 2 2 ( ) Ag s Cl e AgCl s − + − → 总反应: 2 2 ( ) 2 2 ( ) Ag s Cl Zn AgCl s Zn − + + + → + 化学反应可逆 能量变化可逆 Zn(s)|ZnSO4 ||HCl|AgCl(s) | Ag(s) 作原电池 2 ( ) Zn(s) Zn 2e + − − ⎯⎯→ + ( ) 2AgCl(s) 2e 2Ag(s) 2Cl − − + + ⎯⎯→ + 净反应 2 Zn(s) 2AgCl(s) 2Ag(s) 2Cl Zn − + + ⎯⎯→ + + 作电解池 阴极: 2 Zn 2e Zn(s) + − + ⎯⎯→ 阳极 2Ag(s) 2Cl 2AgCl(s) 2e − − + ⎯⎯→ + 净反应: 2 2Ag(s) ZnCl Zn(s) 2AgCl(s) + ⎯⎯→ + A Zn Ag AgCl ZnCl2

可见,该电池在充放电时的化学反应恰好相反,即电池反应重物质变化是可逆的,同时内外电压只相 差无限小的值,说明电池反应是在十分接近于平衡态下进行的,因此当电池恢复原状时,在环境中也不会 留下任何痕迹,这样的电池就符合热力学可逆的条件,故称为可逆电池。 总之,可逆电池必须具备两个基本条件: 1、电池中化学反应必须是可逆的,即电极上的化学反应可向正反两个方向进行。(物质可逆) 2、电池充放电时,必须符合E-V=±V的条件,即充放电时所通过的电流必须十分微小,电池可 以在接近平衡状态下工作,或放电时的能量全部可用来充电,使体系和环境都回到原来的状态。(能量转 化可逆)。 只有同时满足上述两个条件的电池才是可逆电池,即可逆电池在充电和放电时不仅物质转变是可逆的 (即总反应可逆),而且能量的转变也是可逆的(即电极上的正、反向反应是在平衡状态下进行的)。若 不能同时满足上述两个条件的电池均是不可逆电池。不可逆电池两电极之间的电势差E'将随具体工作条 件而变化,且恒小于该电池的电动势。 如当外加电势V比电池的电动势E小8V时,电池放电,反应为: 在Zn极上:Zn-2e→Zn2+ Zn CU 在Cu极上:2H++2e→H(g) 总反应: 2H+Zn放电→Zn2*+H,(g) 当外加电势V比电池的电动势E大8V时,电池充电,反应为: 在Zn极上:2H+2e→H2(g) 在Cu极上:Cu-2e→C2+ 总反应:Cu+2H电→H,(g)+C 可见:即使所通入的电流很小时,充放电过程的化学反应并不相同,即,不可能使电池恢复到原态而 不引起其他变化,即该电池称为不可逆电池,当然并不是所有的反应可逆的电池都是可逆电池,如上第一 个电池,如果充电时内外电压相差很大时明反应虽然可逆,但是能量不可逆,再比如,常用的铅蓄电池, 从化学反应来看符合可逆电池的条件1,但实际充放电时,内外电压相差很大,其中的部分电能或化学能 转变为热,而这部分热再转化为功时,环境中必然留下痕迹(热功转化不可逆性)所以常用的铅蓄电池是 不可逆电池。 电池还可你根据其装置分为单液电池和双液电池: Pt Zn 盐桥 ZnSO.(aq) AgCl+Ag 素瓷烧杯 CuSO,(ag) nso.(a 2双液电池 3双液电池 1单液电池 (用素烧瓷分开) (用盐桥分开) 严格的说,双液电池都是不可逆电池,因为在两种电解质之间要又扩散过程,如2电池,在放电时, Zn2会向CuS0,溶液扩散(因为放电过程中负极Zn浓度增加,而Cu"浓度降低),而在充电时,Cu会向
5 可见,该电池在充放电时的化学反应恰好相反,即电池反应重物质变化是可逆的,同时内外电压只相 差无限小的值,说明电池反应是在十分接近于平衡态下进行的,因此当电池恢复原状时,在环境中也不会 留下任何痕迹,这样的电池就符合热力学可逆的条件,故称为可逆电池。 总之,可逆电池必须具备两个基本条件: 1、电池中化学反应必须是可逆的,即电极上的化学反应可向正反两个方向进行。(物质可逆) 2、电池充放电时,必须符合 E V V − = 的条件,即充放电时所通过的电流必须十分微小,电池可 以在接近平衡状态下工作,或放电时的能量全部可用来充电,使体系和环境都回到原来的状态。(能量转 化可逆)。 只有同时满足上述两个条件的电池才是可逆电池,即可逆电池在充电和放电时不仅物质转变是可逆的 (即总反应可逆),而且能量的转变也是可逆的(即电极上的正、反向反应是在平衡状态下进行的)。若 不能同时满足上述两个条件的电池均是不可逆电池。不可逆电池两电极之间的电势差E′将随具体工作条 件而变化,且恒小于该电池的电动势。 如当外加电势V比电池的电动势E小δV时,电池放电,反应为: 在 Zn 极上: 2 Zn e Zn 2 + − → 在 Cu 极上: 2 2 2 ( ) H e H g + + → 总反应: 2 2 2H Zn Zn H + + + ⎯⎯⎯→ + 放电 (g) 当外加电势 V 比电池的电动势 E 大δV 时,电池充电,反应为: 在 Zn 极上: 2 2 2 ( ) H e H g + + → 在 Cu 极上: 2 Cu e Cu 2 + − → 总反应: 2 2 Cu H H g Cu 2 ( ) + + + ⎯⎯⎯→ + 充电 可见:即使所通入的电流很小时,充放电过程的化学反应并不相同,即,不可能使电池恢复到原态而 不引起其他变化,即该电池称为不可逆电池,当然并不是所有的反应可逆的电池都是可逆电池,如上第一 个电池,如果充电时内外电压相差很大时明反应虽然可逆,但是能量不可逆,再比如,常用的铅蓄电池, 从化学反应来看符合可逆电池的条件 1,但实际充放电时,内外电压相差很大,其中的部分电能或化学能 转变为热,而这部分热再转化为功时,环境中必然留下痕迹(热功转化不可逆性)所以常用的铅蓄电池是 不可逆电池。 电池还可你根据其装置分为单液电池和双液电池: 严格的说,双液电池都是不可逆电池,因为在两种电解质之间要又扩散过程,如 2 电池,在放电时, Zn2+会向 CuSO4 溶液扩散(因为放电过程中负极 Zn2+浓度增加,而 Cu2+浓度降低),而在充电时,Cu2+会向 A Zn Cu H2SO4 1 单液电池 2 双液电池 (用素烧瓷分开) 3 双液电池 (用盐桥分开)

ZSO,溶液扩散(因为Cu会向负极迁移),这两种扩散是离子的迁移速率不同,所以扩散的结果在两种液 体接界处产生一定方向,一定大小的电势,称为液体接界电势,或扩散电势,所以是不可逆的,这种电势 有时较大,在精确计算是不可以忽略,但是在两种溶液之间插入盐桥,如3电池,就可以近似的认为液体 接界电势己经消除,所以当作可逆电池来处理。盐桥的作用见§9.5电动势产生的机理中的扩散电势。 二、可逆电极和不可逆电极 在电化学的研究范围内,电极指第一类导体和第二类导体两异相(两个以上的相)串联而成的电化学 体系也叫半电池,在电池中,电极就是分别进行氧化过程和还原过程的各个组成部分,所以在电化学中电 极是指金属-溶液体系,而并非单指金属部分。 电池工作时,电极上发生的氧化反应或还原反应称为电极反应,但是,氧化还原反应在同一个相中进 行(如在溶液中进行)的反应,就不是电化学反应。如Fe2·+H2O,+2H→Fe”+2H,O的反应。 按照热力学性质电极可分为:可逆电极和不可逆电极 按照电极的极化分:极化电极和不极化电极(第十章) 1、可逆电极 由于只有可逆电极才能组成可逆电池,所以可逆电池的必备条件,对可逆电极同样适用,即: (1)电极上的物质变化是可逆的 例:Zn|ZnSO,电极 失电子时,Zn-2e→Zn2+ 得电子时,Zn2++2e→Zn化学反应可逆 (2)电极上无净电流通过,即I=0 任意一个电极反应都包括了两个相反的过程,氧化过程和还原过程,其反应的速率可以用电流密度J氧 化和J表示,(灯是同一电极上的单向电流密度,是不能用电表测定),当氧化和还原为可以过程时,J 敦化一J还原 I外=J氧化一J还原=0 总之,可逆电极是指能同时满足物质变化可逆和能量可逆两个条件的电极。 2、不可逆电极 不能同时满足物质变化可逆和能量可逆的两个条件的电极。 例如:Fe|H电极 失电子时,Fe-2e→Fe2+ 得电子时,2H++2e→H,化学反应不可逆 所以为不可逆电极。 三、可逆电极的类型和电极反应 可逆电极的类型主要有三种 1、第一类电极 (1)金属电极:是由金属浸在含该金属离子的溶液中构成的电极。这种电极上搬运电荷的是该金属离 子,电极中金属兼为反应物和导体,只有金属离子可以迁越相界面,电极通用的表示式和电极反应为: 电极 电极反应(还原) M"(a)M(s) M"(a)+ze→M(s) 例如:Zn(s)插入ZnSO4溶液中, 6
6 ZnSO4 溶液扩散(因为 Cu2+会向负极迁移),这两种扩散是离子的迁移速率不同,所以扩散的结果在两种液 体接界处产生一定方向,一定大小的电势,称为液体接界电势,或扩散电势,所以是不可逆的,这种电势 有时较大,在精确计算是不可以忽略,但是在两种溶液之间插入盐桥,如 3 电池,就可以近似的认为液体 接界电势已经消除,所以当作可逆电池来处理。盐桥的作用见§9.5 电动势产生的机理中的扩散电势。 二、可逆电极和不可逆电极 在电化学的研究范围内,电极指第一类导体和第二类导体两异相(两个以上的相)串联而成的电化学 体系也叫半电池,在电池中,电极就是分别进行氧化过程和还原过程的各个组成部分,所以在电化学中电 极是指金属-溶液体系,而并非单指金属部分。 电池工作时,电极上发生的氧化反应或还原反应称为电极反应,但是,氧化还原反应在同一个相中进 行(如在溶液中进行)的反应,就不是电化学反应。如 2 3 2 2 2 Fe 2 Fe H O H 2H O + + + + + → + 的反应。 按照热力学性质电极可分为:可逆电极和不可逆电极 按照电极的极化分:极化电极和不极化电极(第十章) 1、可逆电极 由于只有可逆电极才能组成可逆电池,所以可逆电池的必备条件,对可逆电极同样适用,即: (1)电极上的物质变化是可逆的 例: 4 Zn ZnSO | 电极 失电子时, 2 Zn e Zn 2 + − → 得电子时, 2 Zn e Zn 2 + + → 化学反应可逆 (2)电极上无净电流通过,即 I 外=0 任意一个电极反应都包括了两个相反的过程,氧化过程和还原过程,其反应的速率可以用电流密度 J 氧 化和 J 还原表示,(J 是同一电极上的单向电流密度,是不能用电表测定),当氧化和还原为可以过程时,J 氧化=J 还原 I 外= J 氧化-J 还原=0 总之,可逆电极是指能同时满足物质变化可逆和能量可逆两个条件的电极。 2、不可逆电极 不能同时满足物质变化可逆和能量可逆的两个条件的电极。 例如: Fe H| + 电极 失电子时, 2 Fe e Fe 2 + − → 得电子时, 2 2 H e H2 + + → 化学反应不可逆 所以为不可逆电极。 三、可逆电极的类型和电极反应 可逆电极的类型主要有三种 1、第一类电极 (1)金属电极:是由金属浸在含该金属离子的溶液中构成的电极。这种电极上搬运电荷的是该金属离 子,电极中金属兼为反应物和导体,只有金属离子可以迁越相界面,电极通用的表示式和电极反应为: 电极 电极反应(还原) M ( ) | M(s) z a + + M ( ) e M(s) z a z + − + + → 例如: Zn(s)插入 ZnSO4 溶液中

Zn(sZnS04(a)(作为负极)电极反应为:Zn-2e→Zn2 ZnS04(a)Zn(s)(作为正极)电极反应为:Zn2++2e→Zn 但是对于K、N等金属,由于与水有强烈的作同,必须制成汞齐才能在水溶液中成为稳定的金属电极, 称为汞齐电极: 例如: Na-Hg(a)Nat(a1)(作为负极)电极反应为:Na-Hg(a)-e=Na+Hg() Na'(a,)川Na(Hg(a)(作为正极)电极反应为:Na(a,)+nHg+e→Na(Hg(a) K*(a)川K-Hg(a)(作为正极)电极反应为:K+Hg()+e=K-Hg(a) 该类电极都对金属阳离子可逆,所以常用金属来命名,如铜电极、锌电极等。 (2)气体电极:是由被气体所饱和且含有该气体离子的电解质溶液与惰性的第一类导体所组成的电极, 如书上P61图A,该种电极只进行涉及气体的电极反应,惰性导体只起传导电子的作用,例如氢电极、氧 电极和卤素电极的表示和电极反应: H'(a,)IH,p)川Pt 2H'(a)+2e→H,p) OH(a)IH,p)川Pt 2H,0+2e→H,(p)+20H(a.) H(a.)川OpPt 0,p)+4H(a.)+4e→2H20) OH(a)O,(p)|Pt 0,p)+2H,0+4e→40H(a.) CI(a)CL,(p)|Pt Cl,p)+2e→2Cr(a.) 注意:参加电极反应的气体不是气相中的分子,而是该气体溶解与液相中的分子,电极表示式中的P是 气体达到溶解平衡时液相内气体的压力。 2、第二类电极(难溶物电极) (1)金属难溶盐电极:是由金属表面覆盖一薄层金属的难溶盐,然后浸入含有该几难溶盐的负离子 的溶液中所构成。 例如:电极 电极反应(还原) CI(a)I AgCI(s)IAg(s) AgCI(s)+e"Ag(s)+Cl(a) CI(a)|Hg2Cl2(s)|Hg(1) Hg2Cl2 (s)+2e"->2Hg(l)+2Cl(a_) (2)金属难溶氧化物电极:是在金属表面覆盖一薄层金属的难溶氧化物,然后浸入含有H或OH离子 的溶液中所构成。例如 电极 电极反应(还原) H'(a.)IAg2O(s)IAg(s) Ag20s)+2H'(a.)+2e→2Ag(s)+H,00) OH(a)IAg,O(s)IAg(s) Ag20(s)+2H20+2e→2Ag(s)+20H(a) 3、第三类电极(又叫氧化还原电极) 氧化-还原电极:是由惰性金属(如铂片)插入含有某种离子的不同氧化态的溶液中构成的电极,参 与电极反应的氧化态和还原态物质都在同一液相中,惰性金属只传导电子,不发生其他变化,例如 电极 电极反应(还原)
7 Zn(s)| ZnSO4(a)(作为负极) 电极反应为: 2 Zn e Zn 2 + − → ZnSO4(a)|Zn(s)(作为正极)电极反应为: 2 Zn e Zn 2 + + → 但是对于 K、Na 等金属,由于与水有强烈的作同,必须制成汞齐才能在水溶液中成为稳定的金属电极, 称为汞齐电极; 例如: Na-Hg(a)|Na+ (a1) (作为负极) 电极反应为: Na-Hg(a) -e= Na++ Hg(l) Na ( ) | Na(Hg)( ) a a + + (作为正极)电极反应为: + Na Hg(l) e Na(Hg)( ) ( ) a n a − + + + → K+ (a2)| K-Hg(a) (作为正极)电极反应为:K++ Hg(l) +e= K-Hg(a) 该类电极都对金属阳离子可逆,所以常用金属来命名,如铜电极、锌电极等。 (2)气体电极:是由被气体所饱和且含有该气体离子的电解质溶液与惰性的第一类导体所组成的电极, 如书上 P61 图 A,该种电极只进行涉及气体的电极反应,惰性导体只起传导电子的作用,例如氢电极、氧 电极和卤素电极的表示和电极反应: H ( ) | H ( ) | Pt 2 a p + + 2 2H ( ) 2e H ( ) a p + − + + → OH ( ) | H ( ) | Pt 2 a p − − 2 2 2H O 2e H ( ) 2OH ( ) p a − − − + → + H ( ) | O ( )|Pt 2 a p + + O ( ) 4H ( ) 4e 2H O(l) 2 2 p a − + + + + → OH ( ) | O ( ) | Pt 2 a p − − O ( ) 2H O 4e 4OH ( ) 2 2 p a − − − + + → Cl ( ) | Cl ( ) | Pt 2 a p − − Cl ( ) 2e 2Cl ( ) 2 p a − − − + → 注意:参加电极反应的气体不是气相中的分子,而是该气体溶解与液相中的分子,电极表示式中的 P 是 气体达到溶解平衡时液相内气体的压力。 2、第二类电极(难溶物电极) (1)金属难溶盐电极:是由金属表面覆盖一薄层金属的难溶盐,然后浸入含有该几难溶盐的负离子 的溶液中所构成。 例如: 电极 电极反应(还原) Cl ( ) | AgCl(s) | Ag(s) a − − AgCl(s) e Ag(s) Cl ( ) a − − − + → + Cl ( ) | Hg Cl (s) | Hg(l) 2 2 a − − Hg Cl (s) 2e 2 2 − + 2Hg(l) 2Cl ( ) a − − ⎯⎯→ + (2)金属难溶氧化物电极:是在金属表面覆盖一薄层金属的难溶氧化物,然后浸入含有 H +或 OH-离子 的溶液中所构成。例如 电极 电极反应(还原) H ( ) | Ag O(s) | Ag(s) 2 a + + Ag O(s) 2H ( ) 2e 2 a + + − + + 2 ⎯⎯→2Ag(s) H O(l) + OH ( ) | Ag O(s) | Ag(s) 2 a − − Ag O(s) 2H O 2e 2 2 − + + 2Ag(s) 2OH ( ) a − − ⎯⎯→ + 3、第三类电极(又叫氧化还原电极) 氧化-还原电极:是由惰性金属(如铂片)插入含有某种离子的不同氧化态的溶液中构成的电极,参 与电极反应的氧化态和还原态物质都在同一液相中,惰性金属只传导电子,不发生其他变化,例如 电极 电极反应(还原)

Fe"(a),Fe(a,)Pt Fe+(a)+e→Fe2+(a2) Sn(a),Sn"(a)|Pt Sn+(a)+2e→Sn2+(a2) Cu(a),Cu"(a,)|Pt Cu2*(a)+e→Cu*(a2) 另外还有一种电极为:膜电极,如玻璃电极:生物膜电极。 §9.2电动势的测定 一、电动势的测定一一对消法测电动势 可逆电池的电动势不能直接用伏特计来测量。这是因为:把伏特计与电池接通后,只有适量的电流通 过时,伏特计才能显示,这样电池计中就发生化学变化,致使溶液浓度发生变化,因而电动势也不断变化, 这样就不符合可逆电池的工作条件。另外,电池本身有内阻,用伏特计所量出的只是两电极间的电势差而 不是可逆电池的电动势。因此,一定要在没有电流通过的条件下测定可逆电池的电动势。 电池电动势:可逆电池无电流通过时两极间的电势差称为该电池的电动势。电位差U(伏特计读数) 和电动势E不仅概念不同,数值也不相等。电位差的数值比电动势要低。只有符合下列条件时,U值才等 于E值。 设R。为外线路上的电阻,R为电池的内阻,I为回路中的电流。 则根据欧姆定律:E=I(R+R) 若只考虑外电路时:U=IR, 将两式比较得 U R ER+R 当R很大时R,→oE≈U 根据这一原理波根多夫设计了测量电动势的方法一一对消法 1、对消法测定电动势的原理图 图9.1是对消法测定电池电动势的简图。 AB一为均匀滑线电阻;R一为可变电阻: E,一为电压为E,的工作电池: G一一为高灵敏度的检流计; E,e一一为电动势为E,的标准电池; Ex一一为待测电池;D一一为双臂开关。 图9.1对消法测定电池电动势的简图 2、测定步骤 先将H点移到标准电池Es电动势值的对应刻度H点,将双臂开关向上与标准电池接通,迅速调节可 变电阻R到G中无电流,这时Es的电动势与AH的电势降值反向而对消,并校准了AB上电势降的标度, 固定R将开关向下,迅速调节C到C点,使G中午电流通过,此时Ex的电动势与AC的电势降等值反向 而对消,这时C点标注的电势降数值为Ex的电动势,如果没有进行标注,则可以测量A田与AC的长度得: 6=品 无论是校准还是测量中,必须保证G中无电流通过,否则电池失去可逆性,电池内阻要消耗电势将, 所测数值只是电池的工作电压,此知必须小于电池电动势
8 3 2 Fe ( ), Fe ( ) Pt 1 2 a a + + | 3 2 1 2 Fe ( ) e Fe ( ) a a + + − + → 4 2 Sn ( ), Sn ( ) Pt 1 2 a a + + | 4 2 1 2 Sn ( ) 2e Sn ( ) a a + + − + → 2 Cu ( ), Cu ( ) Pt 1 2 a a + + | 2 Cu ( ) e Cu ( ) 1 2 a a + + − + → 另外还有一种电极为:膜电极,如玻璃电极;生物膜电极。 §9.2 电动势的测定 一、电动势的测定——对消法测电动势 可逆电池的电动势不能直接用伏特计来测量。这是因为:把伏特计与电池接通后,只有适量的电流通 过时,伏特计才能显示,这样电池计中就发生化学变化,致使溶液浓度发生变化,因而电动势也不断变化, 这样就不符合可逆电池的工作条件。另外,电池本身有内阻,用伏特计所量出的只是两电极间的电势差而 不是可逆电池的电动势。因此,一定要在没有电流通过的条件下测定可逆电池的电动势。 电池电动势:可逆电池无电流通过时两极间的电势差称为该电池的电动势。电位差U(伏特计读数) 和电动势E 不仅概念不同,数值也不相等。电位差的数值比电动势要低。只有符合下列条件时,U 值才等 于E 值。 设R0 为外线路上的电阻,Ri 为电池的内阻,I 为回路中的电流。 则根据欧姆定律:E=I(R+ Ri) 若只考虑外电路时:U =IR , 将两式比较得 i U R E R R = + 当 R 很大时 RO → E U 根据这一原理波根多夫设计了测量电动势的方法——对消法 1、 对消法测定电动势的原理图 图9.1 是对消法测定电池电动势的简图。 AB—为均匀滑线电阻;R—为可变电阻; EW—为电压为 EW的工作电池; G——为高灵敏度的检流计; Es,c——为电动势为Es,c的标准电池; Ex ——为待测电池;D——为双臂开关。 图 9.1 对消法测定电池电动势的简图 2、测定步骤 先将 H 点移到标准电池 Es 电动势值的对应刻度 H 点,将双臂开关向上与标准电池接通,迅速调节可 变电阻 R 到 G 中无电流,这时 Es 的电动势与 AH 的电势降值反向而对消,并校准了 AB 上电势降的标度, 固定 R 将开关向下,迅速调节 C 到 C 点,使 G 中午电流通过,此时 Ex 的电动势与 AC 的电势降等值反向 而对消,这时 C 点标注的电势降数值为 Ex 的电动势,如果没有进行标注,则可以测量 AH 与 AC 的长度得: x s.c AC E E AH = 无论是校准还是测量中,必须保证 G 中无电流通过,否则电池失去可逆性,电池内阻要消耗电势将, 所测数值只是电池的工作电压,此知必须小于电池电动势

二、标准电池 软木塞 在测定电池电动势时,需要一个电动势为 饱和 己知且稳定不变的原电池作为电动势量度标 CdSO,溶液 准。这个电池就是常用的可逆Weston标准电 Hg+Hg,SO 池。标准电池的装置见右图。 cso. Weston电池的组成结构为: Cd-Hg齐 正极,是汞和硫酸亚汞的糊状物,下方放 少许汞。 Hg 负极,是含12.5%的镉(Cd)镉汞齐。 正 负 在两极糊状物和汞齐的上方分别放有 Weston标准电池结构简图 CdS0,H0晶体和其饱和溶液。 Weston标准电池的反应: 负极 Cd(Hg)(a)->Cd2+2e-+nHg(1) 正极Hg,S0,(s)+2e→2Hg①)+SO 净反应CdHX+He,S0,付+Ho0→Cs0,H,0g+Mie0 CdHg)(a)中含镉W(Cd)=0.05~0.14 问题 为什么在定温度下,含Cd的质量分数在0.05~0.14之间, 583 标准电池的电动势有定值? 馆化物(印 从HgCd相图可知,在室温下,镉汞齐中镉的质量分数在 513 0.05~0.14之间时,系统处于熔化物和固溶体两相平衡区,镉 ↑43 汞齐活度有定值。 T/K 而标准电池电动势只与镉汞齐的活度有关,所以也有定值。 353 西相共存 固溶体2单相 293.15K时E=1.101845V 2 G 298.15K时E=1.101832V 20 40 60 80100 Hg Cd的质量直分数 可见标准电池的电动势与温度有关,其关系为 6/N=1.01845-4.05×10(T/K-293.15)-9.5×10(T/K-293.15)2+1×108(T/K-293.15)3 我国在1975年提出的公式为: E/N=E(293.15K)/N-{39.94(T/K-293.15)+0.929(T/K-293.15)2-0.009(T/K-293.15)3 +0.00006(T/K-293.15)}×10 通常要把标准电池恒温、恒湿存放,使电动势稳定。 §9.3可逆电池的书写方法及电动势的取号 一、可逆电池的书面表示法 要表达一个电池的组成和结构,若都画出来,未免过于费事。因此,有必要为书写电 池规定一些方便而科学的表达方式。在这方面,通用的惯例有如下几点: (1)电池中的负极写在左边,起氧化作用:正极写在右边,起还原作用。 (2)以或,”表示不同物相的界面,有接界电势存在,包括电极与溶液的界面,一 种溶液与另一种溶液的界面,或同一溶液但两种不同浓度间的界面等。 9
9 二、标准电池 在测定电池电动势时,需要一个电动势为 已知且稳定不变的原电池作为电动势量度标 准。这个电池就是常用的可逆Weston标准电 池。标准电池的装置见右图。 Weston 电池的组成结构为: 正极,是汞和硫酸亚汞的糊状物,下方放 少许汞。 负极,是含 12.5%的镉(Cd)镉汞齐。 在两极糊状物和汞齐的上方分别放有 4 2 8 CdSO H O 3 晶体和其饱和溶液。 Weston 标准电池的反应: 负极 2 Cd(Hg)( ) Cd 2e Hg(l) a n ⎯⎯→ + + + − 正极 2 Hg SO (s) 2e 2Hg(l) SO 2 4 4 − − + ⎯⎯→ + 净反应 2 4 2 8 Cd(Hg)( ) Hg SO (s) H O(l) 3 a + + 4 2 8 CdSO H O(s) Hg(l) 3 ⎯⎯→ + n Cd(Hg)( ) a 中含镉 W (Cd) 0.05 0.14 = 问 题 为什么在定温度下,含 Cd 的质量分数在 0.05~0.14 之间, 标准电池的电动势有定值? 从 Hg-Cd 相图可知,在室温下,镉汞齐中镉的质量分数在 0.05~0.14 之间时,系统处于熔化物和固溶体两相平衡区,镉 汞齐活度有定值。 而标准电池电动势只与镉汞齐的活度有关,所以也有定值。 293.15K 时 E = 1.101845V 298.15K 时 E = 1.101832V 可见标准电池的电动势与温度有关,其关系为 ET/V=1.01845-4.05×10-5 (T/K-293.15)- 9.5×10-7 (T/K-293.15)2 +1×10-8 (T/K-293.15)3 我国在 1975 年提出的公式为: ET/V=E(293.15K)/V-{39.94(T/K-293.15)+0.929(T/K-293.15)2 - 0.009(T/K-293.15)3 +0.00006(T/K-293.15)4}×10-6 通常要把标准电池恒温、恒湿存放,使电动势稳定。 §9.3 可逆电池的书写方法及电动势的取号 一、可逆电池的书面表示法 要表达一个电池的组成和结构,若都画出来,未免过于费事。因此,有必要为书写电 池规定一些方便而科学的表达方式。在这方面,通用的惯例有如下几点: (1)电池中的负极写在左边,起氧化作用;正极写在右边,起还原作用。 (2)以“|”或“,”表示不同物相的界面,有接界电势存在,包括电极与溶液的界面,一 种溶液与另一种溶液的界面,或同一溶液但两种不同浓度间的界面等
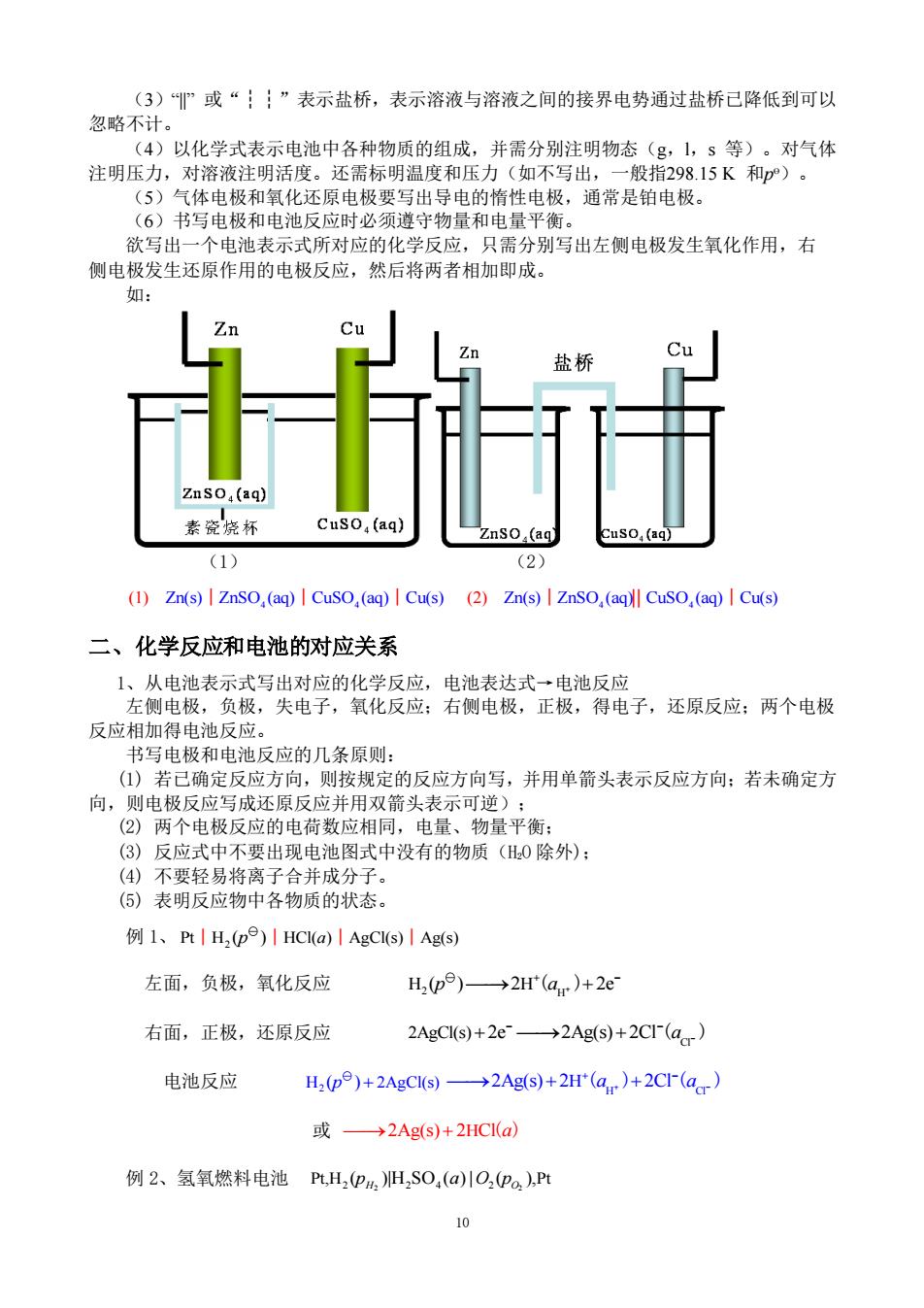
(3)”或“”表示盐桥,表示溶液与溶液之间的接界电势通过盐桥已降低到可以 忽略不计。 (4)以化学式表示电池中各种物质的组成,并需分别注明物态(g,1,s等)。对气体 注明压力,对溶液注明活度。还需标明温度和压力(如不写出,一般指298.15K和)。 (5)气体电极和氧化还原电极要写出导电的惰性电极,通常是铂电极。 (6)书写电极和电池反应时必须遵守物量和电量平衡。 欲写出一个电池表示式所对应的化学反应,只需分别写出左侧电极发生氧化作用,右 侧电极发生还原作用的电极反应,然后将两者相加即成。 如: 盐桥 Znso,(aq) 素瓷烧杯 Cuso(aq) Znso (aq) ℃us0,(aq) (1) (2) (1)Zn(s)|ZnSo,(aq)|Cuso,(aq)|Cu(s)(2)Zn(s)I ZnSO,(aq Cuso,(aq)Cu(s) 二、化学反应和电池的对应关系 1、从电池表示式写出对应的化学反应,电池表达式→电池反应 左侧电极,负极,失电子,氧化反应;右侧电极,正极,得电子,还原反应;两个电极 反应相加得电池反应。 书写电极和电池反应的几条原则: (1)若已确定反应方向,则按规定的反应方向写,并用单箭头表示反应方向:若未确定方 向,则电极反应写成还原反应并用双箭头表示可逆): (2)两个电极反应的电荷数应相同,电量、物量平衡: (3)反应式中不要出现电池图式中没有的物质(H0除外): (4)不要轻易将离子合并成分子。 (5)表明反应物中各物质的状态。 例1、Pt|H,(p)|HCI(a)|AgCI(s)|Ags) 左面,负极,氧化反应 H,(p)→2H(a)+2e 右面,正极,还原反应 2AgC(s)+2e→2Ags)+2Cr(a) 电池反应 H2(p)+2AgCI(s)->2Ag(s)+2H*(a )+2CI-(a) 或→2Ag(s)+2HCI(a) 例2、氢氧燃料电池Pt,H2(P4,)H2SO,(a)川O2Po,),Pt 10
10 (3)“||” 或“┆┆”表示盐桥,表示溶液与溶液之间的接界电势通过盐桥已降低到可以 忽略不计。 (4)以化学式表示电池中各种物质的组成,并需分别注明物态(g,l,s 等)。对气体 注明压力,对溶液注明活度。还需标明温度和压力(如不写出,一般指298.15 K 和p Ө)。 (5)气体电极和氧化还原电极要写出导电的惰性电极,通常是铂电极。 (6)书写电极和电池反应时必须遵守物量和电量平衡。 欲写出一个电池表示式所对应的化学反应,只需分别写出左侧电极发生氧化作用,右 侧电极发生还原作用的电极反应,然后将两者相加即成。 如: (1) (2) 4 4 (1) Zn(s) ZnSO (aq) CuSO (aq) │ │ │C ( u s) 4 4 (2) Zn(s) ZnSO (aq) CuSO (aq) │ ‖ │C ( u s) 二、化学反应和电池的对应关系 1、从电池表示式写出对应的化学反应,电池表达式→电池反应 左侧电极,负极,失电子,氧化反应;右侧电极,正极,得电子,还原反应;两个电极 反应相加得电池反应。 书写电极和电池反应的几条原则: (1) 若已确定反应方向,则按规定的反应方向写,并用单箭头表示反应方向;若未确定方 向,则电极反应写成还原反应并用双箭头表示可逆); (2) 两个电极反应的电荷数应相同,电量、物量平衡; (3) 反应式中不要出现电池图式中没有的物质(H2O 除外); (4) 不要轻易将离子合并成分子。 (5) 表明反应物中各物质的状态。 例 1、 Pt H HCl( ) AgCl(s) Ag(s) 2 │ ( ) p │ a │ │ 左面,负极,氧化反应 2 H H H ( ) 2 2e p a + ⎯⎯→ + + − ( ) 右面,正极,还原反应 Cl 2AgCl(s) 2e 2Ag(s) 2Cl a − − − + ⎯⎯→ + ( ) 电池反应 H 2AgCl(s) 2 ( ) p + H Cl 2Ag(s) 2 2Cl H a a + − ⎯⎯→ + + + − ( ) ( ) 或 ⎯⎯→ + 2Ag(s) 2 Cl H ( )a 例 2、氢氧燃料电池 2 2 Pt,H Pt 2 2 4 2 ( )|H SO ( ) | ( ), H O p a O p