
第六章化年街 物理化学电子教豪 第六章化学平衡 §6.1化学反应的自发方向和限度 §6.2化学反应等温方程式和平衡常数 §6.3化学反应平衡常数表示式 §6.4反应标准态Gibbsl自由能变(△,G §6.5标准生成Gibbs自由能与平衡常数的计算 §6.6用配分函数计算反应△.G和平衡常数 §6.7各种因素对化学反应平衡的影响 §6.8同时平衡 §6.9反应的藕合与近似计算
第六章 化学平衡 物理化学电子教案 第六章 化学平衡 §6.2 化学反应等温方程式和平衡常数 §6.1 化学反应的自发方向和限度 §6.3 化学反应平衡常数表示式 §6.4 反应标准态Gibbs自由能变( ) §6.5 标准生成Gibbs自由能与平衡常数的计算 §6.6 用配分函数计算反应 和平衡常数 §6.7 各种因素对化学反应平衡的影响 θ r Gm θ r Gm §6.8 同时平衡 §6.9 反应的藕合与近似计算

第六章化年街 物理化学电子教素 化学平衡是研究化学反应体系的平衡问题 (a)化学反应的方向和限度 (b)各种状态反应的平衡常数表示式 (c)各种条件对化学平衡衡的影响
第六章 化学平衡 物理化学电子教案 化学平衡是研究化学反应体系的平衡问题 ( a) 化学反应的方向和限度 ( b) 各种状态反应的平衡常数表示式 ( c) 各种条件对化学平衡的影响

第六章化年街 物理化学电子教素 大部分化学反应可以几乎同时朝正、反两个方 向进行,在一定条件(温度,压力,浓度)下,当正反两 个方向的反应速度相等时,体系就达到了平衡状态, 平衡状态就是反应的限度 ◆平衡后,体系中各物质的数量按一定的比例关系不再 改变.一旦外界条件改变,平衡状态就要发生变化. 平衡状态从宏观上看是静态,实际上是一种动态平衡. 实际生产中需要知道:①如何控制反应条件,使反应 按人们所需要的方向进行;②在给定条件下,反应进行的最 高限度是什么?
第六章 化学平衡 物理化学电子教案 ◆平衡后, 体系中各物质的数量按一定的比例关系不再 改变. 一旦外界条件改变, 平衡状态就要发生变化. ◆ 平衡状态从宏观上看是静态,实际上是一种动态平衡. ◆ 实际生产中需要知道: ①如何控制反应条件, 使反应 按人们所需要的方向进行; ②在给定条件下, 反应进行的最 高限度是什么? 大部分化学反应可以几乎同时朝正、反两个方 向进行, 在一定条件 (温度, 压力, 浓度)下, 当正反两 个方向的反应速度相等时, 体系就达到了平衡状态, 平衡状态就是反应的限度

第六章化年街 物理化学电子教豪 S6.1化学反应的自发方向和限度 1.化学反应的平衡条件 对任一反应:O=∑y.B B 当反应系统(封闭系统)发生微小量变化时(本章 均设无非体积功): dG=-SdT+Vdp+∑hdne 恒温、恒压条件下: dGp=∑hd 引入反应进度的概念 dξs dns 将dn.=Vd5代入得: VB dG,=∑Y4d5一dG决定于反应进度
第六章 化学平衡 物理化学电子教案 §6.1 化学反应的自发方向和限度 1. 化学反应的平衡条件 对任一反应: 当反应系统 (封闭系统)发生微小量变化时(本章 均设无非体积功): = − + + B dG SdT Vdp B dnB 恒温、恒压条件下: = B dGT,p B dnB = B 0 B B = B dGT,p B B d B —dG 决定于反应进度. 将 dnB = B d 代入得: 引入反应进度的概念 B B d d n =

第六章化年街 物理化学电子教案 设在无限大量系统中按反应计量关系进行= 1mol反应,这样反应系统的组成不变为常数.从 5=0到1mol积分: △,Gm(5)=∫∑Y4sd5=∑Vh 一摩尔Gibbs自由能变. G 也可以写为: => T B 此式意义,指恒温、恒压条件下,在有限量系 统中反应进行d飞摩尔时所引起系统的Gibbs自由 能变化.同样认为系统的组成不变,B为常数
第六章 化学平衡 物理化学电子教案 设在无限大量系统中按反应计量关系进行ξ= 1mol反应, 这样反应系统的组成不变,μB为常数. 从 ξ=0到 1mol积分: = = B B B 1 0 B r Gm ( ) B B d — 摩尔Gibbs自由能变. 也可以写为: = B B B , T p G 此式意义, 指恒温、恒压条件下, 在有限量系 统中反应进行 dξ摩尔时所引起系统的Gibbs自由 能变化. 同样认为系统的组成不变, μB 为常数

第六章化年街 物理化学电子教豪 2.化学反应自发方向的判据和亲和势 上式可作为反应方向的判椐(④Gm作为反应趋 势的度量),即 0时,向左自发 B =0时,反应达平衡 (平衡条件之一) 定义化学反应的亲和势为: 这一定义是德唐德(De Donder)给出的,就是说反应的 趋势只决定于系统变化的始、终态,与途径无关。亲和势 取负值,意指“势”为正值对于一自发反应,A>0;反应到 终态,A=0;不能A<0
第六章 化学平衡 物理化学电子教案 2. 化学反应自发方向的判据和亲和势 上式可作为反应方向的判椐 (ΔrGm作为反应趋 势的度量), 即 r m B B T,p B G G = = 定义化学反应的亲和势为: B B T,p B G A = − = − (平衡条件之一) = 时 反应达平衡 时 向左自发 时 向右自发 , , , 0 0 0 这一定义是德唐德(De Donder)给出的, 就是说反应的 趋势只决定于系统变化的始、终态, 与途径无关。亲和势 取负值,意指“势”为正值.对于一自发反应, A > 0; 反应到 终态, A = 0; 不能 A < 0
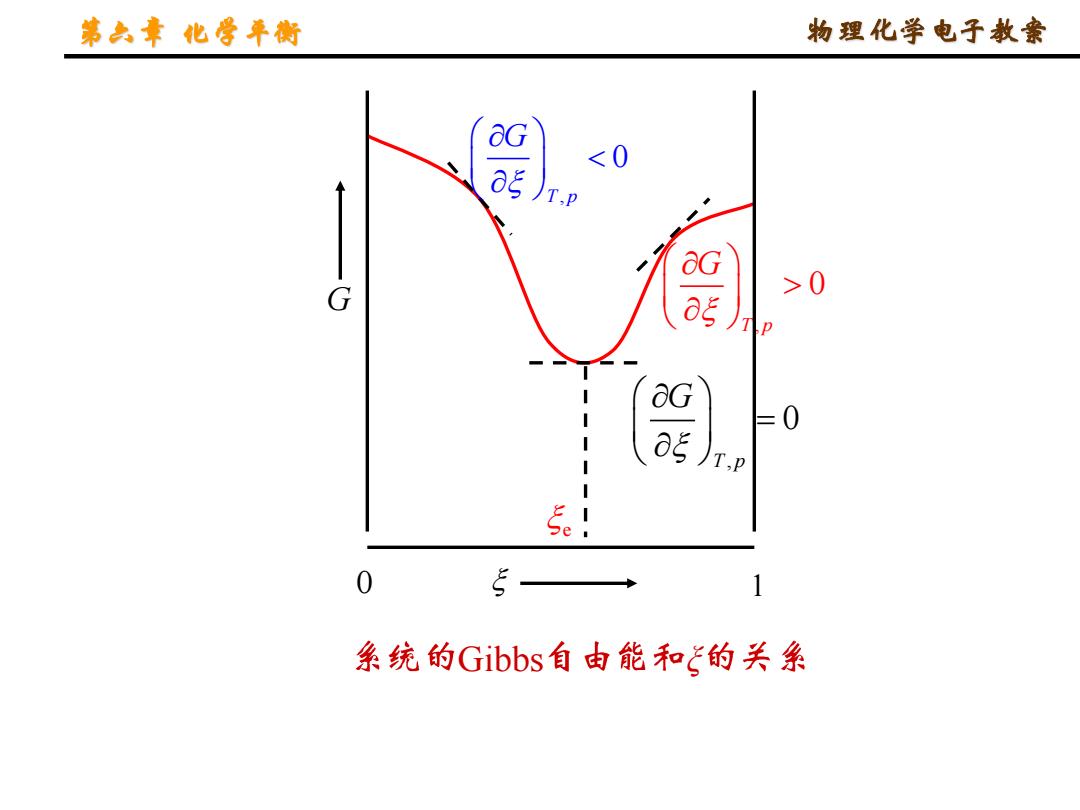
第六章化年街 物理化学电子教素 &G 0 &G =0 )T.P 5e 1 条统的Gibbs自由能和飞的关系
第六章 化学平衡 物理化学电子教案 , 0 T p G , 0 T p G = , 0 T p G Gibbs ξ 0 1 G e

第六章化号年衡 物理化学电子教案 3.化学反应过程的Gibbs自由能变化 一化学平衡的善遍性 根据热力学原理:当反应物的化学势总和大于 产物的化学势总和,反应就能自发进行;但为什么不 能进行到底,平衡后就不在进行? 严格讲,反应物与产物处于同一系统的反应都 是可逆的,不能进行到底。 只有逆反应与正反应相比小到可以忽略不计的 反应,可以粗略地认为可以进行到底。这主要是由 于存在混合Gibbs自由能的缘故
第六章 化学平衡 物理化学电子教案 3. 化学反应过程的Gibbs自由能变化 ——化学平衡的普遍性 根据热力学原理: 当反应物的化学势总和大于 产物的化学势总和,反应就能自发进行; 但为什么不 能进行到底, 平衡后就不在进行? 严格讲,反应物与产物处于同一系统的反应都 是可逆的,不能进行到底。 只有逆反应与正反应相比小到可以忽略不计的 反应,可以粗略地认为可以进行到底。这主要是由 于存在混合Gibbs自由能的缘故
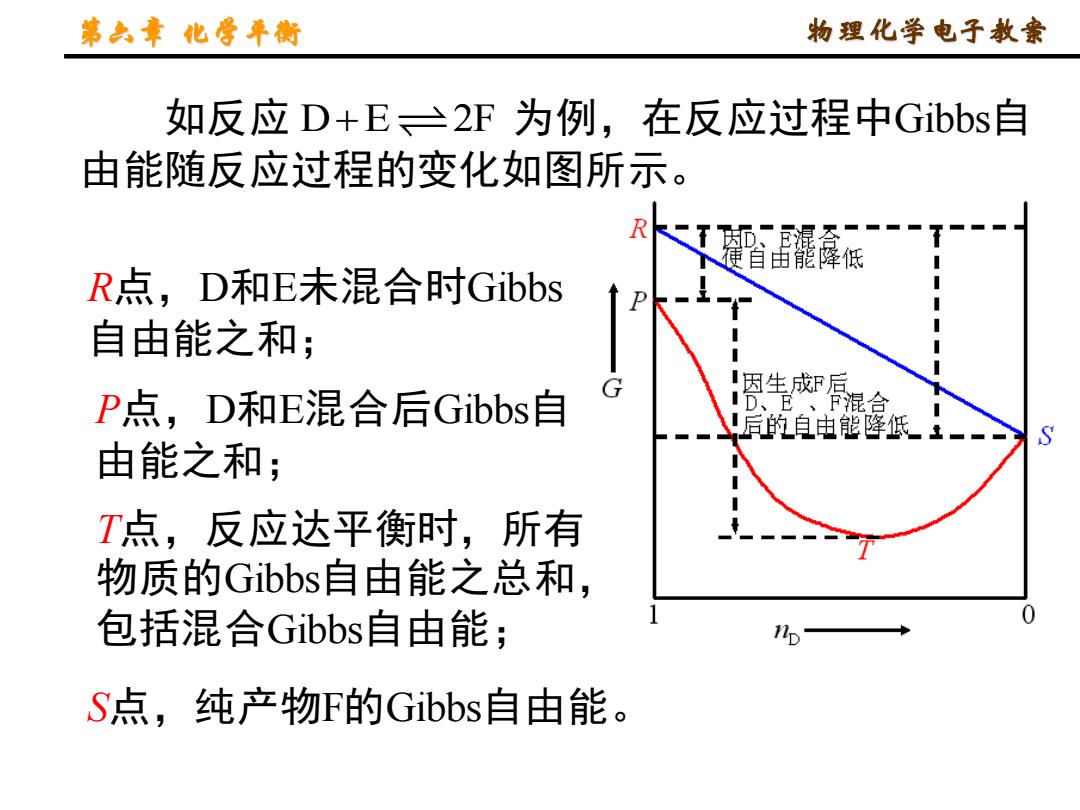
第六章化年街 物理化学电子教案 如反应D+E、三2F为例,在反应过程中Gibbs自 由能随反应过程的变化如图所示。 R 都、混 便自宙能降低 R点,D和E未混合时Gibbs 自由能之和 I因生成F后 P点,D和E混合后Gibbs自 G ID、E、F混合 后的自由能降低-一 由能之和; T点,反应达平衡时,所有 物质的Gibbs自由能之总和, 包括混合Gibbs自由能; np S点,纯产物F的Gibbs自由能
第六章 化学平衡 物理化学电子教案 如反应 为例,在反应过程中Gibbs自 由能随反应过程的变化如图所示。 D E 2F + R点,D和E未混合时Gibbs 自由能之和; P点,D和E混合后Gibbs自 由能之和; T点,反应达平衡时,所有 物质的Gibbs自由能之总和, 包括混合Gibbs自由能; S点,纯产物F的Gibbs自由能

第六章化骨平街 物理化学电子教豪 恒温恒压下,设有一气相反应: A(g) Tp恒定→B(g) t=0时:na,0=1mol nB,0=0 t时刻:nA=1-nB NB=5 =1-5 此时反应系统的Gibbs自由能为: G=nAMA ngMs n(RTRTin) =m+,+RT,血%+eh告)
第六章 化学平衡 物理化学电子教案 恒温恒压下, 设有一气相反应: A(g) ⎯⎯ ⎯→B(g) T、p恒 定 t = 0 时: nA,0 = 1mol nB,0 = 0 t 时刻: nA = 1- nB = 1-ξ nB =ξ ( ) ( ln ln ) θ B θ B A A θ B B θ A A p px n p px = n + n + R T n + G = nA A + nB B ( ln ) ( ln ) θ θ B θ B B θ A A A p p n RT p p = n + RT + + 此时反应系统的Gibbs自由能为: