
第9章 沉淀-溶解平衡 和沉淀滴定 Chapter 9 Precipitation -dissolution equilibrium and precipitation titration
沉淀-溶解平衡 和沉淀滴定 第9 章

本章教学要求 1.了解沉淀的溶解度和溶度积常数。 2.掌握微溶化合物溶解度的计算。 3.熟悉影响条件溶度积和沉淀溶解度的因素。 4.熟悉几种重要的银量法的原理、特点和应用。 上页 下页 目录 返回
本章教学要求 1. 了解沉淀的溶解度和溶度积常数 。 2. 掌握微溶化合物溶解度的计算。 3. 熟悉影响条件溶度积和沉淀溶解度的因素。 4. 熟悉几种重要的银量法的原理、特点和应用

本章内容 9.1 沉淀-溶解平衡 Precipitation-dissolution equilibrium 9.2 沉淀滴定法 Precipitation titration 上页 下页 目录返回
9.1 沉淀-溶解平衡 Precipitation – dissolution equilibrium 9.2 沉淀滴定法 Precipitation titration

9.1沉淀一溶解平 Precipitation-dissolution equilibrium 9.1.1 溶度积常数和溶解度 Solubility- product constant and solubility 9.1.2 离子积:沉淀形成与沉淀溶解的 判据Ion product:a criterion of formation of deposit and dissolution of deposit 9.1.3 沉淀一溶解平衡的移动 Shift of precipitation dissolution equilibrium 上页 下页 目录 返回
9.1.1 溶度积常数和溶解度 Solubility- product constant and solubility 9.1.2 离子积: 沉淀形成与沉淀溶解的 判据 Ion product: a criterion of formation of deposit and dissolution of deposit 9.1.3 沉淀-溶解平衡的移动 Shift of precipitation - dissolution equilibrium 9.1 沉淀-溶解平衡 Precipitation – dissolution equilibrium
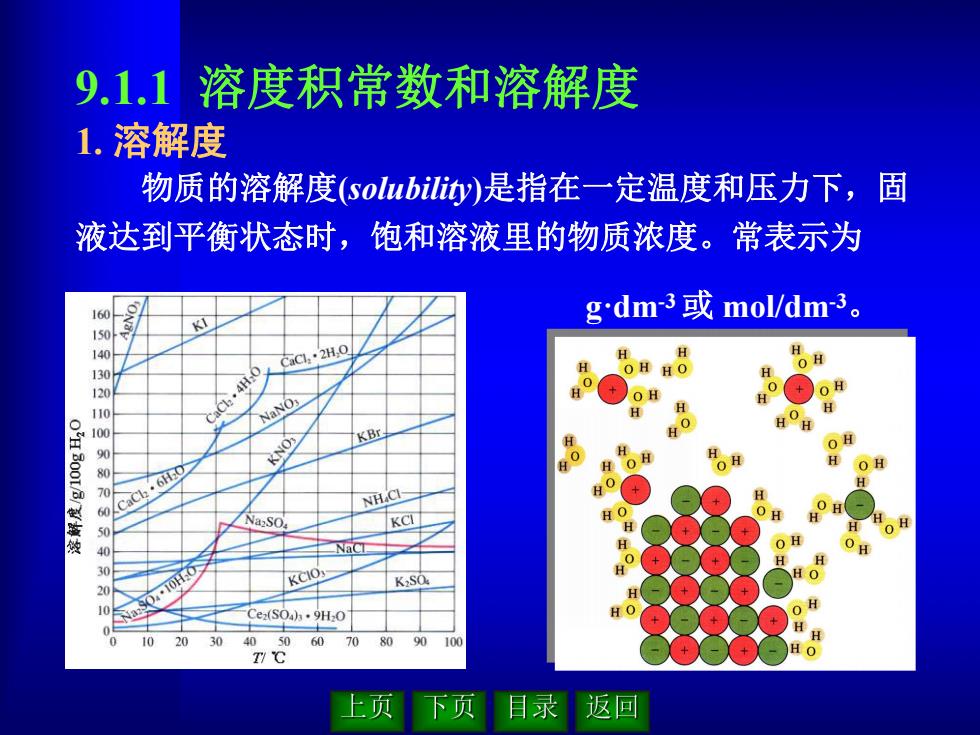
9.1.1溶度积常数和溶解度 1.溶解度 物质的溶解度(solubility)是指在一定温度和压力下,固 液达到平衡状态时,饱和溶液里的物质浓度。常表示为 160 gdm3或mol/dm3。 1 140 CaC1·2H,0 H H 120 OH 110 H 100 KNO KBr H 90 6H0 70 NH.CI- 50 KCI 30 Nas90.-10H.OS KCIO K2SO Cez(S0ah·9H0 10 20 30 4050 60 708090100 上页 下页 目录返回
9.1.1 溶度积常数和溶解度 1. 溶解度 物质的溶解度(solubility)是指在一定温度和压力下,固 液达到平衡状态时,饱和溶液里的物质浓度。常表示为 g·dm-3或 mol/dm-3
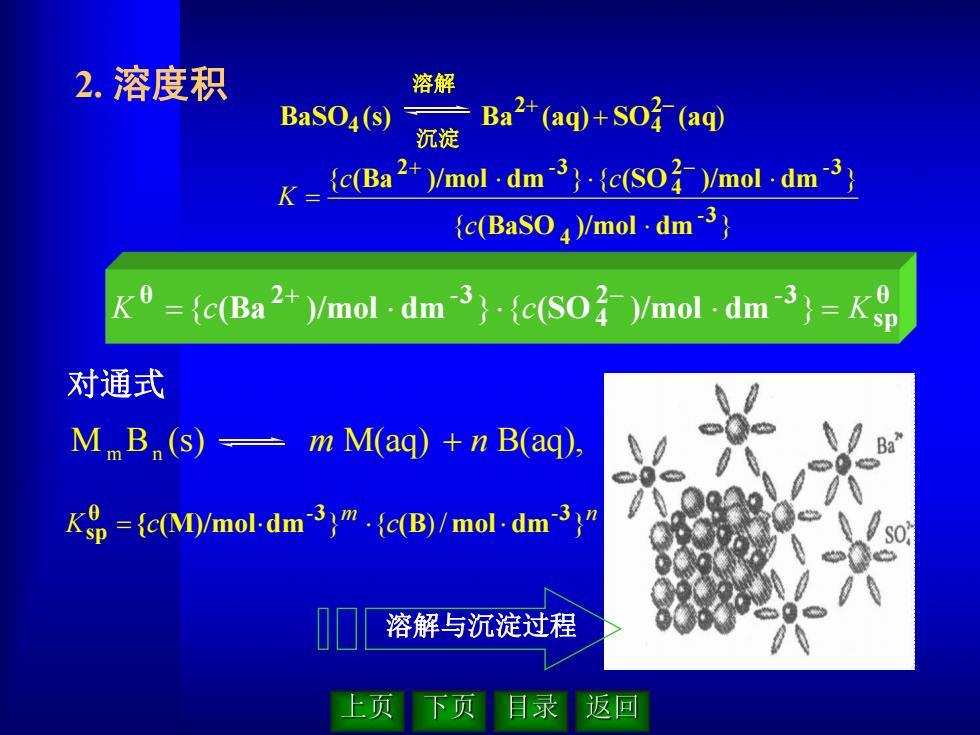
2.溶度积 溶解 BaSO4(s) Ba2+(aq+so子(aq 沉淀 =fc(Ba2)/mol dmc()/mol.dm3 {c(BaSO)/mol.dm3 ={c(Ba2)/mol.dm3()/mol dm3=Kp 对通式 MB (s)=mM(aq)+n B(aq). Ba" Kop=fc(M)/mol-dm3c(B)/mol.dm3)" 溶解与沉淀过程 上页 下页 目录 返▣
2. 溶度积 θ sp 2 3 4 θ 2 3 K c(Ba )/mol dm c(SO )/mol dm K - - { } { } - m - n K c } {c )/ } θ 3 3 sp { (M)/moldm (B mol dm { } { } { } 3 4 2 3 4 2 3 (BaSO )/mol dm (Ba )/mol dm (SO )/mol dm - - - c c c K 对通式 溶解与沉淀过程 BaSO (s) Ba (aq) SO (aq) 2 4 2 4 溶解 沉淀 M B (s) M(aq) B(aq), m n m n

溶度积和溶解度之间有什么关系? Solution ●与溶解度概念应用范围不同,K”只用来表示难溶电解 质的溶解度。 ● K不受离子浓度的影响,而溶解度则不同。 ●用K比较难溶电解质的溶解性能只能在相同类型化合 物之间进行,溶解度则比较直观。 上页下页目录返回
Question 1 溶度积和溶解度之间有什么关系? Solution ● 与溶解度概念应用范围不同, 只用来表示难溶电解 质的溶解度。 ● 不受离子浓度的影响,而溶解度则不同。 ● 用 比较难溶电解质的溶解性能只能在相同类型化合 物之间进行,溶解度则比较直观。 θ K sp θ K sp θ K sp

Que 298K时铬酸银Ag,CrO,的溶度积常数 为2.0×1012,求该温度下的溶解度。 Solution 设饱和溶液中CrO离子的浓度x mol-dm3,则代入 溶度积常数表达式得: K sp(Ag2CrO)={c(Ag+)/mol-dm-3)2c(Cr20)/mol-dm-3) =(2x)2x=4x3 x/mol-dm-3=3K9p(Ag2Cr04)/4=7.9×10- 溶液中Cr20帝子的浓度为7.9×10-5m0l·dm-3,也是 Ag2CrO4以mol-dm3为单位的溶解度。 上页 目录 返回
Question 2 298K时铬酸银Ag2CrO4的溶度积常数 为2.0×10 -12,求该温度下的溶解度。 Solution θ K sp 3 5 2 4 θ sp Ag CrO 4 7 9 10 {K ( ) / } . 设饱和溶液中 离子的浓度x mol·dm-3,则代入 溶度积常数表达式得: (Ag2CrO4) = {c(Ag +)/mol·dm-3} 2{c( )/mol·dm-3} = (2x) 2·x = 4x3 x/mol·dm-3 = 溶液中 离子的浓度为7.9×10 - 5 mol·dm- 3 , 也是 Ag2CrO4以mol·dm-3为单位的溶解度。 2 C 2O4 r 2 C 2O4 r 2 C 2O4 r

Que AgCI和Ag2CrO4的溶度积分别为 1.8×10-10和1.1×10-12,则下面叙述中 正确的是: (A)AgCI与Ag2CrO4的溶度度相等 (B)AgCI的溶解度大于AgCO (C)二者类型不同,不能由K”大小直接判断溶解度大小 Solution 分子式 溶度积 溶解度/mol·dm-9 AgCI 1.8×10-10 1.3×10-5 AgBr 5.0×10-13 7.1×10-7 AgI 8.3×10-17 9.1×10-10 AgzCrO 1.1×10-12 6.5×10-5 上页 下页 目录返回
Question 3 AgCl 和 Ag2CrO4的溶度积分别为 1.8×10 -10和 1.1 ×10 -12 ,则下面叙述中 正确的是: (A) AgCl与Ag2CrO4的溶度度相等 (B) AgCl的溶解度大于Ag2CrO4 (C) 二者类型不同,不能由 大小直接判断溶解度大小 Solution 分子式 溶度积 溶解度/ AgBr AgI AgCl mol · dm-3 1.8×10 -10 Ag2CrO4 1.3×10 -5 5.0×10 -13 7.1×10 -7 8.3×10 -17 9.1×10 -10 1.1×10 -12 6.5×10 -5 θ K sp
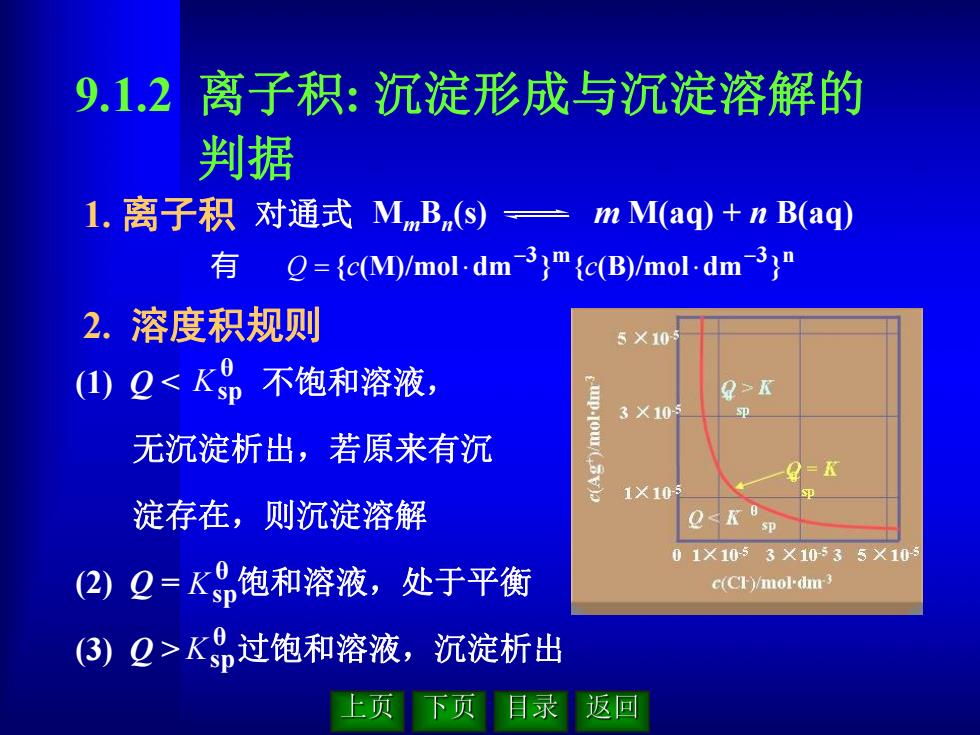
9.1.2 离子积:沉淀形成与沉淀溶解的 判据 1.离子积对通式MmB,(s)一mM(aq)+nB(aq) ={c(M)/mol.dm-3)"{c(B)/mol.dm3)" 2.溶度积规则 5×10 (1) QK 3×105 无沉淀析出,若原来有沉 .ou = 1×10 淀存在,则沉淀溶解 QK0 01X10-53×10535X10 (2)2=K0饱和溶液,处于平衡 c(CF)/mol-dm3 (3) Q>Kn过饱和溶液,沉淀析出 上页 返回
9.1.2 离子积: 沉淀形成与沉淀溶解的 判据 2. 溶度积规则 (1) Q 过饱和溶液,沉淀析出 θ Ksp θ Ksp θ Ksp 1. 离子积 对通式 MmBn (s) m M(aq) + n B(aq) 3 m 3 n { (M)/mol dm } { (B)/mol dm } 有 Q c c