
第2章 化学键与 分子结构 chapter 2 Chemical Bond and Molecular Structure
第 2 章 化学键与 分子结构 Chemical Bond and Molecular Structure Chapter 2

本章教学要求 1.认识化学键的本质; 2.掌握离子键的形成及其特点; 3. 掌握离子的特征,离子极化概念; 掌握价键理论的内容;会用价键理论解释共价键的 特征,会用价电子对互斥理论和杂化轨道理论解释 简单的分子结构; 5。初步认识分子轨道,掌握第二周期元素的分子轨道 特点; 6.理解金属键理论, 特别是能带理论,会用能带理论 解释固体分类; 7.认识分子间作用力和氢键的本质,会解释其对物质 性质的影响。 上页 下页 目录 返回
上页 下页 目录 返回 7.认识分子间作用力和氢键的本质,会解释其对物质 性质的影响。 1.认识化学键的本质; 2.掌握离子键的形成及其特点; 3.掌握离子的特征,离子极化概念; 4.掌握价键理论的内容;会用价键理论解释共价键的 特征,会用价电子对互斥理论和杂化轨道理论解释 简单的分子结构; 5.初步认识分子轨道,掌握第二周期元素的分子轨道 特点; 6.理解金属键理论,特别是能带理论,会用能带理论 解释固体分类; 本章教学要求

2.1化学键的定义Definition of chemical bond 本章内 2.2离子键理论 Tonic bond theory 2.3共价键的概念与路易斯结构式Concept of the covalent bond theory and Lewis'structure formula 2.4用以判断共价分子几何形状的价层电子对互斥 理论SEPR for judging the configuration of the covalence molecular 2.5原子轨道的重叠一价键理论Superposition of atomic orbital-valence bond theory 2.6分子轨道理论Molecular orbital theory 2.7金属键理论Metallic bond theory 2.8分子间作用力和氢键Intermolecular forces and hydrogen bond 上页 下页 目录 返回
上页 下页 目录 返回 2.1 化学键的定义 Definition of chemical bond 2.2 离子键理论 Ionic bond theory 2.3 共价键的概念与路易斯结构式 Concept of the covalent bond theory and Lewis’ structure formula 2.7 金属键理论Metallic bond theory 2.8 分子间作用力和氢键 Intermolecular forces and hydrogen bond 2.4 用以判断共价分子几何形状的价层电子对互斥 理论 VSEPR for judging the configuration of the covalence molecular 2.5 原子轨道的重叠— 价键理论 Superposition of atomic orbital —valence bond theory 2.6 分子轨道理论Molecular orbital theory
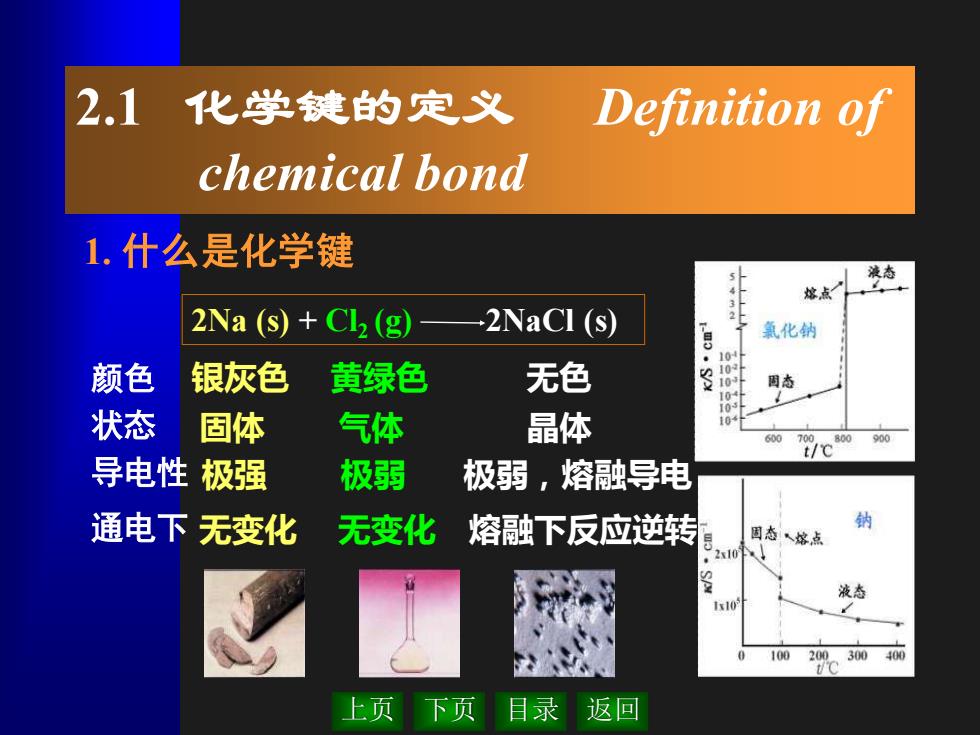
2.1 化学键的定义 Definition of chemical bond 1.什么是化学键 液态 熔点 2Na (s)+Cl(g) 2NaCI (s) 氯化钠 10 颜色 银灰色 黄绿色 无色 8. 固态 状态 固体 气体 晶体 10 600 700 800900 t/℃ 导电性极强 极弱 极弱,熔融导电 通电下无变化 无变化 熔融下反应逆转 固态、熔点 2x10.】 Ix10 100 200 300400 上页下页目录返回
上页 下页 目录 返回 2.1 化学键的定义 Definition of chemical bond 1. 什么是化学键 2Na (s) + Cl2 (g) 2NaCl (s) 颜色 状态 导电性 通电下 银灰色 黄绿色 无色 固体 气体 晶体 极强 极弱 极弱,熔融导电 无变化 无变化 熔融下反应逆转
不同的外在性质反映了不同的内部结构 各自内部的结合力不同 Pauling L在《The Nature of The Chemical Bond》 中提出了用得最广泛的化学键定义:如果两个原子( 或原子团)之间的作用力强得足以形成足够稳定的、 可被化学家看作独立分子物种的聚集体,它们之间就 存在化学键。简单地说,化学键是指分子内部原子之 间的强相互作用力。 上页 下页 目录 返回
上页 下页 目录 返回 Pauling L在《The Nature of The Chemical Bond》 中提出了用得最广泛的化学键定义:如果两个原子( 或原子团)之间的作用力强得足以形成足够稳定的、 可被化学家看作独立分子物种的聚集体,它们之间就 存在化学键。简单地说,化学键是指分子内部原子之 间的强相互作用力。 不同的外在性质反映了不同的内部结构 各自内部的结合力不同
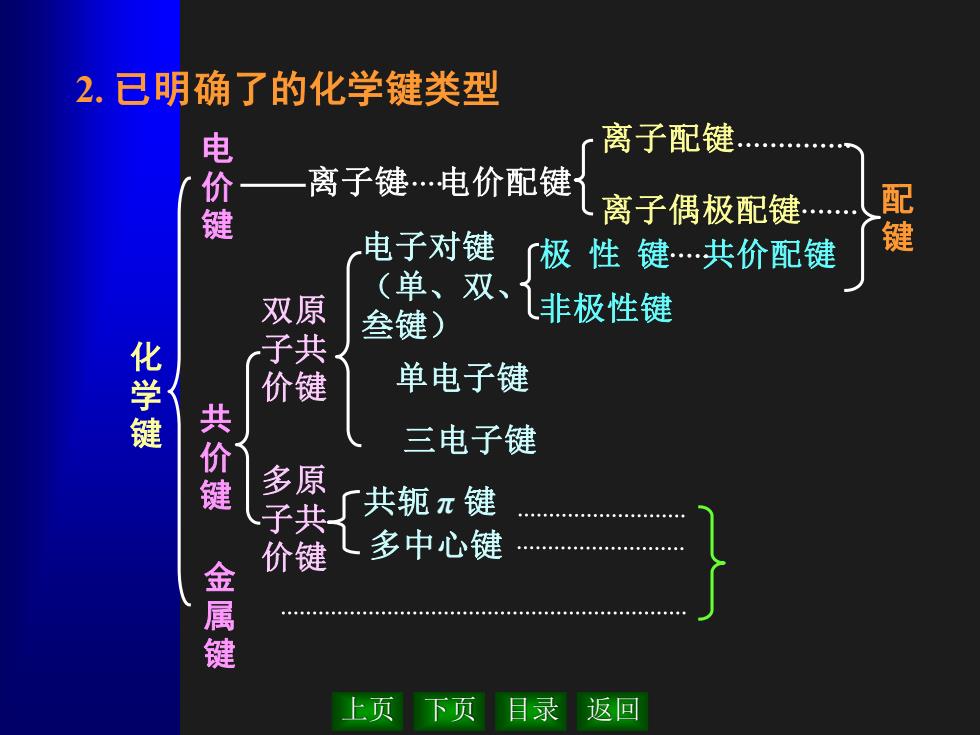
2.已明确了的化学键类型 电 离子配键 离子键.电价配键 键 离子偶极配键. 电子对键 「极性键.共价配键 键 (单、双、 双原 叁键) 非极性键 化学键 子共 价键 单电子键 共价键 三电子键 多原 子共 共轭π键 价键 L多中心键 金属键 上页下页目录 返回
上页 下页 目录 返回 2. 已明确了的化学键类型 化 学 键 共 价 键 金 属 键 离子配键 离子偶极配键 离子键 电价配键 配 键 双原 子共 价键 多原 子共 价键 电子对键 (单、双、 叁键) 单电子键 三电子键 共轭 π 键 多中心键 极 性 键 共价配键 非极性键 电 价 键

2.2离子键理论 Ionic bond theory 2.2.1 离子键及其特点 (1)离子键的形成 -ne nNa(3s') =496JmT→nNa*(2s22p) 静电边>NaC】 +ne nCl(3s23p) E-348.kmoF>CI(3s23p) 形成化学键 形成条件X=X.≥2.0 -450 kJ.mol-1 上页 下页 目录 返回
上页 下页 目录 返回 2.2.1 离子键及其特点 2.2 离子键理论 Ionic bond theory (1)离子键的形成 Na(3s ) Na (2s 2p ) 2 6 - e 496k J mol 1 - 1 1 + n ⎯⎯= ⎯⎯ ⎯⎯− →n n I Cl(3s 3p ) Cl (3s 3p ) 2 6 e 348.7k J mol 2 5 - 1 − + n ⎯⎯=− ⎯⎯⎯ ⎯⎯− →n n E ⎯⎯ ⎯→nNaCl 静电引力 形成条件 XA – XB > 2.0 形成化学键 -450 kJ·mol-1
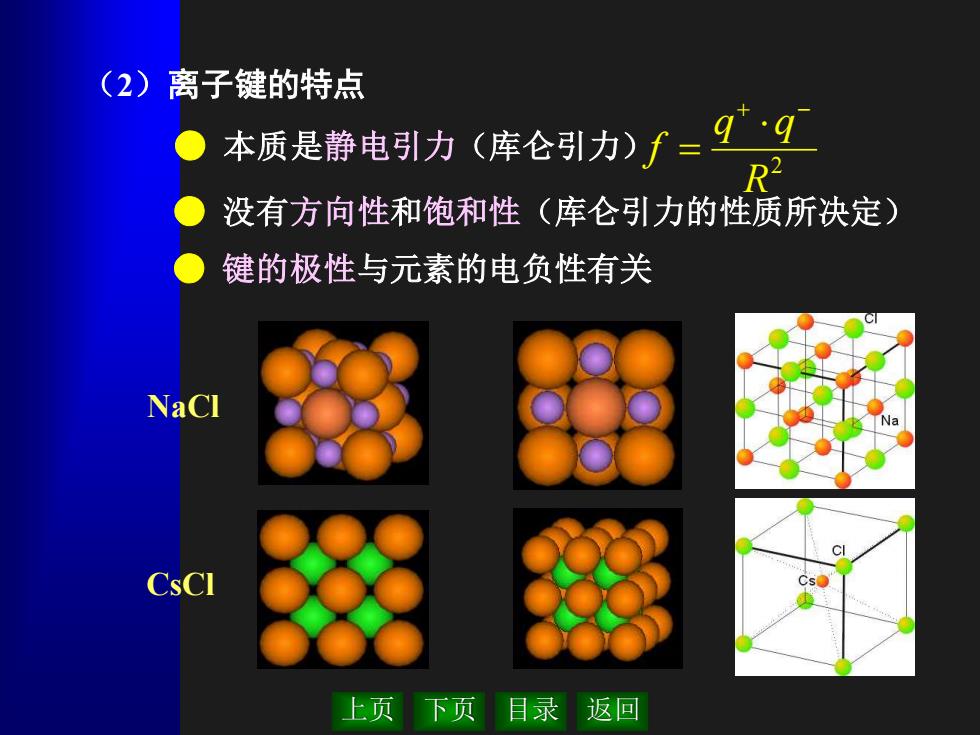
(2)离子键的特点 本质是静电引力(库仑引力)/=9·9 没有方向性和饱和性(库仑引力的性质所决定) 键的极性与元素的电负性有关 NaCl 9 CsCI 上页下页目录返回
上页 下页 目录 返回 (2)离子键的特点 ● 本质是静电引力(库仑引力) ● 没有方向性和饱和性(库仑引力的性质所决定) ● 键的极性与元素的电负性有关 2 R q q f + − = NaCl CsCl
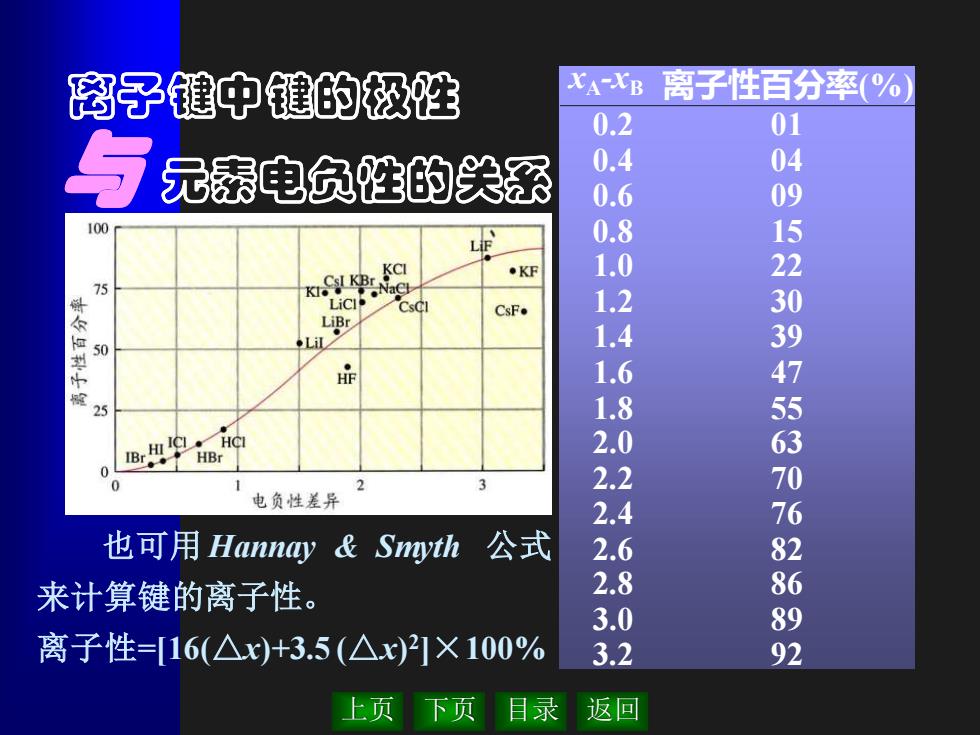
离子建中键的极性 XA-XB 离子性百分率(% 0.2 01 元泰电负性的关系 0.4 04 0.6 09 100 0.8 15 .KF 1.0 22 75 Csc CsF. 1.2 30 LiBr 50 ◆L 1.4 39 扉 1.6 4 25 1.8 5 ®r9的 2.0 63 0 0 2 2.2 电负性差异 2.4 也可用Hannay&Smyth 公式 2.6 来计算键的离子性。 2.8 3.0 0728382 离子性=16(△x)+3.5(△x)21×100% 3.2 上页 下页 目录 返回
上页 下页 目录 返回 也可用 Hannay & Smyth 公式 来计算键的离子性。 离子性=[16(△x)+3.5 (△x) 2 ]×100% xA-xB 离子性百分率(%) 0.2 0.4 0.6 0.8 1.0 1.2 1.4 1.6 1.8 2.0 2.2 2.4 2.6 2.8 3.0 3.2 01 04 09 15 22 30 39 47 55 63 70 76 82 86 89 92 离子键中键的极性 与 元素电负性的关系

(3)晶格能(lattice energy) ◆定义1mol的离子晶体解离为自由气态离子时所吸收 的能量,以符号U表示。 MX (S) →M(g)+X(g) 作用度量离子键的强度。晶格类型相同时,与正、 负离子电荷数成正比,与离子间距离成反比。 化合物 离子电荷 ropm △UU/kJmo1 t(m.p.)/℃ NaF +1,-1 231 923 993 NaCl +1,-1 282 786 801 NaBr +1,-1 298 747 747 Nal +1,-1 323 704 661 MgO +2,-2 210 3791 2852 Cao +2,-2 240 3401 2614 SrO +2,-2 257 3223 2430 BaO +2,-2 256 3054 1918 上页 下页 目录 返回
上页 下页 目录 返回 (3 )晶格能 (lattice energy) ◆ 定义 1mol 的离子晶体解离为自由气态离子时所吸收 的能量,以符号U 表示。 ◆ 作用 度量离子键的强度。晶格类型相同时,U与正、 负离子电荷数成正比,与离子间距离r0成反比。 MX (S) M+ (g) + X- (g) 993 801 747 661 2 852 2 614 2 430 1 918 +1,-1 +1,-1 +1,-1 +1,-1 +2,-2 +2,-2 +2,-2 +2,-2 231 282 298 323 210 240 257 256 923 786 747 704 3 791 3 401 3 223 3 054 化合物 离子电荷 ro /pm ΔU/kJ·mol-1 t (m. p.)/℃ NaF NaCl NaBr NaI MgO CaO SrO BaO