第三章络合滴定法
2024/9/30 1 第三章 络合滴定法

>络合滴定法:又称配位滴定法 以生成配位化合物(络合物)为基础的滴定分析方 法。 例如,用AgNO,标准溶液滴定氰化物时,Ag与 CN络合,形成难离解的[Ag(CN)2络离子(K形= 1021)的反应,就可用于络合滴定。反应如下: Ag++2CN-=Ag[(CN)2] 2024/9/30 2
2024/9/30 2 ➢ 络合滴定法: 又称配位滴定法 以生成配位化合物(络合物)为基础的滴定分析方 法。 例如,用AgNO3标准溶液滴定氰化物时,Ag+与 CN-络合,形成难离解的[Ag(CN)2 ] -络离子(K形= 1021)的反应,就可用于络合滴定。反应如下: Ag+ + 2CN- = Ag[(CN)2 ] -

本章主要内容提要 : 口EDTA与金属离子络合物 0 副反应系数和条件稳定常数 础以 口络合滴定法的基本原理 口金属指示剂 口提高络合滴定选择性的途径 ▣络合滴定法应用示例 2024/9/30
2024/9/30 3 本章主要内容提要: ❑ EDTA与金属离子络合物 ❑ 副反应系数和条件稳定常数 ❑ 络合滴定法的基本原理 ❑ 金属指示剂 ❑ 提高络合滴定选择性的途径 ❑ 络合滴定法应用示例 以 配 位 反 应 为 基 础 的 滴 定 分 析 法

§3-1,分析化学中常用的络合物 一、简单络合物 口由中心离子和单基配位体(ligand)形成化合物。 如:AgNH3)2。 口单基配位体:是指一个配位体和中心原子只以 一个配键结合。如:NH3一Ag一NH3 口特点:简单络合物常逐级配位形成逐级络合物, 逐级稳定常数较接近,由于稳定性较差,平衡时 以多种配位形式同时存在,因而限制了其用于滴 定分析,但可作掩蔽剂、显色剂和指示剂等。 2024/9/30
2024/9/30 4 §3-1 分析化学中常用的络合物 一、简单络合物 ❑ 单基配位体:是指一个配位体和中心原子只以 一个配键结合。如:NH3—Ag—NH3 ❑ 特点:简单络合物常逐级配位形成逐级络合物, 逐级稳定常数较接近,由于稳定性较差,平衡时 以多种配位形式同时存在,因而限制了其用于滴 定分析,但可作掩蔽剂、显色剂和指示剂等。 ❑ 由中心离子和单基配位体(ligand)形成化合物。 如:Ag(NH3 )2 +

简单络合物: K稳= [ML] M+L=ML [M][L] K稳2 [ML2] ML+L=ML2 [ML]IL] MLOn-1)+L=MLn K稳. [ML,] [ML-]L] 滴定剂只有以CN为配位剂的氰量法和以 Hg2+为中心离子的汞量法。 2CN-+Ag+台Ag(CN)2Hg2++2CI台HgC12 4CN-+Wi2+台Ni(CW)}Hg2++2SCN-台HB(SCW)2 2024/9/30
2024/9/30 5 ◼ 滴定剂只有以CN-为配位剂的氰量法和以 Hg2+为中心离子的汞量法。 − + − − + − + + 2 4 2 2 4 ( ) 2 ( ) CN Ni Ni CN CN Ag Ag CN 2 2 2 2 2 ( ) 2 Hg SCN Hg SCN Hg Cl HgCl + + + − + − ML n L MLn ML L ML M L ML + = + = + = ( −1) 2 简单络合物: [ ][ ] [ ] [ ][ ] [ ] [ ][ ] [ ] 1 2 2 1 ML L ML K ML L ML K M L ML K n n n − = = = 稳 稳 稳
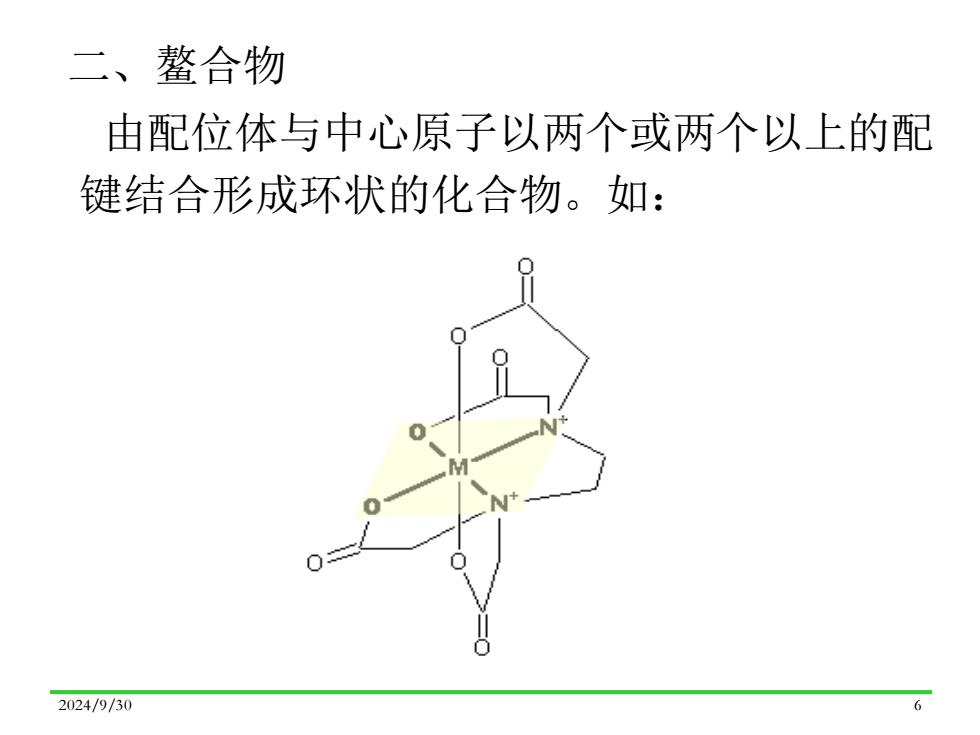
二、鳌合物 由配位体与中心原子以两个或两个以上的配 键结合形成环状的化合物。如: 2024/9/30 6
2024/9/30 6 二、鳌合物 由配位体与中心原子以两个或两个以上的配 键结合形成环状的化合物。如:

鳌合物的特点: 1、稳定性高, 2、对金属离子有一定的选择性。 鳌合物的类型: 1、00型鳌合物 2、NN型鳌合物 3、NO型鳌合物 4、含硫鳌合物:有SS型、SO型、SN型鳌合物. 2024/9/30
2024/9/30 7 鳌合物的特点: 1、稳定性高, 2、对金属离子有一定的选择性。 鳌合物的类型: 1、OO型鳌合物 2、NN型鳌合物 3、NO型鳌合物 4、含硫鳌合物:有SS型、SO型、SN型鳌合物

三、乙二胺四乙酸(EDTA) EDTA ethylenediamine tetraacetic acid 结构: OOCHC CH,COOH CHCCH.-CH.Cti.COOH 特点: 口含有4个羧基(硬碱)和2个氨基(中间碱),能与 许多金属离子形成鳌合物。当形成鳌合物时两个羧 基上的两个H+转移到N原子上,形成双极离子,因 而有6个配位原子,可形成5个五元螯合环。 2024/9/30
2024/9/30 8 三、乙二胺四乙酸(EDTA) ◼ EDTA:ethylenediamine tetraacetic acid ◼ 结构: CH COOH CH COOH N CH CH N HOOCH C HOOCH C 2 2 2 2 2 2 − − − ◼ 特点: ❑ 含有4个羧基(硬碱)和2个氨基(中间碱),能与 许多金属离子形成鳌合物。当形成鳌合物时两个羧 基上的两个H+转移到N原子上,形成双极离子,因 而有6个配位原子,可形成5个五元螯合环

双极离子 N-CH:-CH:-N<CH,COOH OOCH,C H+ CH,COO HOOCH,C 即:两个双极离子与 金属离子形成鳌合物, 一个双极离子与一个 羧基和金属离子形成 螯合物。EDTA配位 能力强,能与许多金属 离子形成稳定的螯合物。 2024/9/30
2024/9/30 9 即:两个双极离子与 金属离子形成鳌合物, 一个双极离子与一个 羧基和金属离子形成 鳌合物。EDTA配位 能力强,能与许多金属 离子形成稳定的螯合物。 双极离子 C H COOH C H COO N C H C H N HOOCH C OOCH C H H 2 2 2 2 2 2 − − − − − + +

EDTA的性质 口EDTA为氨羧配位剂,具有很强的配位 性能,是常用的配位滴定剂和掩蔽剂。 ▣EDTA(H4Y)溶解度小(22C时100mL水中溶解 0.02g),其二钠盐Na2H2Y2H,O)溶解度较大 (22℃时100mL水中溶解11.1g),溶液浓度约为 0.3molL1,pH约为4.4。因而常把EDTA的二钠盐 称为EDTA 2024/9/30 10
2024/9/30 10 ❑ EDTA为氨羧配位剂,具有很强的配位 性能,是常用的配位滴定剂和掩蔽剂。 ❑ EDTA(H4Y)溶解度小(22ºC时100mL水中溶解 0.02g) , 其 二 钠 盐 (Na2H2Y•2H2O) 溶 解 度 较 大 ( 22ºC时100mL水中溶解11.1g),溶液浓度约为 0.3mol·L-1 ,pH约为4.4。因而常把EDTA的二钠盐 称为EDTA EDTA的性质