
第7章 配位化合物 dth Coordination Competals
Chapter 7 Coordination Compounds 第 7 章 配位化合物

7.1相关的定义和命名 The relating definitions and nomenclature 7.2化学键理论 Chemical bond theory 7.3异构现象与立体化学 Isomerism and stereochemistry 7.41 配合物的稳定性 Stability of the complex 7.5配合物的应用 Apllication of the complex 章首 结束
7.1 相关的定义和命名 7.2 化学键理论 7.3 异构现象与立体化学 7.4 配合物的稳定性 7.5 配合物的应用 The relating definitions and nomenclature Chemical bond theory Isomerism and stereochemistry Stability of the complex Apllication of the complex
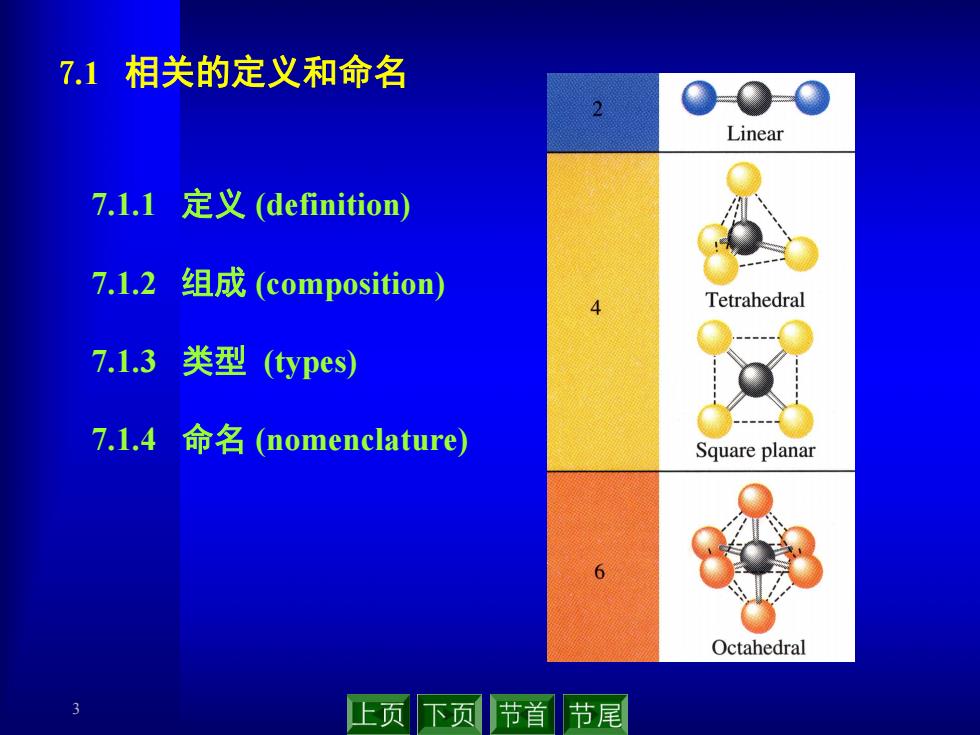
7.1相关的定义和命名 0-0-0 Linear 7.1.1定义(definition) 7.1.2组成(composition) Tetrahedral 7.1.3 类型(ypes 7.1.4命名(nomenclature) Square planar Octahedral 上页下节首节尾
3 7.1.1 定义 (definition) 7.1.2 组成 (composition) 7.1.3 类型 (types) 7.1.4 命名 (nomenclature) 7.1 相关的定义和命名

7.1.1定义(definition) 配合物可看成是一类由简单化合物反应生成的复杂化合物: CuSO+4NH3===[Cu(NH3)41SO 产物1) 3NaF +AIF3===Na3[AIFG] (产物2) SiF +2 HF ==H2[SiF (产物3) Ni +4 CO==Ni(CO)4] 产物4) KzS04+Al2(S043+24H20==2KA1(S0212H,O (产物5 显然,这些产物中: ● 都存在一个“配位个体” “配位个体”相对稳定,既可存在于晶体中,也可存在于溶液 中 ●与“复盐(double salts)不同,但又无绝对的界线. 上页下页 节首 节尾
4 7.1.1 定义 (definition) CuSO4 + 4 NH3 === [Cu(NH3)4]SO4 (产物1) 3NaF + AlF3 === Na3[AlF6] (产物2) SiF4 + 2 HF === H2[SiF6] (产物3) Ni + 4 CO === [Ni(CO)4] (产物4) 配合物可看成是一类由简单化合物反应生成的复杂化合物: ● 都存在一个“配位个体”. ● “配位个体”相对稳定,既可存在于晶体中,也可存在于溶液 中. ● 与“复盐 (double salts) 不同,但又无绝对的界线. K2SO4 +Al2(SO4)3+24 H2O === 2 KAl(SO4)2·12H2O (产物5) 显然,这些产物中:

配位化学的奠基人一维尔纳 1883年供职于苏黎世大学的Verner A提出 了天才的见解,被后人称之为维尔纳学说 大多数化学元素表现出两种类型的化合 价,即主价和副价 元素形成配合物时倾向于主价和副价都 能得到满足 元素的副价指向空间确定的方向 NH2 CI 维尔纳(Verner,A,1866一1919) H3N、 NH CI 瑞士无机化学家.因创立配位化学而获得 HN NH; NH3 1913年诺贝尔化学奖 上页 下页 节首节尾
5 配位化学的奠基人——维尔纳 ● 大多数化学元素表现出两种类型的化合 价,即主价和副价 ● 元素形成配合物时倾向于主价和副价都 能得到满足 ● 元素的副价指向空间确定的方向 1883年供职于苏黎世大学的Werner A 提出 了天才的见解,被后人称之为维尔纳学说. 维尔纳 (Werner, A, 1866—1919) 瑞士无机化学家.因创立配位化学而获得 1913年诺贝尔化学奖 Co NH3 Cl Cl Cl NH3 NH3 NH3 H3N H3N

7.1.2组成(composition)) 配位单元:由一个简单阳离子或原子和一定数目的中性分子或阴 离子以配位键结合,按一定的组成和空间构型形成一 个复杂的离子或分子形成的离子称为配离子,形成的 分子称为配分子. 配合物:由配离子与带有相反电荷的离子组成的电中性化合物 以及不带电荷的配分子本身 配分子:N(CO)4, [CoCI3(NH3)3] 配离子:BF, [Fe(CN。],【CoNH3)s(H2O)P,[CuNH3)4P 配合物:配酸HBF4 配盐K4[Fe(CN)6],【CoNH3)sH2OIl3 配碱 Cu(NH3)4(OH)2 止页下页 节首 节尾
6 配位单元:由一个简单阳离子或原子和一定数目的中性分子或阴 离子以配位键结合,按一定的组成和空间构型形成一 个复杂的离子或分子.形成的离子称为配离子,形成的 分子称为配分子. 配 合 物:由配离子与带有相反电荷的离子组成的电中性化合物 以及不带电荷的配分子本身. 7.1.2 组成 (composition) 3 4 2 4 6 3 5 2 3 4 2 3 4 3 3 5 2 4- 4 6 4 3 3 3 Cu(NH ) (OH) K Fe(CN) , Co(NH ) (H O) Cl HBF BF , Fe(CN) , Co(NH ) (H O) , Cu(NH ) Ni(CO) , CoCl (NH ) 配碱 配盐 配合物:配酸 配离子: 配分子:

(1)内界与外界 [AgNH,)月]oI Ni(CO) [CoCI;(NH:);] 忠 外 中心原子 中心离子 体 配离子 形成体一中心离子或原子(central ion or central atom) (配分子) 配位体一中性分子或阴离子 形成体一提供空轨道 电子对接受体Lewisi酸 配位体一 提供孤对电子 电子对给予体Lewis碱 上页下页 节首节尾
7 3 2 4 3 3 3 Ag(NH ) Cl Ni(CO) CoCl (NH ) ← 中 心 离 子 ← 中 心 离 子 ← 中 心 原 子 ← 配 位 体 ← 外 界 ← 配 位 体 配 位 体 形成体 — 中心离子或原子(central ion or central atom) 配位体 — 中性分子或阴离子 配离子 (配分子) 形成体 — 提供空轨道 电子对接受体 Lewis酸 配位体 — 提供孤对电子 电子对给予体 Lewis碱 (1) 内界与外界

(2)形成体 正离子(多) 中性原子(少) Fe(CO)s Ni(CO) ( 金属元素(多) 非金属元素(少) BF SiF 常见金属离子的配位数 1价金属离子 2价金属离子 3价金属离子 Cu+ 2,4 Ca2+ 6 AB+ 4,6 Ag" 2 Mg2+ 6 Cr3+ 6 Au+ 2,4 Fe2+ 6 Fe3+ 6 C02+ 4,6 C03+ 6 Cu2+ 4,6 Au3+ 4 Zn2+ 4,6 下页 节首 节尾
8 正离子(多) 中性原子(少) Fe(CO)5 , Ni(CO)4 金属元素(多) 非金属元素(少) 2 4 S 6 BF iF (2) 形成体 常见金属离子的配位数 1价金属离子 2价金属离子 3价金属离子 Cu+ 2,4 Ca2+ 6 Al3+ 4,6 Ag+ 2 Mg2+ 6 Cr 3+ 6 Au+ 2,4 Fe 2+ 6 Fe 3+ 6 Co2+ 4,6 Co3+ 6 Cu2+ 4,6 Au3+ 4 Zn2+ 4,6

(3)配体和配位原子 负离子 X-SCN-C,O CN- 配位体 中性分子H,ONH,CO en 配位原子:配位体中与中心离子(或原子)直接键合的原子 。单齿配体:一个配体中只含一个配位原子 XQH(羟基) CN-SCN(硫氰根) CO(羰基 NO(硝基)H2ONH3NCS(异硫氰根) ●多齿配体:一个配体中含有多个配位原子 ●二齿配体:例如,乙二胺(en)HN一CH,一CH,一NH2 乙二酸根(草酸根)C,O ●六齿配体: 乙二胺四乙酸根EDTA(Y4-) DT 止页下页节首节尾
9 配位体 H O NH CO en X SCN C O CN 2 3 2 2 4 中性分子 负离子 配位原子:配位体中与中心离子(或原子)直接键合的原子. ● 单齿配体: 一个配体中只含一个配位原子. N O H O N H N CS X O H C N SCN C O (2 硝基) 2 3 (异硫氰根) (羟基) (硫氰根) (羰基) (3) 配体和配位原子 ● 多齿配体: 一个配体中含有多个配位原子 ● 二齿配体:例如,乙二胺(en)H2 N CH2 CH2 NH2 乙二酸根(草酸根) 2 C2O4 O O C C O O • • • • 2– ● 六齿配体:乙二胺四乙酸根 EDTA(Y4-)

(④)配位数及电荷 ●与中心离子(或原子)成键(没有强调配位键)的配位原子的总数 配位数=∑配位体的数目×齿数 单齿配体 Cu(NH3)4 4 PtCI (NH3 3+1=4 多齿配体 【coCl2(en)2]P 2+2×2=6 [AIC2O)] 3×2=6 [Ca(EDTA)P- 1×6=6 ●配离子与形成体的电荷数 (+ (+ Ag(S203)2 Pt Cl3(NH3) (+3) (+2) K3 Fe(CN)6 赤血盐, Fe(CN)6 黄血盐 (+3) (0) Co Cl3(NH3)3 Fe(CO)s 10 上页 下页 节首 节尾
10 配位数 配位体 i的数目齿数 Ca(EDTA) 1 6 6 Al(C O ) 3 2 6 CoCl (en) 2 2 2 6 PtCl (NH ) 3 1 4 Cu(NH ) 4 2 3 2 4 3 2 2 2 3 3 4 3 多齿配体 单齿配体 ● 与中心离子(或原子)成键(没有强调配位键)的配位原子的总数 (4) 配位数及电荷 ● 配离子与形成体的电荷数 5 (0) 3 3 3 ( 3) 6 ( 2) 6 4 ( 3) 3 3 3 ( 2) 3 2 3 2 ( ) Co Cl (NH ) , Fe(CO) K Fe (CN) , K Fe (CN) Ag(S O ) , Pt Cl (NH ) 赤血盐 黄血盐