
第13章 p区元素(一) Chapter 13 p-block elements (一)
p区元素(一) 第13章
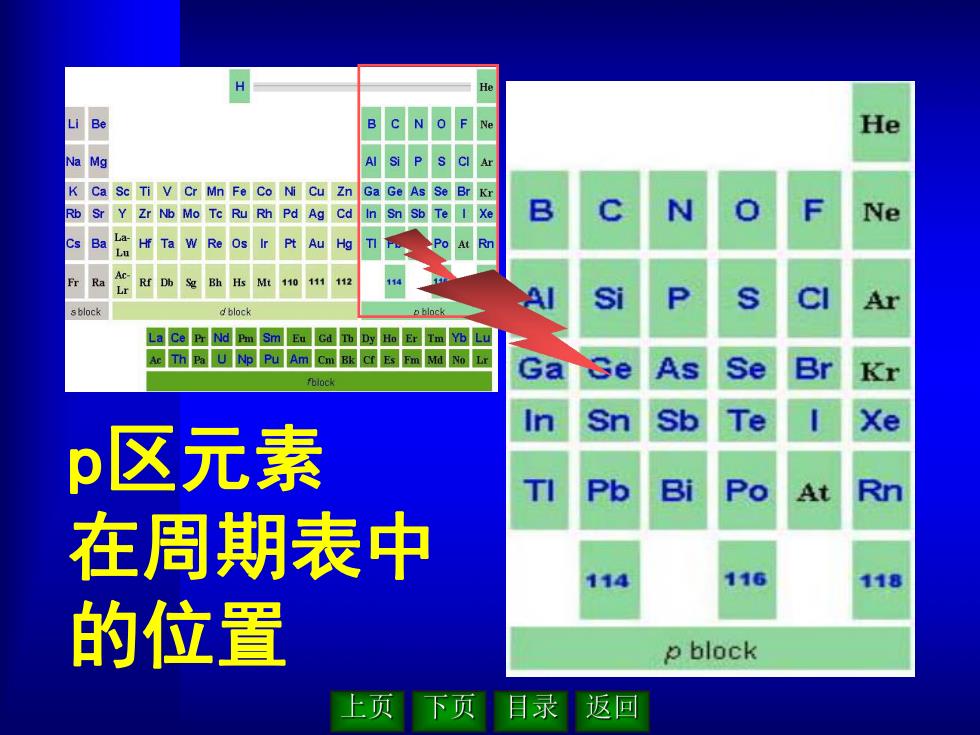
He B C N O F He Mg K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te 1 xe B Ne c Ba La- Hf Ta w Re Ir Pt Au Hg Ra Ac- Rr Db Mt110111112 sblock dblock Lace压Nd Pm Sm Eu Gd面四aE留mo回 A五Pu AmCm@国mMa p区元素 Pb B引 Rn 在周期表中 114 116 118 的位置 p block 上页下页 目录 返回
p区元素 在周期表中 的位置

本章教学要求 1.了解p区元素的特点; 2.了解p区元素的存在、制备及用途; 3.掌握重点元素硼、铅、碳、硅、氮和磷的 单质及其化合物的性质,会用结构理论和 热力学解释它们的某些化学现象; 4.从正硼烷的结构了解缺电子键和硼烷结构; 5.了解一些无机材料的制备和用途; 6. 了解惰性电子对效应概念及其应用。 上页 目录 返回
1.了解 p 区元素的特点; 6.了解惰性电子对效应概念及其应用。 5.了解一些无机材料的制备和用途; 4.从正硼烷的结构了解缺电子键和硼烷结构; 3.掌握重点元素硼、铅、碳、硅、氮和磷的 单质及其化合物的性质,会用结构理论和 热力学解释它们的某些化学现象; 2.了解 p 区元素的存在、制备及用途; 本章教学要求

13.1 第13、14、15族元素概述 Generality of the groups 13-15 章内容 elements 13.2 硼Boron 13.3铝Aluminum 13.4 碳Carbon13.5硅 Silicon 13.6 氮Nitrogenl.3.7磷Phosphorus 13.8 长周期元素的重要化学现象及重 要反应 The important chemical phenomenons reactions of long -period elements 上页 下页目录返回
13.1 第13、14、15族元素概述 Generality of the groups 13-15 elements 13.2 硼 Boron 13.3 铝 Aluminum 13.4 碳 Carbon 13.5 硅 Silicon 13.6 氮 Nitrogen13.7 磷 Phosphorus 13.8 长周期元素的重要化学现象及重 要反应 The important chemical phenomenons & reactions of long -period elements

P区元素的化学以其多学性为特点 ●唯一同时包括金属和非金属元素的一个区 。无机非金属材料库: 人造金刚石 碳碳复合料(隐形飞机) 高能燃料 ranoFET WW D 光子带隙材料 硅单晶材料 纳米半导体材料 太阳能电池材料 上页 下页 返回
● 唯一同时包括金属和非金属元素的一个区 ● 无机非金属材料库: P区元素的化学以其多样性为特点 分子筛 人造金刚石 高能燃料 纳米半导体材料 太阳能电池材料 光子带隙材料

多样性 diversity diversity ● 包括“不活泼的单原子气体—稀有气体” ●有毒的小元素群 ●多有同素异形体 ●成键的多样性:如乙硼烷的3c-2e键等 ●周期表中的规律性:惰性电子对效应,对角线规则等 Ga Ge AS Se 有益微量元素 In Sn Sb Te 可能是有益微量元素 TI Pb Bi Po 上页 下页 目录返回
● 有毒的小元素群 ● 多有同素异形体 ● 成键的多样性:如乙硼烷的 3c-2e 键等 ● 周期表中的规律性:惰性电子对效应,对角线规则等 ● 包括 “不活泼的单原子气体——稀有气体” 有益微量元素 可能是有益微量元素

13.1第13、14、15族元素概述 Generality of the groups 13-15 elements 1.金属性 总的变化规律是由上而下逐渐增强 35 As,SbBi的电导率 229 26 Ga2 24 温度/℃ 22 0 k(As)/(kS.cm-1)35 38 k(Sb)/(kS.cm-1)24 26 9.58.6 k(Bi)/(kS.cm-1)8.6 9.5 Sb Bi ● 金属铋由液态变为固态 元素 Al Ga In 时体积膨胀而不是缩小 m.p./C 660 30 157303 上页 下页 目录 返回
13.1 第13、14、15族元素概述 Generality of the groups 13-15 elements 1. 金属性 总的变化规律是由上而下逐渐增强 温度 / ℃ 22 0 k(As)/(kS·cm-1) 35 38 k(Sb)/(kS·cm-1) 24 26 k(Bi)/(kS·cm-1) 8.6 9.5 As, Sb Bi 的电导率 ● 金属铋由液态变为固态 时体积膨胀而不是缩小 Al Ga In Tl m.p./℃ 660 30 157 元素 303 ● Ga2
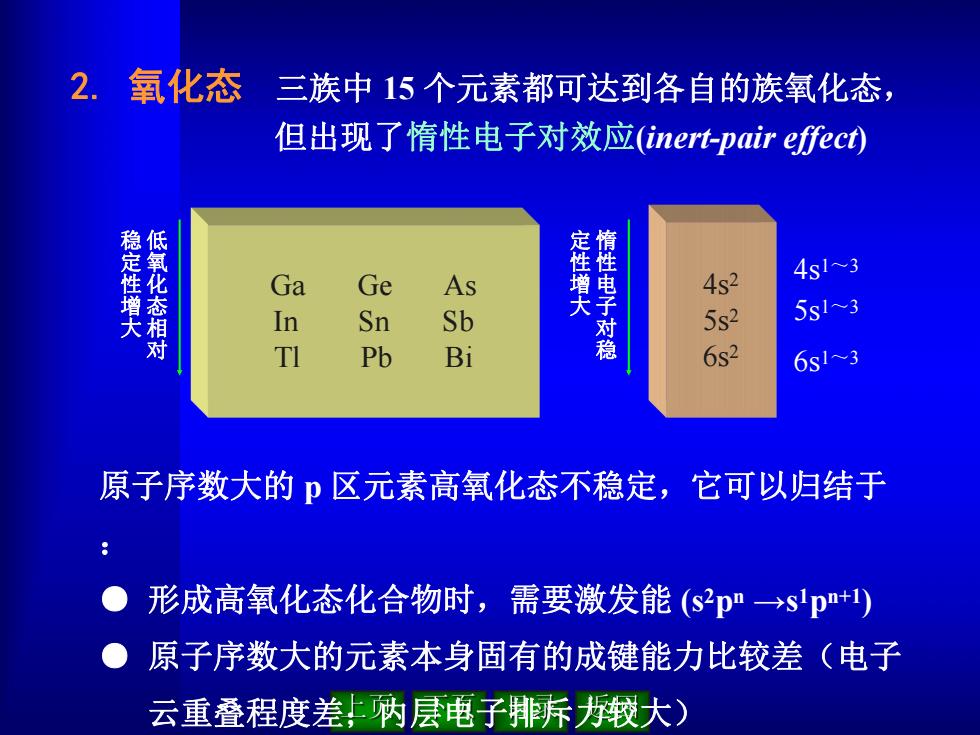
2.氧化态 三族中15个元素都可达到各自的族氧化态, 但出现了惰性电子对效应(inert-pair effect) 稳定性增大 低氧化态相对 4s1~3 Ga Ge As 定性增大 4s2 In Sn Sb 性电子对稳 5s2 5s13 ti Pb Bi 6s2 6s13 原子序数大的p区元素高氧化态不稳定,它可以归结于 ● 形成高氧化态化合物时,需要激发能(s2pn→slp+) 。原子序数大的元素本身固有的成键能力比较差(电子 云重叠程度差上内层电子排诉缎大)
2. 氧化态 三族中 15 个元素都可达到各自的族氧化态, 但出现了惰性电子对效应(inert-pair ef ect) 原子序数大的 p 区元素高氧化态不稳定,它可以归结于 : ● 形成高氧化态化合物时,需要激发能 (s 2pn →s 1pn+1) ● 原子序数大的元素本身固有的成键能力比较差(电子 云重叠程度差;内层电子排斥力较大) Ga Ge As In Sn Sb Tl Pb Bi 低 氧 化 态 相 对 稳 定 性 增 大 4s 2 5s 2 6s 2 4s 1~3 5s 1~3 6s 1~3 惰 性 电 子 对 稳 定 性 增 大
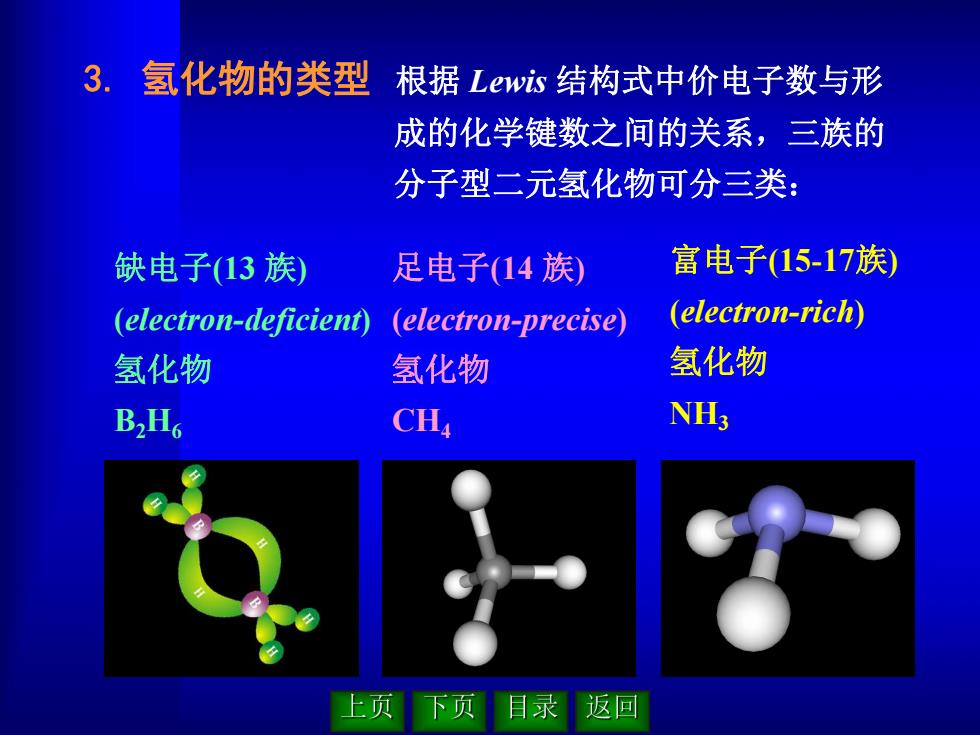
3.氢化物的类型 根据Lewis结构式中价电子数与形 成的化学键数之间的关系,三族的 分子型二元氢化物可分三类: 缺电子(13族)》 足电子(14族 富电子(15-17族 (electron-deficient) (electron-precise) (electron-rich) 氢化物 氢化物 氢化物 B2H6 CH NH; 上页 下页目录 返回
3. 氢化物的类型 根据 Lewis 结构式中价电子数与形 成的化学键数之间的关系,三族的 分子型二元氢化物可分三类: 缺电子(13 族) (electron-deficient) 氢化物 B2H6 足电子(14 族) (electron-precise) 氢化物 CH4 富电子(15-17族) (electron-rich) 氢化物 NH3
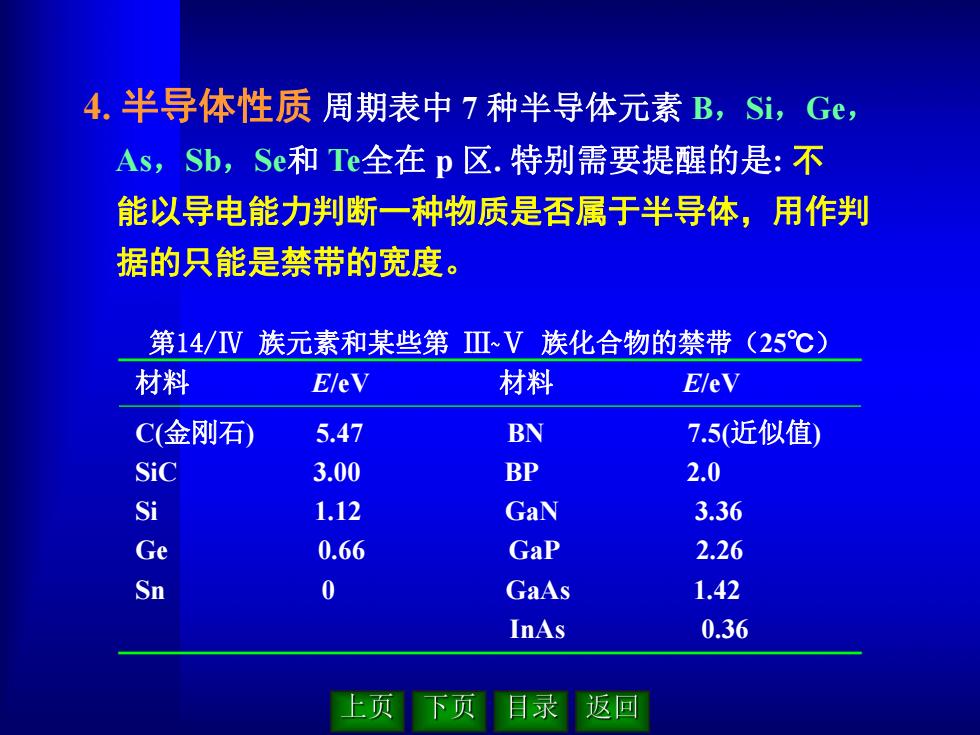
4.半导体性质周期表中7种半导体元素B,Si,Ge, As,Sb,Se和Te全在p区.特别需要提醒的是:不 能以导电能力判断一种物质是否属于半导体,用作判 据的只能是禁带的宽度。 第14/V族元素和某些第ⅢV族化合物的禁带(25℃) 材料 E/eV 材料 EleV C(金刚石) 5.47 BN 7.5(近似值) Sic 3.00 BP 2.0 Si 1.12 GaN 3.36 Ge 0.66 GaP 2.26 Sn 0 GaAs 1.42 InAs 0.36 上页 下页 目录返回
4. 半导体性质 周期表中 7 种半导体元素 B,Si,Ge, As,Sb,Se和 Te全在 p 区. 特别需要提醒的是: 不 能以导电能力判断一种物质是否属于半导体,用作判 据的只能是禁带的宽度。 第14/Ⅳ 族元素和某些第 Ⅲ~Ⅴ 族化合物的禁带(25℃) 材料 E/eV 材料 E/eV C(金刚石) 5.47 BN 7.5(近似值) SiC 3.00 BP 2.0 Si 1.12 GaN 3.36 Ge 0.66 GaP 2.26 Sn 0 GaAs 1.42 InAs 0.36