
第16章 f区元素 Chapter 16 f-Block Elements
第16章 f区元素
C N O F Ne B Si P S CI Ar f区元素 Ca Sc TI V Cr Mn Fe Co NI Cu Zn Ga Ge As Se Br Kr Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Rn 在周期表 sbhoc La Ce Pr Nd p.om Fcd Th D成oxTm6o 知国国uM文Ua面醒国maa证 中的位置 a Ce Pr Nd Pm Sm E Gd Tb Ho Yb Np Pu Am Cm Bk Es m Md fblock 上页 下页目录 返回
f区元素 在周期表 中的位置

本章教学要求 1.熟悉镧系元素的电子结构、名称,镧系收缩概 念及其产生的原因和影响; 2.了解镧系元素的存在,制备及用途; 3.重点掌握镧系元素氧化物,氢氧化物的性质; 4. 了解镧系元素的分离方法,特别注意溶剂萃取 法及离子交换法的原理; 5. 简单了解锕系元素电子结构、名称及与镧系元 素的相似性。 上页 下页 自录 返回
1.熟悉镧系元素的电子结构、名称,镧系收缩概 念及其产生的原因和影响; 5. 简单了解锕系元素电子结构、名称及与镧系元 素的相似性。 4.了解镧系元素的分离方法,特别注意溶剂萃取 法及离子交换法的原理; 3.重点掌握镧系元素氧化物,氢氧化物的性质; 2.了解镧系元素的存在,制备及用途; 本章教学要求

本章内容 16.1 镧系元素 Lanthanides 16.2 钢系元素简介 Introduction of actinides 上页 下页目录返回
16.1 镧系元素 Lanthanides 16.2 锕系元素简介 Introduction of actinides

16.1 闲系元素 Lanthanides 16.1.1 基本性质概述 Generality of basic properties 16.1.2 重要化合物 Important compounds 16.1.3 镧系元素的相互分离 Interseparation lanthanides 16.1.4 存在、提取和应用Occurrence, abstraction and applications 上页 下页 目录 返回
16.1 镧系元素 Lanthanides 16.1.1 基本性质概述 Generality of basic properties 16.1.2 重要化合物 Important compounds 16.1.3 镧系元素的相互分离 Interseparation lanthanides 16.1.4 存在、提取和应用Occurrence, abstraction and applications

有关F区元素定义的争论仍在继续 一种意见将镧系和锕系分别界定为La之后的14种 元素和Ac之后的14种元素,结果是镧系不包括La而 锕系不包括Ac。 另一种意见是镧系应包括La而锕系应包括Ac,各 有15个元素。 这都与f电子的填充有关。 Ce Sm Eu Gd Th Ho Er Tm Yb Ac Th Pu m Md 上页 下页 目录 返回
一种意见将镧系和锕系分别界定为 La 之后的 14 种 元素和 Ac 之后的 14 种元素,结果是镧系不包括 La 而 锕系不包括 Ac 。 另一种意见是镧系应包括 La 而锕系应包括 Ac , 各 有 15 个元素。 这都与 f 电子的填充有关

稀士”一别致有趣的名字 Rare Earth Rare Earth 稀土的英文是Rare Earth,18世纪得名,“稀”原 指稀贵,“土”是指其氧化物难溶于水的“土”性。 其实稀土元素在地壳中的含量并不稀少,性质也不象土 ,而是一组活泼金属,“稀土”之称只是一种历史的习 惯。 根据IUPAC推荐,把57至71的15个元素称为镧 系元素,用Ln表示,它们再加上21号的Sc和39号的 Y称为稀土元素,用RE表示 下页 自录 返回
稀土的英文是 Rare Earth,18 世纪得名, “稀”原 指稀贵, “土” 是指其氧化物难溶于水的 “土” 性。 其实稀土元素在地壳中的含量并不稀少,性质也不象土 ,而是一组活泼金属, “稀土” 之称只是一种历史的习 惯 。 根据 IUPAC 推荐,把 57 至 71 的 15 个元素称为镧 系元素,用Ln 表示 ,它们再加上 21 号的 Sc 和 39 号的 Y 称为稀土元素,用 RE 表示 。 “稀土”— 别致有趣的名字 Rare Earth Rare Earth “

16.1.1 基本性质概述 1.镧系元素的分组 57Las8Ce59Pr60Nd 61Pm 62Sm 63Eu 64Gd 65Tb 66Dy 67Ho68Er69Tm70Yb7Lu 镧铈错钕钷钐铕钆铽镝钬铒铥镱镥 轻稀土组 重稀土组 轻稀土组 中稀土组 重稀土组 另有四分组: 57La58Ce59Pr60Nd 61Pm 62Sm 63Eu 64G 镧铈错钕 64Gd 65Tb 66Dy 67H068Er69Tm70Yb71Lu 钆 钺 镝 钬铒铥镱镥 上页下页 目录返回
1. 镧系元素的分组 钆 铽 镝 钬 铒 铥 镱 镥 另有四分组: 57La58Ce 59Pr 60Nd 镧 铈 镨 钕 钷 钐 铕 钆 61Pm 62Sm 63Eu 64Gd 64Gd 65Tb 66Dy 67Ho68Er 69Tm70Yb71Lu 16.1.1 基本性质概述 轻稀土组 重稀土组 57La 58Ce 59Pr 60Nd 61Pm 62Sm 63Eu 64Gd 65Tb 66Dy 67Ho 68Er 69Tm70Yb 71Lu 镧 铈 镨 钕 钷 钐 铕 钆 铽 镝 钬 铒 铥 镱 镥 轻稀土组 中稀土组 重稀土组
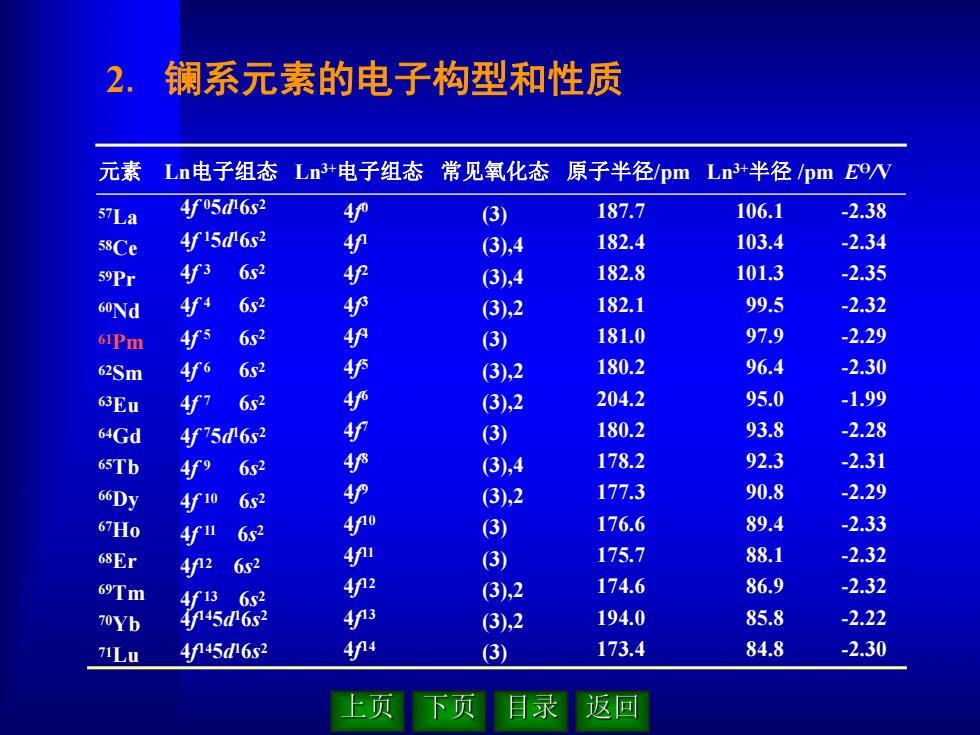
2.镧系元素的电子构型和性质 元素 Ln电子组态 L+电子组态常见氧化态 原子半径/pm Ln+半径/pm Eevv 57La 4f05d6s2 护 (3) 187.7 106.1 -2.38 58Ce 4f15d 6s2 4 (3),4 182.4 103.4 -2.34 59Pr 4r3 6s2 (3),4 182.8 101.3 -2.35 60Nd 4f4 6s2 4 (3),2 182.1 99.5 -2.32 61Pm 4fs 6s2 (3) 181.0 97.9 -2.29 62Sm 4f6 6s2 4护 (3),2 180.2 96.4 -2.30 63Eu 4f7 6s2 (3),2 204.2 95.0 -1.99 64Gd 4f75d6s2 4 (3) 180.2 93.8 -2.28 65Tb 4f9 6s2 (3),4 178.2 92.3 -2.31 66Dy 4f10 4护 (3),2 177.3 90.8 -2.29 67H0 4fu (3) 176.6 89.4 -2.33 68Er n 6s2 (3) 175.7 88.1 -2.32 69Tm (3),2 174.6 86.9 -2.32 4f13 6s2 70Yb 4f45d62 4P3 (3),2 194.0 85.8 -2.22 TLu 4P45d6s2 4f4 3) 173.4 84.8 -2.30 上页 下页 录 返回
2. 镧系元素的电子构型和性质 元素 Ln电子组态 Ln3+电子组态 常见氧化态 原子半径/pm Ln3+半径 /pm EӨ/V 57La 58Ce 59Pr 60Nd 61Pm 62Sm 63Eu 64Gd 65Tb 66Dy 67Ho 68Er 69Tm 70Yb 71Lu 4f 05d 16s 2 4f 15d 16s 2 4f 3 6s 2 4f 4 6s 2 4f 5 6s 2 4f 6 6s 2 4f 7 6s 2 4f 75d 16s 2 4f 9 6s 2 4f 10 6s 2 4f 11 6s 2 4f 12 6s 2 4f 13 6s 2 4f 145d 16s 2 4f 145d 16s 2 4f 0 4f 1 4f 2 4f 3 4f 4 4f 5 4f 6 4f 7 4f 8 4f 9 4f 10 4f 11 4f 12 4f 13 4f 14 (3) (3),4 (3),4 (3),2 (3) (3),2 (3),2 (3) (3),4 (3),2 (3) (3) (3),2 (3),2 (3) 187.7 182.4 182.8 182.1 181.0 180.2 204.2 180.2 178.2 177.3 176.6 175.7 174.6 194.0 173.4 106.1 103.4 101.3 99.5 97.9 96.4 95.0 93.8 92.3 90.8 89.4 88.1 86.9 85.8 84.8 -2.38 -2.34 -2.35 -2.32 -2.29 -2.30 -1.99 -2.28 -2.31 -2.29 -2.33 -2.32 -2.32 -2.22 -2.30

3.氧化态特征 镧系元素全部都能形成稳定的+3氧化态。 3 Ce Nd Pm Dy Ho Er Tm Ba2+ Sm Eu La3+(4f0),Gd3+(4f7)和Lu3+(4f14)处于稳定结构, 获得+2和+4氧化态是相当困难的;Ce3+(4f1)和 Tb3+(4f8)失去一个电子即达稳定结构,因而出现+4氧 化态;Eu+(4f6)和Yb3+(4f13)接受一个电子即达稳定结 构,因而易出现+2氧化态 上页下页目录 返回
3. 氧化态特征 镧系元素全部都能形成稳定的 + 3 氧化态。 La3+(4f 0), Gd3+(4f 7) 和 Lu3+(4f 14) 处于稳定结构, 获得 +2 和 +4 氧化态是相当困难的; Ce 3+ (4f 1 ) 和 Tb3+(4f 8) 失去一个电子即达稳定结构,因而出现 +4 氧 化态;Eu3+(4f 6) 和 Yb3+(4f 13) 接受一个电子即达稳定结 构,因而易出现 +2 氧化态