
第五节蛋白质的分离、纯化和表征 蛋白质的酸碱性质 二 蛋白质的胶体性质与蛋白质的沉淀 三 蛋白质相对分子质量的测定 四、蛋白质的分离纯化 五、蛋白质的分离纯化方法 六、蛋白质的含量测定与纯度鉴定 本节小结
2 第五节 蛋白质的分离、纯化和表征 一、蛋白质的酸碱性质 二、蛋白质的胶体性质与蛋白质的沉淀 三、蛋白质相对分子质量的测定 四、蛋白质的分离纯化 五、蛋白质的分离纯化方法 六、蛋白质的含量测定与纯度鉴定 本节小结
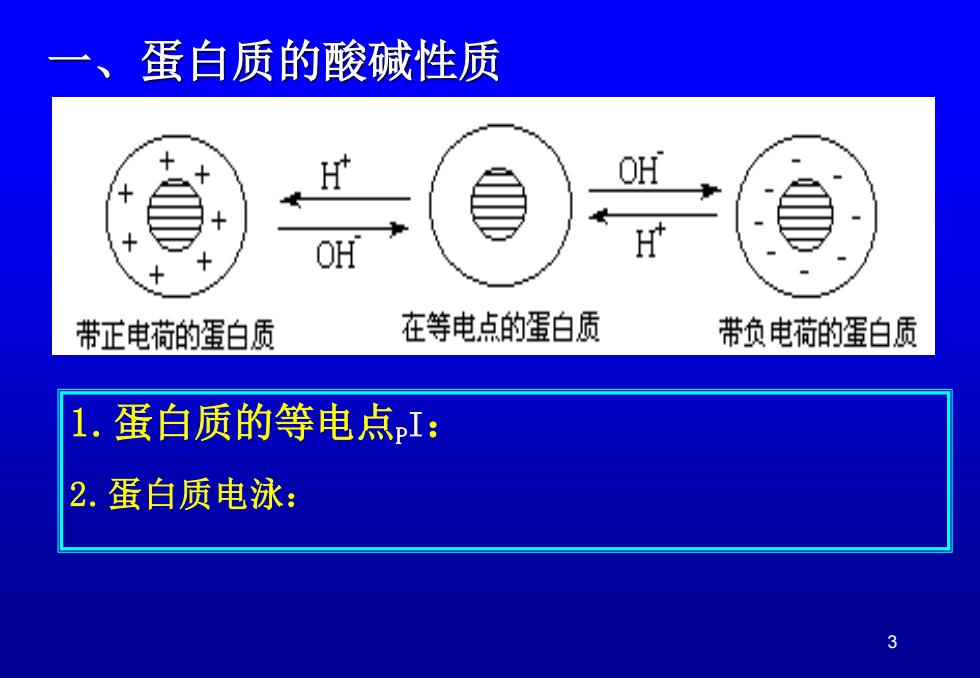
一、蛋白质的酸碱性质 OH OH 带正电荷的蛋白质 在等电点的蛋白质 带负电荷的蛋白质 1.蛋白质的等电点I: 2.蛋白质电泳: 3
3 一、蛋白质的酸碱性质 1.蛋白质的等电点PI: 2.蛋白质电泳:

二、蛋白质的胶体性质与蛋白质的沉淀 1.蛋白质溶液是胶体溶液 2.维持蛋白质的胶体系统稳定的因素 ●1一100nm大小的质点在动力学上是稳定的. ●某一pH下质点带有同种电荷,互相排斥。 ·质点能与溶剂(水)形成水化层,相互间不易靠拢
4 二、蛋白质的胶体性质与蛋白质的沉淀 1.蛋白质溶液是胶体溶液 2.维持蛋白质的胶体系统稳定的因素 ⚫1-100nm大小的质点在动力学上是稳定的. ⚫某一pH下质点带有同种电荷,互相排斥。 ⚫质点能与溶剂(水)形成水化层,相互间不易靠拢

蛋白质的沉淀作用 1.可逆沉淀: 2.不可逆沉淀: 3.沉淀蛋白质的方法 冬等电点沉淀(可逆,不变性)强酸碱沉淀(不可逆): 蛋白质的盐析(可逆,不变性):硫酸铵、硫酸钠、氯化钠。 ~有机溶剂沉淀蛋白质(可逆或不可逆):乙醇、丙酮或甲醇。 重金属盐和生物碱剂沉淀蛋白质:Hg2+、Ag2+、单宁酸、 苦味酸。 加热(变性)沉淀蛋白质:
5 蛋白质的沉淀作用 1.可逆沉淀: 2.不可逆沉淀: 3.沉淀蛋白质的方法 ❖等电点沉淀(可逆,不变性)强酸碱沉淀(不可逆): ❖蛋白质的盐析(可逆,不变性):硫酸铵、硫酸钠、氯化钠。 ❖有机溶剂沉淀蛋白质(可逆或不可逆):乙醇、丙酮或甲醇。 ❖重金属盐和生物碱剂沉淀蛋白质:Hg2+ 、Ag2+、单宁酸、 苦味酸。 ❖加热(变性)沉淀蛋白质:

三、蛋白质相对分子质量的测定 1.根据化学组成测定最低相对分子质量 X(某.)的原子量 最低相对分子质量= ×100 Y(某.)的百分含量 例1:肌红蛋白和血红蛋白含铁量均为0.335%,计算二者的相对分 子质量。 例2:一种纯酶按重量计算含亮氨酸1.65%和异亮氨酸2.48%,问 其最低相对分子质量? 2.沉降法(超速离心法)
6 三、蛋白质相对分子质量的测定 1.根据化学组成测定最低相对分子质量 例1:肌红蛋白和血红蛋白含铁量均为0.335%,计算二者的相对分 子质量。 例2:一种纯酶按重量计算含亮氨酸1.65%和异亮氨酸2.48%,问 其最低相对分子质量? 2. 沉降法(超速离心法) X(某.)的原子量 Y(某.)的百分含量 最低相对分子质量= ×100
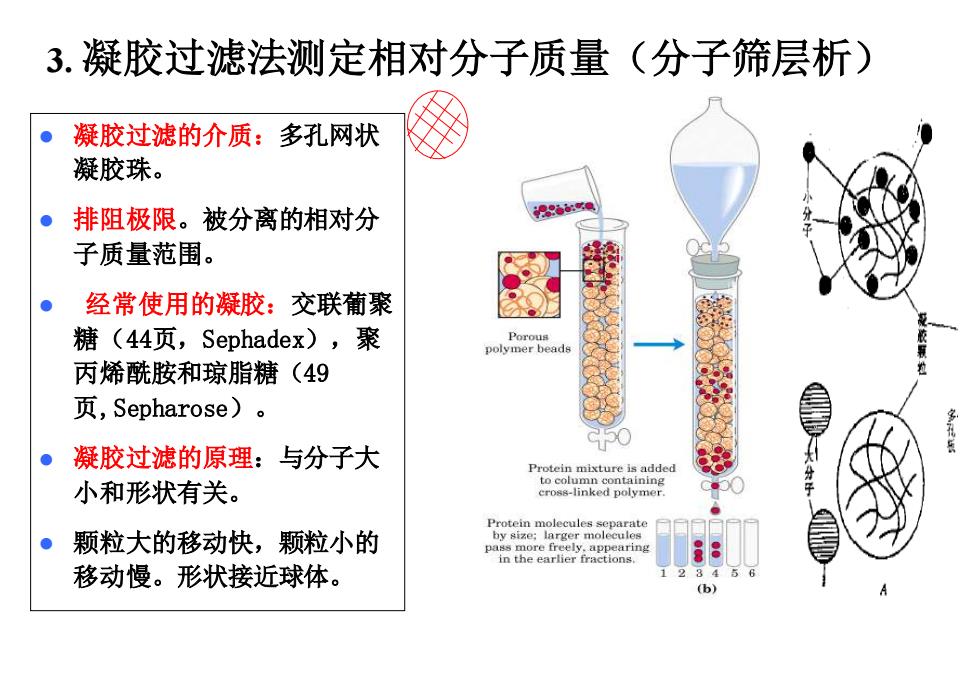
3.凝胶过滤法测定相对分子质量(分子筛层析) 凝胶过滤的介质:多孔网状 凝胶珠。 ·排阻极限。被分离的相对分 说86: 子质量范围。 。经常使用的凝胶:交联葡聚 糖(44页,Sephadex),聚 polymer beads 丙烯酰胺和琼脂糖(49 页,Sepharose)。 。凝胶过滤的原理:与分子大 Protein mixture is added 小和形状有关。 to column containing cross-linked polymer ●颗粒大的移动快,颗粒小的 移动慢。形状接近球体。 (b
7 3. 凝胶过滤法测定相对分子质量(分子筛层析) ⚫ 凝胶过滤的介质:多孔网状 凝胶珠。 ⚫ 排阻极限。被分离的相对分 子质量范围。 ⚫ 经常使用的凝胶:交联葡聚 糖(44页,Sephadex),聚 丙烯酰胺和琼脂糖(49 页,Sepharose)。 ⚫ 凝胶过滤的原理:与分子大 小和形状有关。 ⚫ 颗粒大的移动快,颗粒小的 移动慢。形状接近球体
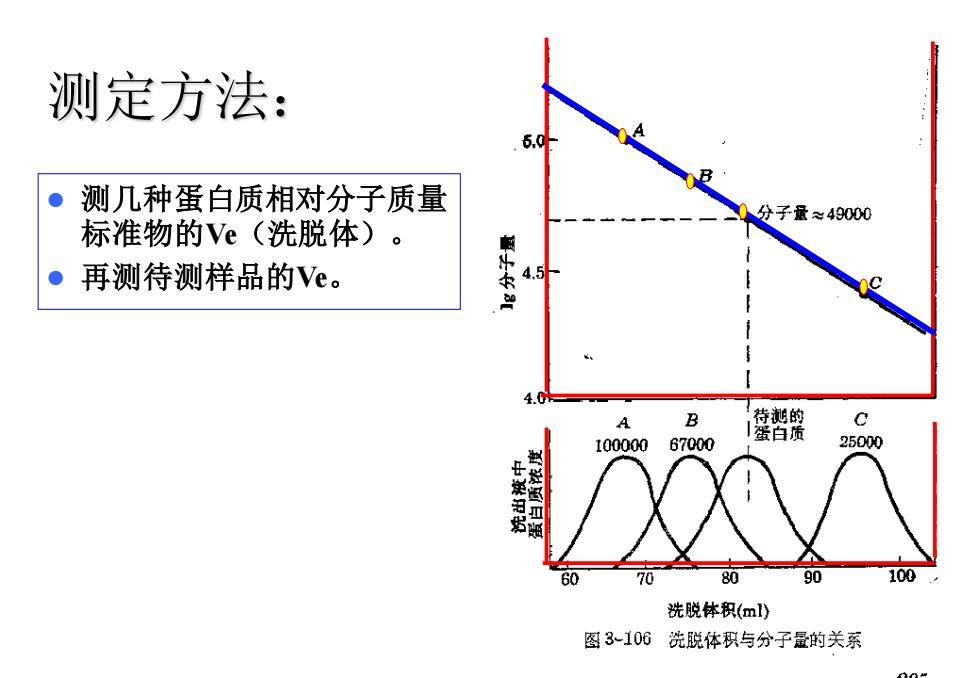
测定方法: 测几种蛋白质相对分子质量 分子量≈49000 标准物的Ve(洗脱体)。 ● 再测待测样品的Ve。 4.5 F 4.0 A B 待测的 蛋白质 10000067000 25000 80 90 100 洗脱体积(ml) 图3106洗脱体积与分子量的关系
8 测定方法: ⚫ 测几种蛋白质相对分子质量 标准物的Ve(洗脱体)。 ⚫ 再测待测样品的Ve
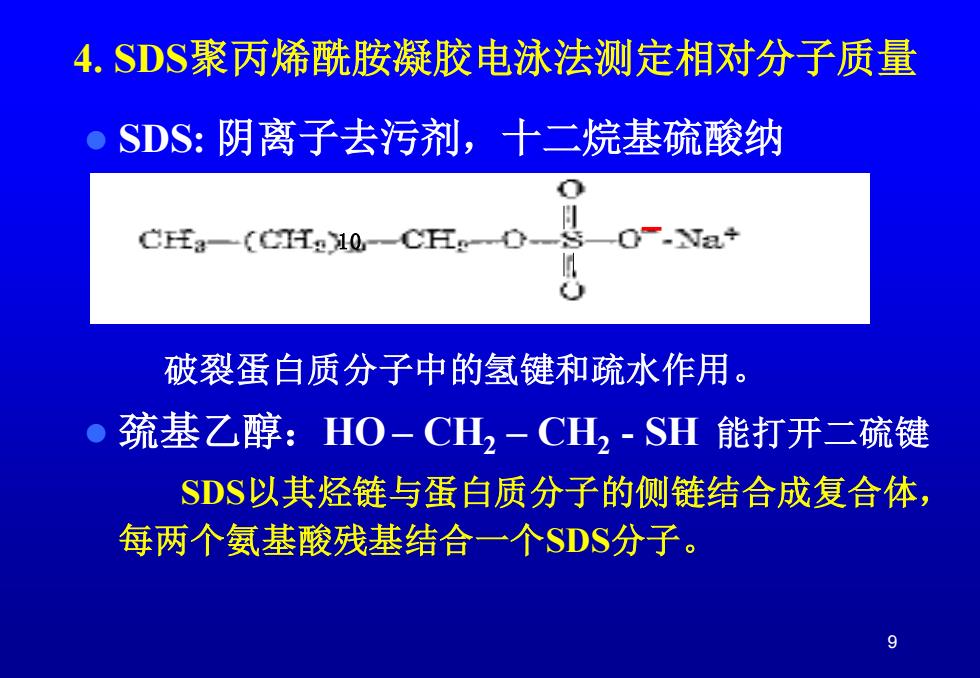
4.SDS聚丙烯酰胺凝胶电泳法测定相对分子质量 SDS:阴离子去污剂,十二烷基硫酸纳 o Cfa一(H知10CHgD O-Na+ 破裂蛋白质分子中的氢键和疏水作用。 巯基乙醇:HO-CH2-CH2-SH能打开二硫键 SDS以其烃链与蛋白质分子的侧链结合成复合体, 每两个氨基酸残基结合一个SDS分子
9 4. SDS聚丙烯酰胺凝胶电泳法测定相对分子质量 ⚫ SDS: 阴离子去污剂,十二烷基硫酸纳 破裂蛋白质分子中的氢键和疏水作用。 ⚫ 巯基乙醇:HO – CH2 – CH2 - SH 能打开二硫键 SDS以其烃链与蛋白质分子的侧链结合成复合体, 每两个氨基酸残基结合一个SDS分子。 10

结果 不同蛋白质的SDS复合体覆盖 上相同的负电荷,具有几乎 相同的荷质比,向正极移动。 具有机同的构象,长椭圆棒, 。电泳迁移率不受各种蛋白质 原有的电荷、分子形状等因 素的影响,而与多肽链分子 量大小相关。分子量大的泳 动慢,小的泳动快。 。几种已知分子量的标准蛋白 质作对照。也可做图求
10 结果: ❖不同蛋白质的SDS复合体覆盖 上相同的负电荷,具有几乎 相同的荷质比,向正极移动。 ❖具有机同的构象,长椭圆棒, ❖电泳迁移率不受各种蛋白质 原有的电荷、分子形状等因 素的影响 ,而与多肽链分子 量大小相关。分子量大的泳 动慢,小的泳动快。 ❖几种已知分子量的标准蛋白 质作对照。也可做图求。 - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -

四、蛋白质的分离纯化 原理:目的是从混杂蛋白质中分离出一个特殊蛋白质。页使用 组合的分级技术,利用欲分离蛋白质的溶解度、分子大小、电 荷、特殊的结合亲和力。 程序 前处理:选材、破碎、匀浆、溶解、离心或差速离心、(pH、 温 度、酶的抑制剂等保证蛋白质的稳定)。 粗分级分离:盐析、等电点沉淀、有机溶剂分级分离,离心。 细分级分离:层折法。 结晶:结晶过程本身也伴随着一定程度的纯化。 11
11 四、蛋白质的分离纯化 原理:目的是从混杂蛋白质中分离出一个特殊蛋白质。页使用 组合的分级技术,利用欲分离蛋白质的溶解度、分子大小、电 荷、特殊的结合亲和力。 程序 ➢ 前处理:选材、破碎、匀浆、溶解、离心或差速离心、(pH、 温 度、酶的抑制剂等保证蛋白质的稳定)。 ➢ 粗分级分离:盐析、等电点沉淀、有机溶剂分级分离,离心。 ➢ 细分级分离:层折法。 ➢ 结晶:结晶过程本身也伴随着一定程度的纯化