
第七章 红外吸收光谱法 第一节 概述 红外分光光度法:利用物质对红外光区电磁辐射的 选择性吸收的特性来进行结构分析、定性和定量的 分析方法,又称红外吸收光谱法 一、红外光的区划 二、红外吸收过程 三、红外光谱的作用 四、红外光谱的表示方法 五、R与UV的区别
第七章 红外吸收光谱法 第一节 概述 红外分光光度法:利用物质对红外光区电磁辐射的 选择性吸收的特性来进行结构分析、定性和定量的 分析方法,又称红外吸收光谱法 一、红外光的区划 二、红外吸收过程 三、红外光谱的作用 四、红外光谱的表示方法 五、IR与UV的区别

一、红外光的区划 红外线:波长在0.76500um(1000um)范围内的 电磁波 近红外区:0.76~2.5m一0H和一NH倍频吸收区 中红外区:2.5~25m 振动、伴随转动光谱 远红外区:25~500μm 纯转动光谱 二、红外吸收过程 UV一分子外层价电子能级的跃迁(电子光谱) R一分子振动和转动能级的跃迁 (振转光谱)
一、红外光的区划 红外线:波长在0.76~500μm (1000μm) 范围内的 电磁波 二、红外吸收过程 近红外区:0.76~2.5μm —OH和—NH倍频吸收区 中红外区:2.5~25μm 振动、伴随转动光谱 远红外区:25~500μm 纯转动光谱 UV——分子外层价电子能级的跃迁(电子光谱) IR——分子振动和转动能级的跃迁 (振转光谱)

三、红外光谱的作用 1.可以确定化合物的类别(芳香类) 2.确定官能团: ×例:一CO—,一C=C—,一C=C— 3。推测分子结构(简单化合物) 4.定量分析
三、红外光谱的作用 1.可以确定化合物的类别(芳香类) 2.确定官能团: ✓ 例:—CO—,—C=C—,—C≡C— 3.推测分子结构(简单化合物) 4.定量分析
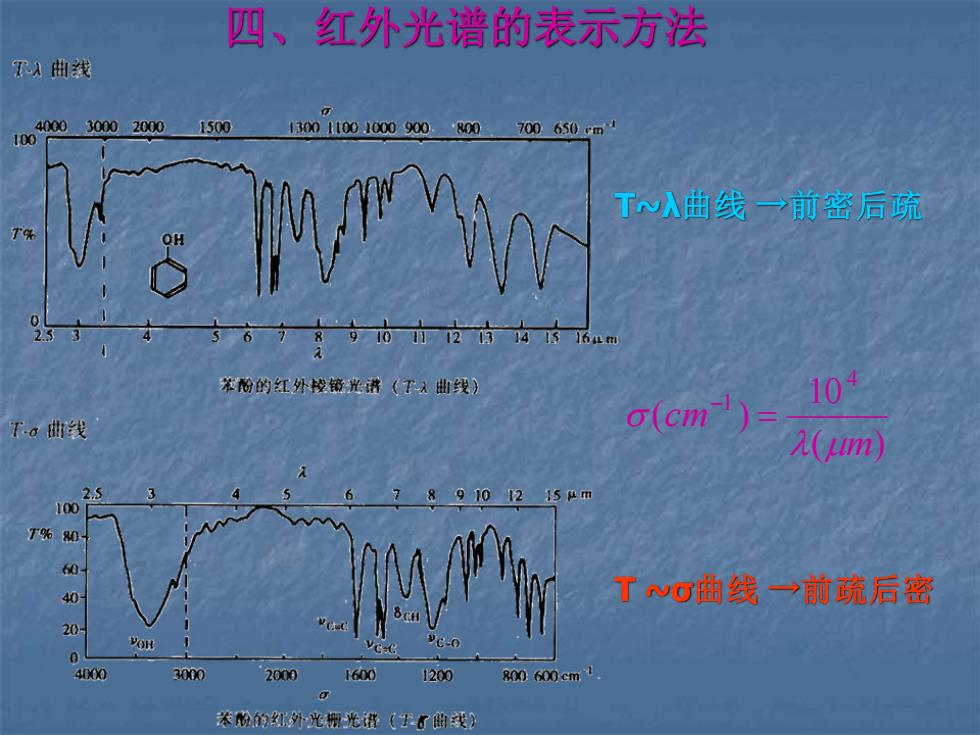
四、红外光谱的表示方法 T入曲浅 4000300020001500 10 30011001000900.800700650rmJ Tw入曲线一前密后疏 T% 2337 5678910241mn 苯酚的红外控镜光讲(T入曲线》 104 Ta曲线 o(cm)= A(um) 2.5 9101215Am 100 T9%80 40 Twg曲线→前疏后密 20 4000 3000 2000 1600 1200 800600cm1 苯阳的红外光桥光道(了曲浅)
四、红外光谱的表示方法 T ~σ曲线 →前疏后密 T~λ曲线 →前密后疏 ( ) 10 ( ) 4 1 m cm = −

五、IR与UV的区别 IR UV 起源 分子振动能级伴随转动能级跃迁分子外层价电子能级跃 迁 适用 所有红外吸收的有机化合物 具n-n跃迁有机化合物 具n-n*跃迁有 机化合物 特征性特征性强 简单、特征性不强 用途 鉴定化合物类别 定量 鉴定官能团 推测有机化合物 共轭骨
五、IR与UV的区别 IR UV 起源 分子振动能级伴随转动能级跃迁 分子外层价电子能级跃 迁 适用 所有红外吸收的有机化合物 具n-π *跃迁有机化合物 具 π-π * 跃迁有 机化合物 特征性 特征性强 简单、特征性不强 用途 鉴定化合物类别 定量 鉴定官能团 推测有机化合物 共轭骨架 推测结构

第二节 红外分光光度法基本原理 红外分光光度法—一研究物质结构与红外光谱之间 关系 红外光谱— 由吸收峰位置和吸收峰强度共同描述 一、红外吸收光谱的产生 二、振动形式 三、振动的自由度 四、特征峰与相关峰 五、吸收峰位置 六、吸收峰强度
第二节 红外分光光度法基本原理 红外分光光度法——研究物质结构与红外光谱之间 关系 红外光谱——由吸收峰位置和吸收峰强度共同描述 一、红外吸收光谱的产生 二、振动形式 三、振动的自由度 四、特征峰与相关峰 五、吸收峰位置 六、吸收峰强度

一、红外吸收光谱的产生 1.振动能级 △E振=0.05~1.0EV>△E转=0.0001~0.057/ →△E=△E振+△E转 ·红外光谱主要由分子的振动能级跃迁产生 ·分子的振动能级差远大于转动能级差 ·分子发生振动能级跃迁必然同时伴随转动能级跃迁
一、红外吸收光谱的产生 ◼ 红外光谱主要由分子的振动能级跃迁产生 ◼ 分子的振动能级差远大于转动能级差 ◼ 分子发生振动能级跃迁必然同时伴随转动能级跃迁 E 振 = 0.05 ~1.0EV E 转 = 0.0001 ~ 0.05V E = E 振 + E 转 1.振动能级

续前 。振动光谱 双原子分子A-B一→近似看作谐振子 两原子间的伸缩振动一→近似看作简谐振动 oWO 简谐振动位能U=K-) 2 伸 缩 伸”→>原子间实际距离 r. 。→原子间平衡距离 平衡位置 平衡位置 飞→化学键力常数N1cm) 谐根予振动示意图 当r=r。→U=0 当r>r或r0
续前 2.振动光谱 双原子分子A-B→近似看作谐振子 两原子间的伸缩振动→近似看作简谐振动 2 ( ) 2 1 e 简谐振动位能 U = K r − r 化学键力常数( ) 原子间平衡距离 原子间实际距离 K N cm r r e → / → → 0 0 = = r r r r U r r U e e e 当 或 当

续前 分子振动总能量E=U+T U→位能 T)动能 当r=r。→U=0,E=T 当(”=)最大→T=0,E三U →分子振动总能量E=(广+)·hy →分子振动频率 V-→分子振动量千数 =0,1,2,3
续前 分子振动总能量 EV =U + T 动能 位能 → → T U 当 r = re U = 0 ,EV =T 当(r − re )最大 T = 0 ,EV =U 分子振动总能量 EV =(V + ) h 2 1 0 ,1 ,2 ,3 分子振动量子数 分子振动频率 = → → V V

续前 分子振动能级差△E三△V·hy 光子照射能量E,=hv 产生红外光谱前提△E振=E,即V=AVY V→红外光的照射频率 v>分子的振动频率
续前 分子振动能级差 E 振 = V h 光子照射能量 EL = h L 产生红外光谱前提 E 振 = EL 即 L = V 分子的振动频率 红外光的照射频率 → → L