
本章学习要求: 掌握形成可逆电池的必要条件,可逆电极的类型, 书面表示方法,熟练正确写出电极和电池反应。 ◆了解对消法测电动势的基本原理和标准电池的作用。 ◆ 熟练用Nernst方程计算电极电势和电池电动势。 ◆了解电动势产生的机理和氢标准电极的作用。 掌握热力学与电化学之间的联系,利用电化学测定 的数据计算热力学函数的变化值。 熟悉电动势测定的主要应用。 电化学
本章学习要求: 掌握形成可逆电池的必要条件,可逆电极的类型, 书面表示方法,熟练正确写出电极和电池反应。 了解对消法测电动势的基本原理和标准电池的作用。 熟练用Nernst方程计算电极电势和电池电动势。 了解电动势产生的机理和氢标准电极的作用。 掌握热力学与电化学之间的联系,利用电化学测定 的数据计算热力学函数的变化值。 熟悉电动势测定的主要应用

第九章可逆电池的电动势及其应用 内容选择 9.1可逆电池和可逆电极 59.2电动势的测定 59.3可逆电池的书写及电动势的取号 59.4可逆电池的热力学 59.5电动势产生的机理 59.6电极电势和电池的电动势 59.7电动势测定的应用
内容选择 第九章 可逆电池的电动势及其应用 §9.1 可逆电池和可逆电极 §9.2 电动势的测定 §9.3 可逆电池的书写及电动势的取号 §9.4 可逆电池的热力学 §9.5 电动势产生的机理 §9.6 电极电势和电池的电动势 §9.7 电动势测定的应用

S9.1可逆电池和可逆电极 本节介绍)一.电化学与热力学的联系 二.原电池的构成 三.组成可逆电池的必要条件 四.可逆电极的类型和电极反应 热力学 电化学
§9.1 可逆电池和可逆电极 本节介绍 一.电化学与热力学的联系 三.组成可逆电池的必要条件 四.可逆电极的类型和电极反应 二.原电池的构成
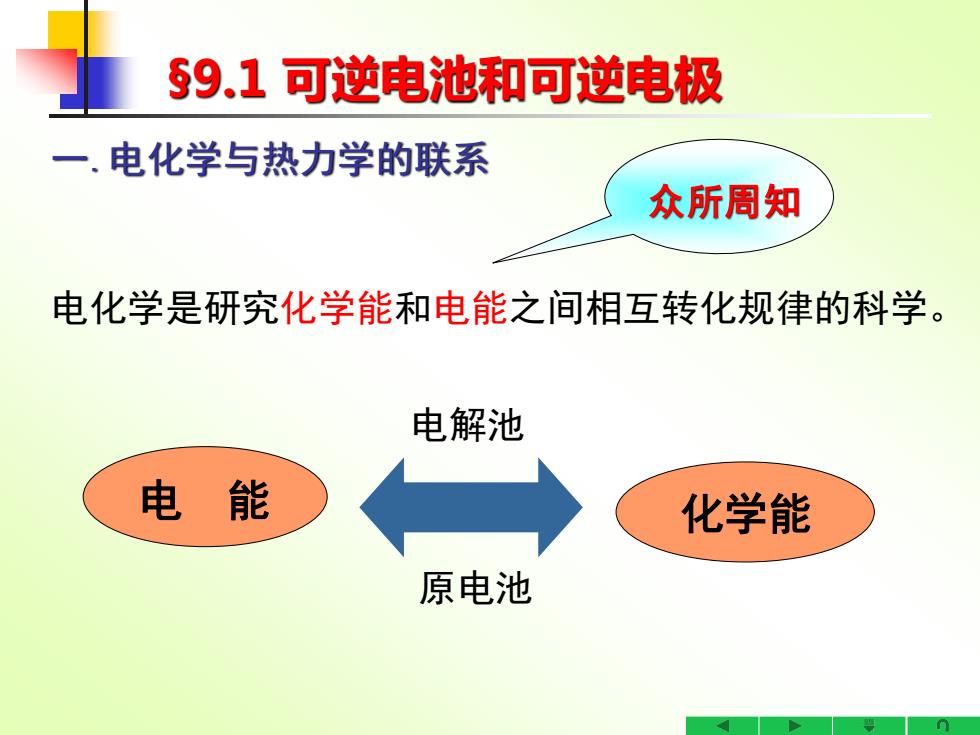
59.1可逆电池和可逆电极 一.电化学与热力学的联系 众所周知 电化学是研究化学能和电能之间相互转化规律的科学。 电解池 电能 化学能 原电池
§9.1 可逆电池和可逆电极 一.电化学与热力学的联系 化学能 电解池 原电池 电 能 电化学是研究化学能和电能之间相互转化规律的科学。 众所周知
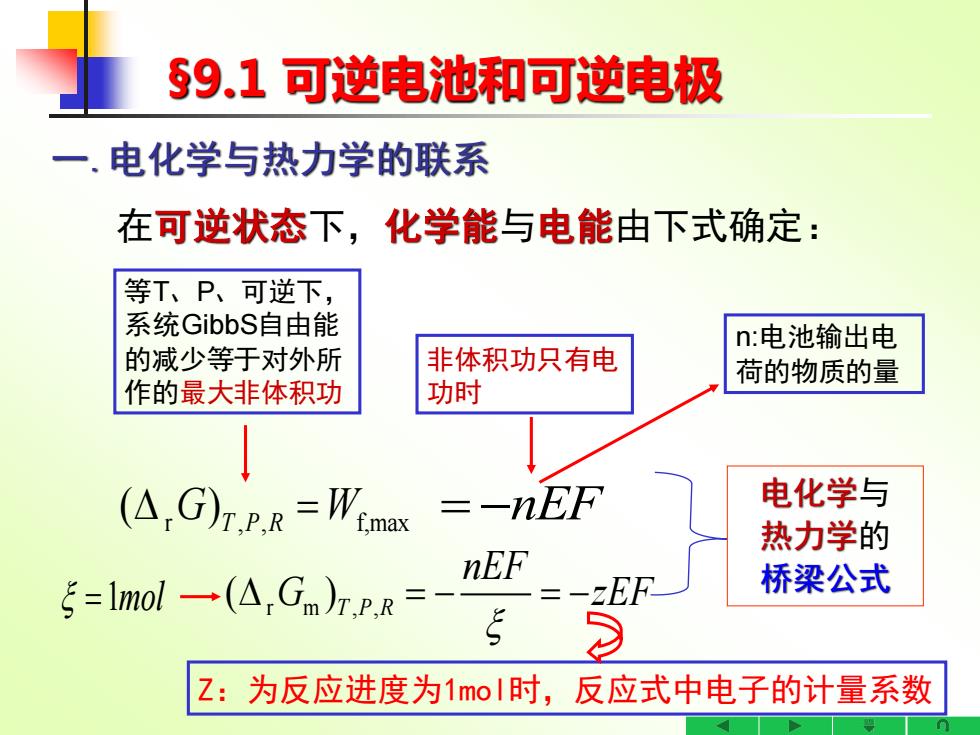
§9,1可逆电池和可逆电极 一.电化学与热力学的联系 在可逆状态下,化学能与电能由下式确定: 等T、P、可逆下, 系统GibbS自由能 n:电池输出电 的减少等于对外所 非体积功只有电 荷的物质的量 作的最大非体积功 功时 (△,G)rPR=Wnax -nEF 电化学与 热力学的 nEF ξ=lmol一(A,Gm)r,PR= 桥梁公式 Z:为反应进度为1moI时,反应式中电子的计量系数
§9.1 可逆电池和可逆电极 一.电化学与热力学的联系 在可逆状态下,化学能与电能由下式确定: 电化学与 热力学的 桥梁公式 r m , , ( )T P R nEF G zEF = − = − 等T、P、可逆下, 系统GibbS自由能 的减少等于对外所 作的最大非体积功 非体积功只有电 功时 =1molr , , f,max ( ) = G W T P R = −nEF Z:为反应进度为1mol时,反应式中电子的计量系数 n:电池输出电 荷的物质的量

S9.1可逆电池和可逆电极 一.电化学与热力学的联系 廷意。1.上式只有在电池可逆放电过程才成立。 当电池中的化学能以不可逆的方式转变 成电能时,两电极间的不可逆电势差一定 小于可逆电动势。 2.可通过可逆电池电动势的测定等电化 学方法求反应的△Gm 3.揭示了化学能转变为电能的最高限度, 为改善电池的性能或研制新的化学电源 提供了理论依据
§9.1 可逆电池和可逆电极 一.电化学与热力学的联系 注意: 2. 可通过可逆电池电动势的测定等电化 学方法求反应的ΔrGm。 3.揭示了化学能转变为电能的最高限度, 为改善电池的性能或研制新的化学电源 提供了理论依据。 1.上式只有在电池可逆放电过程才成立。 当电池中的化学能以不可逆的方式转变 成电能时,两电极间的不可逆电势差一定 小于可逆电动势

§9.1可逆电池和可逆电极 二.原电池的构成 构成条件: 1、能设计成电池的反应,如氧化还原反应。 2、有适当的装置— 电池:单液电池或双液电池 如果两个电极插在同一个电解质溶液中构成的 电池叫单液电池。 如果两个电极插在不同电解质溶液中构成的电 池叫双液电池。双液电池的两个电解质溶液用盐桥 连接
§9.1 可逆电池和可逆电极 二.原电池的构成 如果两个电极插在同一个电解质溶液中构成的 电池叫单液电池。 1、能设计成电池的反应,如氧化还原反应。 2、有适当的装置——电池:单液电池或双液电池 如果两个电极插在不同电解质溶液中构成的电 池叫双液电池。双液电池的两个电解质溶液用盐桥 连接。 构成条件:
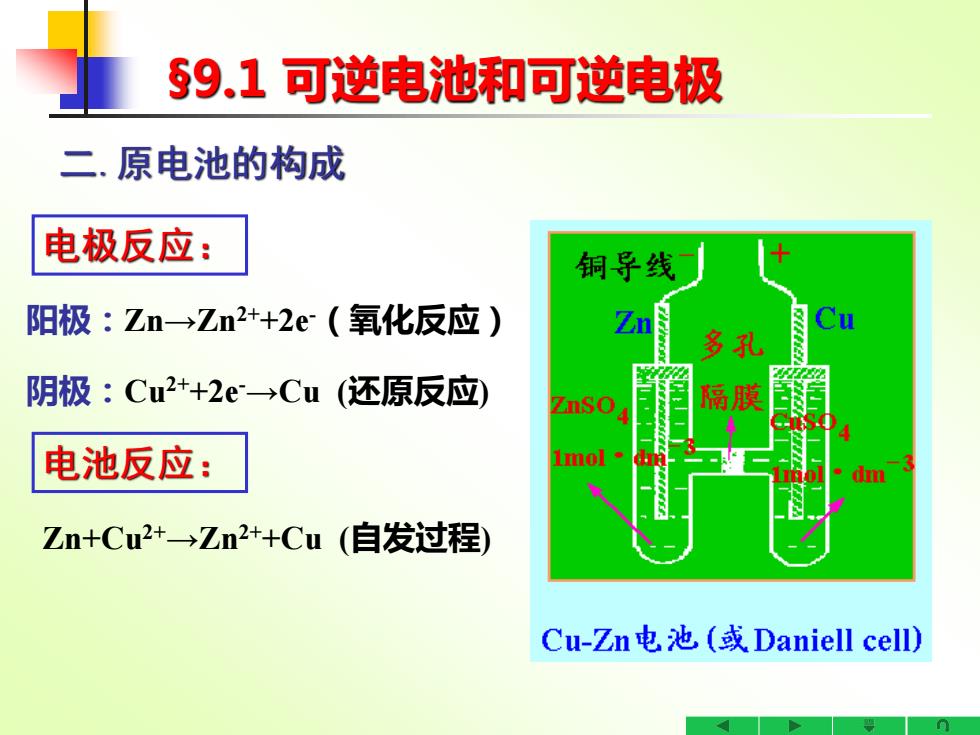
S9.1可逆电池和可逆电极 二.原电池的构成 电极反应: 铜导线 阳极:Zn→Zn2++2e(氧化反应) 多孔 阴极:Cu2++2e→Cu(还原反应) 隔膜 电池反应: mol· Zn+Cu2+→Zn2++Cu(自发过程) Cu-Zn电池(或Daniell cell)
§9.1 可逆电池和可逆电极 二.原电池的构成 Zn+Cu2+→Zn2++Cu (自发过程) 阳极:Zn→Zn2++2e-(氧化反应) 阴极:Cu2++2e-→Cu (还原反应) 电极反应: 电池反应:

§9.1可逆电池和可逆电极 三、组成可逆电池的必要条件 只有可逆电池的电动势才满足△G(T,P)=-ZFE 这时的电动势才有热力学价值,所以研究电池热力学性 质时必须要求电池是可逆电池。 可逆电池必须同时满足两个条件: (1)物质的转变可逆; (2) 能量的转变可逆。 为此构成可逆电池时应具备以下条件:
§9.1 可逆电池和可逆电极 三、组成可逆电池的必要条件 这时的电动势才有热力学价值,所以研究电池热力学性 质时必须要求电池是可逆电池。 ( , ) = − r m G T P ZFE 可逆电池必须同时满足两个条件: 为此构成可逆电池时应具备以下条件: (2)能量的转变可逆。 (1)物质的转变可逆; 只有可逆电池的电动势才满足

59.1可逆电池和可逆电极 构成可逆电池时应具备的条件: 1.电池反应是可逆的。电池反应可逆则电极反应 必须是可逆的。即正向反应的产物若改变条件后 能反向反应生成原来的反应物。 2.电池工作时,无论充电还是放电,通过的电流 必须无限小。 3.电池中不存在任何不可逆的液体接界
§9.1 可逆电池和可逆电极 3.电池中不存在任何不可逆的液体接界。 1.电池反应是可逆的。电池反应可逆则电极反应 必须是可逆的。即正向反应的产物若改变条件后 能反向反应生成原来的反应物。 2.电池工作时,无论充电还是放电,通过的电流 必须无限小。 构成可逆电池时应具备的条件: