
第三章 不饱和烃 作者:冯秀娥 单位:山西医科大学 人民卫生出版社 PEOPLE'S MEOICAL PUBUSHING HOUSS
第三章 不饱和烃 作者:冯秀娥 单位:山西医科大学 •1

目录 第一节烯烃 第二节炔烃 第三节二烯烃 2
目录 第一节 烯烃 第二节 炔烃 第三节 二烯烃 •2

不饱和烃:烯烃、炔烃、二烯烃 0烯烃:含有碳碳双键的烃;官能团为-(, 开链单烯烃的通式为CH2m ©炔烃:含有碳碳叁键的烃;官能团为一C三C一,开链单炔烃的通式为CH2n-2 o二烯烃:含有两个碳碳双键的烃;通式为C,H2n-2 相同碳原子数的开链单炔烃和二烯烃互为同分异构体。不饱和烃相比于 烷烃,化学性质更为活泼。 3
Ø烯烃:含有碳碳双键的烃;官能团为 , 开链单烯烃的通式为CnH2n Ø炔烃:含有碳碳叁键的烃;官能团为 ,开链单炔烃的通式为CnH2n-2 Ø二烯烃:含有两个碳碳双键的烃;通式为CnH2n-2 •3 不饱和烃:烯烃、炔烃、二烯烃 相同碳原子数的开链单炔烃和二烯烃互为同分异构体。不饱和烃相比于 烷烃,化学性质更为活泼

第一节 1 烯烃
1 第一节 烯 烃 • 4

Sp杂化—解释 空 CH2=CH2 间构型 2p2 2p 2s2 激发 2s 激发态) (C价层电子组态) 杂化 2p Sp2 (杂化态)
2s 2 2p 2 激发 (C价层电子组态) 2s 2p (激发态) 杂化 sp2 (杂化态) 2p 杂化轨道理论 sp2杂化——解释 的空 间构型
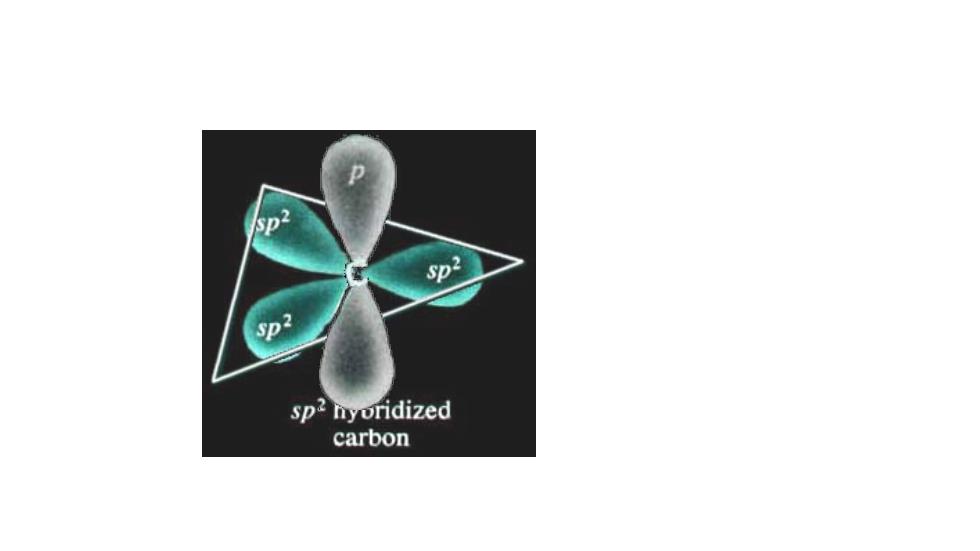
sp2nyoridized carbon
杂化轨道理论
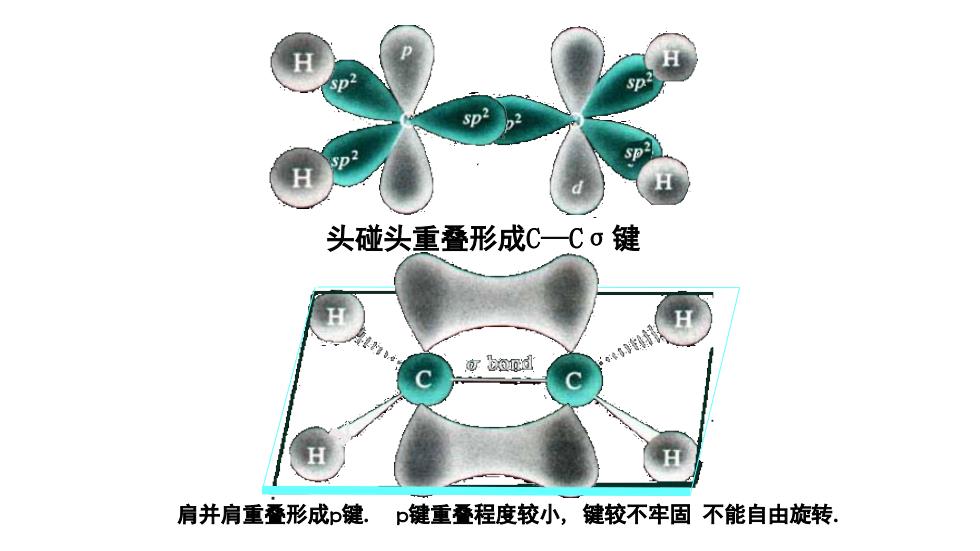
头碰头重叠形成C一Co键 可bo0d 肩并肩重叠形成p键.p键重叠程度较小,键较不牢固不能自由旋转
头碰头重叠形成C—Cσ键 肩并肩重叠形成p键. p键重叠程度较小, 键较不牢固 不能自由旋转. 杂化轨道理论

C-C H 烯键的三个特性 1.共平面性 2.双键的不等性 ·键、π键 3.不可旋转性
烯键的三个特性 1. 共平面性 2. 双键的不等性 σ键、 π 键 3. 不可旋转性 杂化轨道理论
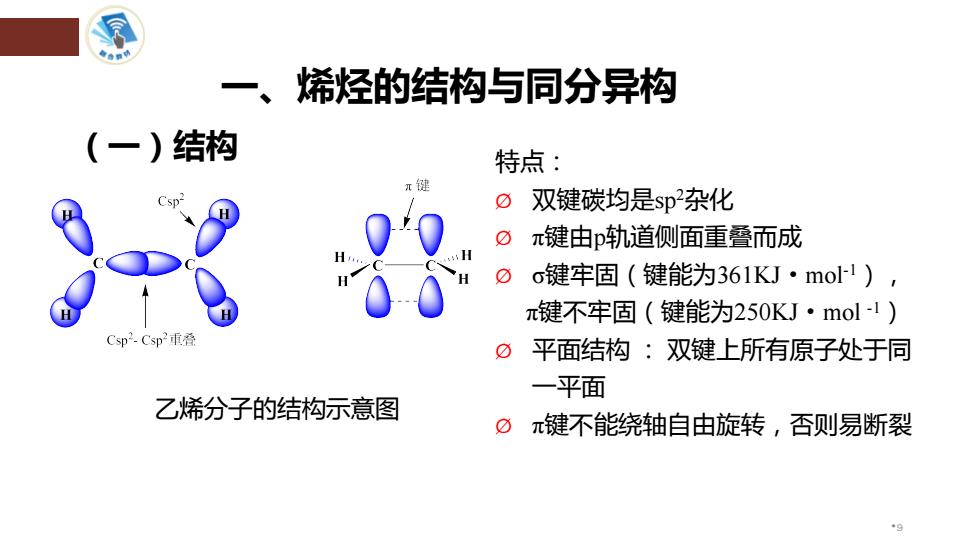
一、 烯烃的结构与同分异构 (一)结构 特点: π键 0 双键碳均是sp杂化 oπ键由p轨道侧面重叠而成 H o键牢固(键能为361KJ·mo1), π键不牢固(键能为250KJ·mol-1) Csp2-Csp2重叠 0 平面结构:双键上所有原子处于同 一平面 乙烯分子的结构示意图 ⑦π键不能绕轴自由旋转,否则易断裂
一、烯烃的结构与同分异构 特点: Ø 双键碳均是sp2杂化 Ø π键由p轨道侧面重叠而成 Ø σ键牢固(键能为361KJ·mol-1), π键不牢固(键能为250KJ·mol -1) Ø 平面结构 : 双键上所有原子处于同 一平面 Ø π键不能绕轴自由旋转,否则易断裂 (一)结构 •9 乙烯分子的结构示意图

(二)同分异构现象 1.构造异构 CH,=CHCH2CH3 CH:CH=CHCH3 CH2=C-CH3 (1) (2) (3)CH3 丁烯存在三种同分异构的烯烃,(1)和(2)的碳链骨架相同,只 是双键的位置不同,这种异构现象称为位置异构,(1)、(2)与(3) 的碳链骨架不同,这种异构现象称为碳链异构。 10
1. 构造异构 (二)同分异构现象 丁烯存在三种同分异构的烯烃,(1)和(2)的碳链骨架相同,只 是双键的位置不同,这种异构现象称为位置异构,(1)、(2)与(3) 的碳链骨架不同,这种异构现象称为碳链异构。 •10