
基础化学 熔点的测定 宋丽丽山东中医药高等专科学核

一、实验目的 1.了解熔点测定的原理和意义。 2.掌握熔点测定的基本操作方法。 二、实验原理 1.熔点:在大气压下,物质的固态和液态 建立起平衡时的温度。此时,物质的固态和液态 的蒸汽压相等。 基础化学 2

2.纯净化合物从开始熔化(始熔)至完全熔 化(全熔)的温度范围称为熔程。 3.每种物质有一定的熔点。 4.纯的化合物熔程很小,一般为0.5~1℃。 若混入少量杂质,熔点即下降,熔程即增大 ,所以可根据熔点测定初步鉴定固体化合物或判断 其纯度。 基础化学 3

三、仪器和药品 仪器: 熔点测定管 毛细管 150温度计、铁架台、带缺口的软木塞、酒精灯 药品:苯甲酸、乙酰苯胺、液体石蜡 基础化学
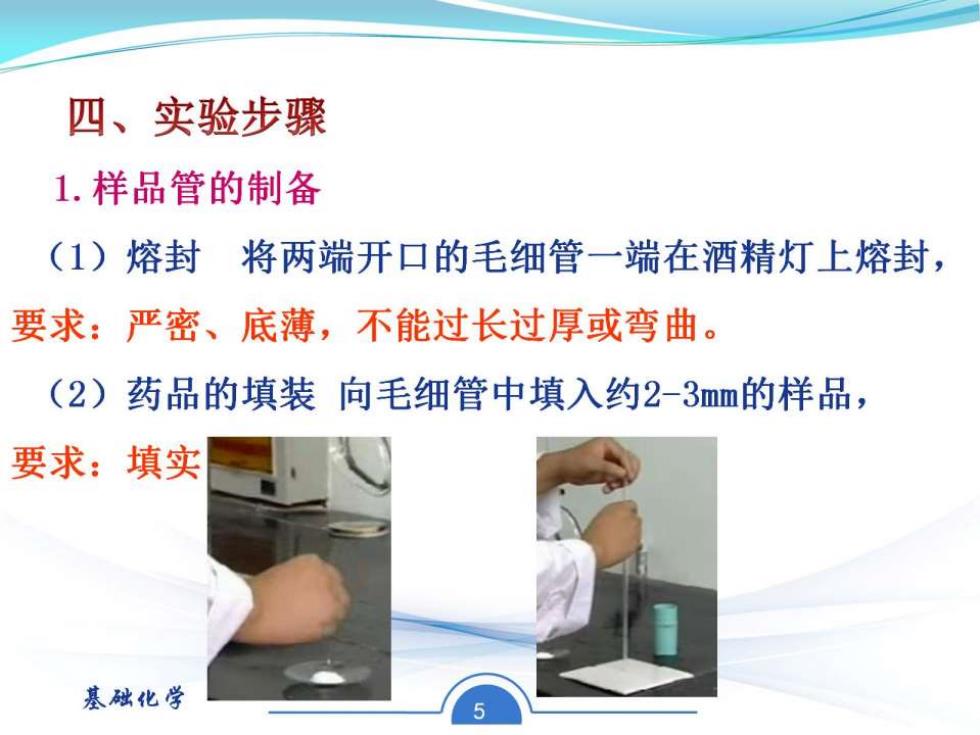
四、实验步骤 1.样品管的制备 (1)熔封将两端开口的毛细管一端在酒精灯上熔封, 要求:严密、底薄,不能过长过厚或弯曲。 (2)药品的填装向毛细管中填入约2-3m血的样品, 要求:填实 基础化学

2.组装熔点测定装置 将液体石蜡倒入熔点测定管中 刚好盖住上侧管口即可 基础化学 6
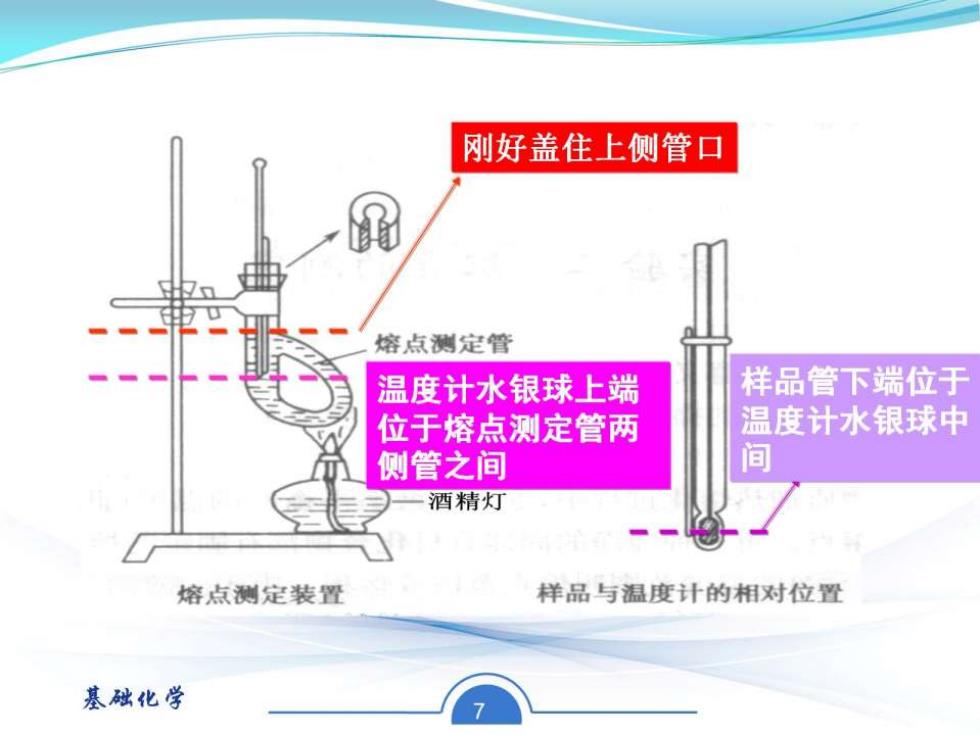
刚好盖住上侧管口 熔点测定管 温度计水银球上端 样品管下端位于 位于熔点测定管两 温度计水银球中 侧管之间 间 酒精灯 熔点测定装置 样品与温度计的相对位置 基础化学

3.熔点的测定 用酒精灯在熔点测定管的侧管末端缓缓 加热。开始时温度每分钟上升5~6℃,加热 到距熔点10~15℃时,减慢升温速度,使其 控制在每分钟升温1一2℃。 基础化学

当毛细管内样品开始形状改变,或出现小 滴液时,记下此时的温度(始熔),继续观察 ,直到固体样品恰好完全融化成透明液体(全 熔)时,再记下此时温度计的温度。 始熔到全熔的温度即为熔点,两者的温度 范围即熔程。 基础化学 9

本实验的样品是苯甲酸和乙酰苯胺,每个样 品测3次,第一次为粗测,加热可稍快,测知大概 熔程后,再做后两次精测。 思考题 1.熔点测定为什么要用切口的塞子? 2.是否可以用第一次测定时已熔化后又固化的 有机化合物再作第二次测定?为什么? 基础化学 10