
醋酸电离度和电离常数的测定 实验实训 王志江 山东中医药高等专科学校

醋酸电离度和电离常数的测定 一、实验目的 1.测定醋酸的电离度和电离平衡常数。 2.学会正确地使用pH计。 3练习和巩固容量瓶、移液管、刻度吸管的基本操作
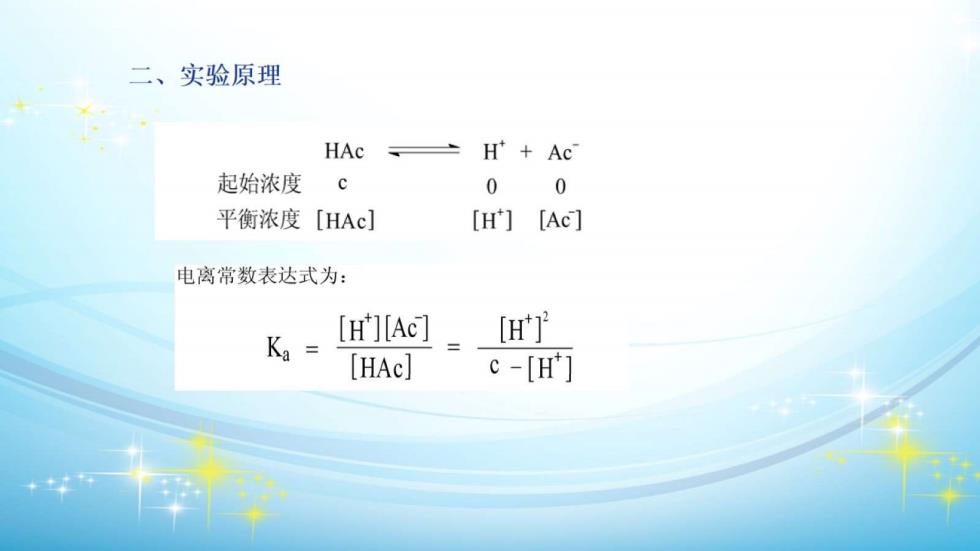
二、实验原理 HAc H'+Ac 起始浓度 c 0 0 平衡浓度[HAc] [H] [Ac] 电离常数表达式为: Ka= [H'][Ac] t] [HAc] c-[H]

已电离的电解质物质的量浓度 0= ×100% 溶液中原有的电解质的总物质的量浓度 (H X100% 元弱酸的浓度是已知的,其次在一定温度下,通过测定弱酸的H 值,由pH=-lgH],可计算出其中的H中

三、实验仪器和药品: 1.仪器:移液管、吸量管(10ml)、容量瓶(50ml)、小烧杯(50ml)、pHS-3C 型酸度计。 2.试剂:0.2molL1的HAc标准溶液 四、实验内容: 1.配制不同浓度的HAc溶液 分别用吸量管或移液管准确量取2.50、5.00、25.00mL 0.2moL1的 HAc标准溶液,分别加入到三支50L的容量瓶中,用蒸馏水稀释定容,摇匀 得到三种不同浓度的醋酸溶液。计算三个容量瓶中HA©溶液的准确浓度

2.测定不同浓度的Ac溶液的pH值,并计算电离度和电离常数 将以上三种不同浓度的HAc溶液分别加入到三支洁净干燥的50L烧杯中 ,加入HAc标准溶液。将以上四种不同浓度的溶液分别编号,然后按照由稀 到浓的顺序在pH计上分别测定它们的pH值,并记录测得的pH值和室温。分 别计算电离度和电离常数

五、数据记录与结果处理 室温:℃ 编号 cAe/molL1pH值 [H的/molL1 电离度a K计算值 K平均值 2

注意事项 1.测定醋酸溶液pH值用的小烧杯,必须洁净、干燥,否则,会影响 醋酸起始浓度,以及所测得的pH值。 2.吸量管的使用与移液管类似,用差量法量取所需液体体积,不可 只吸取所需量的液体,然后完全放出。 3.pH计使用时按浓度由低到高的顺序测定H值,每次测定完毕, 都必须用蒸馏水将电极头清洗干净,并用滤纸擦干

六、思考题 1.改变所测HAc溶液的浓度或温度,电离度或电离常数是否有 变化?若有变化,怎么改变? 2.若所用ⅡAc溶液的浓度极稀,是否还能用近似计算公式 K=4,0了 来计算Ka,为什么?