
分子结构 自然界的物质,除稀有气体以单原子的状态存在以外,大多数物质由原子之间相互结合 形成分子的形式存在。分子是保持物质化学性质的最小微粒,是参加化学反应的基本单元, 物质的化学性质主要决定于分子的性质,而分子的性质主要由分子的内部结构所决定。因此 探索分子的内部结构,寻找分子结构与性质之间的内在联系,对于了解物质的性质和化学变 化规律,都具有重要的意义。 化学键 原子结合成分子时,相邻原子间存在着一种力,我们把分子中相邻原子间的强烈相互作 用力,叫化学键。 原子结合成分子时,原子核不发生变化,只是核外电子排布发生了改变。由于各个原子 核外电子结构不同,所以原子之间相互结合时作用力也不同。通常我们根据原子之间结合方 式不同,把化学健分为离子键、共价键和金属键。 一、离子键 (一)离子健的形成 当活泼金属原子和活泼非金属原子在一定条件下相遇时,由于双方电负性相差较大,它 们都有达到稳定的稀有气体结构的倾向,结果就是活泼金属失去外层电子转化成阳离子,活 泼非金属得到电子转化成阴离子。当两种离子接近到一定距离时,吸引和排斥作用达到暂时 平衡,体系能量降到最低,阴阳离子之间形成稳定的化学键。这种由阴阳离子之间通过静电 作用所形成的化学键称为离子键。以活泼金屈钠和活泼非金属氯反应生成氯化钠为例,该过 程可以表示如下: nNa()-nenNa"(2s22p) nCl(3s23p)+ne nCl(3s23p*) nNa'(2s22p)+nCl(3s23p)nNaCl 像这种由离子键形成的化合物叫离子型化合物。 (二)离子键的特点 离子键的特点是既没有方向性又没有饱和性,只要空间条件允许,正离子周围可以尽量 地吸引负离子,反之亦然。由于离子电荷分布是球形对称的,其电场是均匀分布的,在任何 方向上,每个离子与带相反电荷离子的静电作用是相同的,因此离子键无方向性,另一方面, 对于带电的离子只要空间允许、距离允许,每个离子尽可能多地吸引带相反电荷的离子,不
分子结构 自然界的物质,除稀有气体以单原子的状态存在以外,大多数物质由原子之间相互结合 形成分子的形式存在。分子是保持物质化学性质的最小微粒,是参加化学反应的基本单元, 物质的化学性质主要决定于分子的性质,而分子的性质主要由分子的内部结构所决定。因此 探索分子的内部结构,寻找分子结构与性质之间的内在联系,对于了解物质的性质和化学变 化规律,都具有重要的意义。 化学键 原子结合成分子时,相邻原子间存在着一种力,我们把分子中相邻原子间的强烈相互作 用力,叫化学键。 原子结合成分子时,原子核不发生变化,只是核外电子排布发生了改变。由于各个原子 核外电子结构不同,所以原子之间相互结合时作用力也不同。通常我们根据原子之间结合方 式不同,把化学键分为离子键、共价键和金属键。 一、离子键 (一)离子键的形成 当活泼金属原子和活泼非金属原子在一定条件下相遇时,由于双方电负性相差较大,它 们都有达到稳定的稀有气体结构的倾向,结果就是活泼金属失去外层电子转化成阳离子,活 泼非金属得到电子转化成阴离子。当两种离子接近到一定距离时,吸引和排斥作用达到暂时 平衡,体系能量降到最低,阴阳离子之间形成稳定的化学键。这种由阴阳离子之间通过静电 作用所形成的化学键称为离子键。以活泼金属钠和活泼非金属氯反应生成氯化钠为例,该过 程可以表示如下: nNa(2s22p63s1 ) -ne → nNa+ (2s22p6 ) nCl(3s23p5 ) + ne → nCl– (3s23p6 ) nNa+ (2s22p6 ) + nCl– (3s23p6 ) → nNaCl 像这种由离子键形成的化合物叫离子型化合物。 (二)离子键的特点 离子键的特点是既没有方向性又没有饱和性,只要空间条件允许,正离子周围可以尽量 地吸引负离子,反之亦然。由于离子电荷分布是球形对称的,其电场是均匀分布的,在任何 方向上,每个离子与带相反电荷离子的静电作用是相同的,因此离子键无方向性,另一方面, 对于带电的离子只要空间允许、距离允许,每个离子尽可能多地吸引带相反电荷的离子,不

受离子本身所带电荷数限制,所以离子键无饱和性。 (三)离子键的稳定性 离子键的稳定性与组成离子化合物的离子性质有关,影响离子键稳定性的两种主要因素: 离子电荷和离子半径 1.离子电荷 根据离子键的形成过程,阳离子所带的电荷数就是相应原子失去的电荷数,阴离子所带 的电荷数就是相应原子得到的电荷数。离子键的本质是阴阳离子间的静电作用力,阴阳离子 带的电荷数越多,作用力越强,离子键就越牢周。 2.离子半径 高子键的稳定性除了与离子所带电荷数多少有关外,还与阴阳离子间的距离有关,距离 越近,健就越牢固。 (四)离子化合物 由离子键结合而形成的化合物叫离子化合物。例如:KCI、MgBr2、NHa)SO:等都是离 子化合物。在离子化合物中,离子具有的电荷就是他的化合价。离子化合物一般具有熔点高、 易溶于水、水溶液或熔融状态能导电等特点。 二、共价键 (一)经典共价健理论 1共价键的形成 当分子中原子之间的电负性相近或者相同时,成键原子各自提供相同数目的电子形成共 用电子对。该电子对围绕两个成键原子的原子核运动,为两个成键原子所共有。以HC!分子 形成为例说明共价健的形成过程: H的价电子构型是1s,C1的价电子构型是323p,当H、C1两原子靠近成键时,各自 提供外层的一个电子,形成共用电子对。 +·CI:→HCl 这种原子间通过共用电子对(电子云重叠)产生的原子间的强烈相互作用力称为共价健 2共价键的特点 共价键具有方向性和饱和性,这是共价健的特点,也是共价键区别于离子键的显著特征。 (1)共价键的饱和性一个原子的未成对电子跟另一个原子的自旋相反的电子配对 成键后,就不能再与第三个原子的电子配对成键,否则其中必有两个电子因自旋方向相同而
受离子本身所带电荷数限制,所以离子键无饱和性。 (三)离子键的稳定性 离子键的稳定性与组成离子化合物的离子性质有关,影响离子键稳定性的两种主要因素: 离子电荷和离子半径。 1.离子电荷 根据离子键的形成过程,阳离子所带的电荷数就是相应原子失去的电荷数,阴离子所带 的电荷数就是相应原子得到的电荷数。离子键的本质是阴阳离子间的静电作用力,阴阳离子 带的电荷数越多,作用力越强,离子键就越牢固。 2.离子半径 离子键的稳定性除了与离子所带电荷数多少有关外,还与阴阳离子间的距离有关,距离 越近,键就越牢固。 (四)离子化合物 由离子键结合而形成的化合物叫离子化合物。例如:KCl、MgBr2、(NH4)2SO4等都是离 子化合物。在离子化合物中,离子具有的电荷就是他的化合价。离子化合物一般具有熔点高、 易溶于水、水溶液或熔融状态能导电等特点。 二、共价键 (一)经典共价键理论 1.共价键的形成 当分子中原子之间的电负性相近或者相同时,成键原子各自提供相同数目的电子形成共 用电子对。该电子对围绕两个成键原子的原子核运动,为两个成键原子所共有。以 HCl 分子 形成为例说明共价键的形成过程: H 的价电子构型是 1s1,Cl 的价电子构型是 3s23p5,当 H、Cl 两原子靠近成键时,各自 提供外层的一个电子,形成共用电子对。 H + Cl H Cl x x 这种原子间通过共用电子对(电子云重叠)产生的原子间的强烈相互作用力称为共价键。 2.共价键的特点 共价键具有方向性和饱和性,这是共价键的特点,也是共价键区别于离子键的显著特征。 (1)共价键的饱和性 一个原子的未成对电子跟另一个原子的自旋相反的电子配对 成键后,就不能再与第三个原子的电子配对成键,否则其中必有两个电子因自旋方向相同而

互相排斥。因此一个原子中有几个未成对电子,就只能和几个自旋相反的电子配对成键,这 就是共价键的饱和性。 (2)共价鞋的方向性根据电子云的最大重叠原理,共价键形成时尽可能沿若电子云 密度最大的方向成键。s电子云是球型对称的,因此,无论在哪个方向上都可能发生最大重 叠,而p、电子云在空间都有不同的伸展方向,为了形成稳定的共价键,电子云尽可能沿 着密度最大的方向进行重叠,这就是共价键的方向性。 3.共价键的极性 由同种原子形成的共价键中,两个原子吸引电子的能力完全相同,电子对不偏向任何 方,成键的原子都不显电性,这样的共价键叫做非极性共价键,简称非极性键(non-polar bond)。例如:H一H键、C一C1键都是非极性键。非极性键没有极性。 由不同种原子形成的共价键中,共用电子对偏向电负性大、吸引电子能力强的原子 方,这种原子就带部分负电:而电负性小、吸引电子能力较弱的原子就带部分正电,这样的 共价键叫做极性共价键,简称极性键(polar bond)。例如H一CI键、N一H键都是极性健。 极性键有极性,共价键的极性大小与成键原子的电负性差值有关,差值越大,共价键的极性 越大。 4.配位键 配位键是一种特殊的共价键。若两个成健原子共享的电子对不是由两原子各提供一个电 子,而是由其中一原子独自提供,这种共价键叫配位键。配位键用A一→B来表示,其中A原 子是提供电子对的原子,叫做电子对的给予体:B原子是接收电子对的原子,叫做电子对的 接收体。例如:NH和H形成NH。 H H HN:+H→H=:H 或表示成H一N一H H (二)现代价健理论 1.价键理论的基本要点 (1)两个原子接近时,自旋相反的两个未成对的电子可以相互配对,形成稳定的共价 键。 (2)一个原子中有几个未成对电子,就只能和几个自旋相反的电子配对成键,这就是 共价键的饱和性 (3)成键电子的原子轨道重叠程度越大,原子核间电子云的密度越大,形成的共价健
互相排斥。因此一个原子中有几个未成对电子,就只能和几个自旋相反的电子配对成键,这 就是共价键的饱和性。 (2)共价键的方向性 根据电子云的最大重叠原理,共价键形成时尽可能沿着电子云 密度最大的方向成键。s 电子云是球型对称的,因此,无论在哪个方向上都可能发生最大重 叠,而 p、d 电子云在空间都有不同的伸展方向,为了形成稳定的共价键,电子云尽可能沿 着密度最大的方向进行重叠,这就是共价键的方向性。 3.共价键的极性 由同种原子形成的共价键中,两个原子吸引电子的能力完全相同,电子对不偏向任何一 方,成键的原子都不显电性,这样的共价键叫做非极性共价键,简称非极性键(non-polar bond)。例如:H—H 键、Cl—Cl 键都是非极性键。非极性键没有极性。 由不同种原子形成的共价键中,共用电子对偏向电负性大、吸引电子能力强的原子一 方,这种原子就带部分负电;而电负性小、吸引电子能力较弱的原子就带部分正电,这样的 共价键叫做极性共价键,简称极性键(polar bond)。例如 H—Cl 键、N—H 键都是极性键。 极性键有极性,共价键的极性大小与成键原子的电负性差值有关,差值越大,共价键的极性 越大。 4.配位键 配位键是一种特殊的共价键。若两个成键原子共享的电子对不是由两原子各提供一个电 子,而是由其中一原子独自提供,这种共价键叫配位键。配位键用 A→B 来表示,其中 A 原 子是提供电子对的原子,叫做电子对的给予体;B 原子是接收电子对的原子,叫做电子对的 接收体。例如:NH3和 H+形成 NH4 +。 (二)现代价键理论 1.价键理论的基本要点 (1)两个原子接近时,自旋相反的两个未成对的电子可以相互配对,形成稳定的共价 键。 (2)一个原子中有几个未成对电子,就只能和几个自旋相反的电子配对成键,这就是 共价键的饱和性 (3)成键电子的原子轨道重叠程度越大,原子核间电子云的密度越大,形成的共价键

越稳定。所以成键时原子轨道间的重叠只能沿着一定方向进行,才能达到最大程度的重叠, 这就是共价键的方向性(即最大重叠原理)。 2.共价键的类型 共价键形成时,根据成键时原子轨道重叠的方式不同,把共价键分为。健和π键。 (1)。键如果成键的原子轨道沿者键轴(即两个原子核之间的连线)方向以“头碰头” 方式进行重叠,这样形成的共价键称为σ键。该键的特点是重叠部分集中于两核之间,并沿 着键轴对称分布,可以任意旋转。由于成键时重叠程度大,所以。键较稳定,不易断裂,化 学活性小,可以独立存在于两原子之间。σ键又可分为s-5、sp和P-p三种。例如,出2分子 中的HH键、HC分子中的H-C1键、C分子中C1-C键都是o键。如图3-1(a)所示。 .O0: m⊙eO为 mOC0O ()缝 图3!了键和π键示意图 (2)π键如果成键的两原子的原子轨道沿着键轴方向以“肩并肩”的方式发生侧面重 叠,形成的共价键称为π健。该键的特点是重叠部分分布在键轴两侧,不能绕着键轴任意旋 转,键的重叠程度较小,不稳定,化学反应中易断裂。如图3-1(b)所示。以N为例来分 析分子中的共价键。N原子的电子层结构为1s2s2p,每个N原子的3个2p轨道中各有- 个未成对电子,当两个N原子相结合时,每个N原子若以一个P,电子沿若X轴的方向“头 对头“地重叠形成一个。键,则N原子其余的2个p电子,只能采取“肩并肩'的方式重叠。 从上分析可见,如果原子间只有1对电子,形成共价单键,通常是σ键,如果形成共价 键是双键,则一个。键一个π键,如果是三键,则由一个。键和两个元组成。 (三)杂化轨道理论 现代价键理论能够较好解释了一些共价键的形成,但是对于部分多原子分子的空间构型 无法解释,例如在山0分子中0原子两个未成对电子在两个不同p轨道上,形成0一H健
越稳定。所以成键时原子轨道间的重叠只能沿着一定方向进行,才能达到最大程度的重叠, 这就是共价键的方向性(即最大重叠原理)。 2.共价键的类型 共价键形成时,根据成键时原子轨道重叠的方式不同,把共价键分为 键和 键。 (1) 键 如果成键的原子轨道沿着键轴(即两个原子核之间的连线)方向以“头碰头” 方式进行重叠,这样形成的共价键称为 键。该键的特点是重叠部分集中于两核之间,并沿 着键轴对称分布,可以任意旋转。由于成键时重叠程度大,所以 键较稳定,不易断裂,化 学活性小,可以独立存在于两原子之间。 键又可分为 s-s、s-p 和 p-p 三种。例如,H2分子 中的 H-H 键、HCl 分子中的 H-Cl 键、Cl2分子中 Cl-Cl 键都是 键。如图 3-1(a)所示。 图 3-1 键和 键示意图 (2)π 键 如果成键的两原子的原子轨道沿着键轴方向以“肩并肩”的方式发生侧面重 叠,形成的共价键称为 π 键。该键的特点是重叠部分分布在键轴两侧,不能绕着键轴任意旋 转,键的重叠程度较小,不稳定,化学反应中易断裂。如图 3-1(b)所示。以 N2 为例来分 析分子中的共价键。N 原子的电子层结构为 1s22s22p3,每个 N 原子的 3 个 2p 轨道中各有一 个未成对电子,当两个 N 原子相结合时,每个 N 原子若以一个 Px 电子沿着 X 轴的方向“头 对头”地重叠形成一个 σ 键,则 N 原子其余的 2 个 p 电子,只能采取“肩并肩’的方式重叠。 从上分析可见,如果原子间只有 1 对电子,形成共价单键,通常是 σ 键,如果形成共价 键是双键,则一个 σ 键一个 π 键,如果是三键,则由一个 σ 键和两个 π 组成。 (三) 杂化轨道理论 现代价键理论能够较好解释了一些共价键的形成,但是对于部分多原子分子的空间构型 无法解释,例如在 H2O 分子中 O 原子两个未成对电子在两个不同 p 轨道上,形成 O—H 键

间的夹角应该是90°,而实际上是10445。又如,CH:基态C原子的价电子层结构是2s22p2, 只有两个未成对的电子,按照价键理论C原子只能与两个H原子形成两个共价单键。但实 验测得,CH4能形成四个等同的CH键,每个CH键的夹角是10928,CH4的空间构型为 正四面体。为了解释这些现象,1931年鲍林和斯莱脱(Slater)在价键理论的基础上,提出 了杂化轨道理论。 1杂化轨道的形成过程 在杂化轨道形成时,首先杂化原子的基态某一轨道上的电子从基态激发到能量较高的空 轨道,形成激发态,激发态的多个轨道再进行混合,重新分配能量和空间取向,组合成为成 键能力更强的新原子轨道,这个过程称为原子轨道的杂化,形成新的原子轨道称为杂化轨道。 2杂化轨道理论的基本要点 (1)形成分子时,只有能量相近的轨道才能相互杂化。 (2)杂化轨道的数目等于参加杂化的原子轨道的数目。 (3)杂化后的轨道成键能力增强,这主要是杂化轨道的形状发生改变,一端变大,一 端变小,电子云更集中,变大的一端,有利于和其它原子轨道最大重叠,形成的共价键更牢 固,分子更稳定 (4)杂化轨道仍属于原子轨道· 3.杂化轨道的类型 参与杂化的原子轨道的种类和数目不同,可以组成不同类型的杂化轨道。杂化轨道的类 型有很多,本章主要介绍简单的sp型杂化,包括s印、5即和sp三种杂化。 (山)s印杂化原子在形成分子时,同一原子的1个心轨道和1个m轨道之间进行杂化 的过程称为sp杂化。sp杂化形成2个等价的p杂化轨道,每个sp杂化轨道各含有12s和 12即的成分。两个s即杂化轨道的夹角为180°,形成的分子构型呈直线形。因此,sp杂化轨 道又称直线形杂化轨道。 以BC分子的形成为例。Be原子的价电子构型为2s22p。当它与C1原子成键形成 BC分子时,价电子层2s轨道中的1个电子跃迁到1个2p轨道上,使Be原子处于微发 态1s2s2p。Be原子的2s轨道和刚跃进1个电子的2印轨道发生杂化,形成两个等同的sp 杂化轨道。B原子的杂化过程如图32所示。成健时,每个s印杂化轨道的大头与C原子中 成单电子的3印原子轨道以“头碰头”的方式发生重叠,形成两个spp的。键。杂化轨道间的 夹角是180°,所以BeC2分子的空间构型是直线形。空间构型如图3-3所示
间的夹角应该是 90°,而实际上是 104°45′。又如,CH4基态 C 原子的价电子层结构是 2s22p2, 只有两个未成对的电子,按照价键理论 C 原子只能与两个 H 原子形成两个共价单键。但实 验测得,CH4 能形成四个等同的 C-H 键,每个 C-H 键的夹角是 109°28′,CH4的空间构型为 正四面体。为了解释这些现象,1931 年鲍林和斯莱脱(Slater)在价键理论的基础上,提出 了杂化轨道理论。 1.杂化轨道的形成过程 在杂化轨道形成时,首先杂化原子的基态某一轨道上的电子从基态激发到能量较高的空 轨道,形成激发态,激发态的多个轨道再进行混合,重新分配能量和空间取向,组合成为成 键能力更强的新原子轨道,这个过程称为原子轨道的杂化,形成新的原子轨道称为杂化轨道。 2.杂化轨道理论的基本要点 (1)形成分子时,只有能量相近的轨道才能相互杂化。 (2)杂化轨道的数目等于参加杂化的原子轨道的数目。 (3)杂化后的轨道成键能力增强,这主要是杂化轨道的形状发生改变,一端变大,一 端变小,电子云更集中,变大的一端,有利于和其它原子轨道最大重叠,形成的共价键更牢 固,分子更稳定。 (4)杂化轨道仍属于原子轨道。 3.杂化轨道的类型 参与杂化的原子轨道的种类和数目不同,可以组成不同类型的杂化轨道。杂化轨道的类 型有很多,本章主要介绍简单的 s-p 型杂化,包括 sp、sp2和 sp3三种杂化。 (1) sp 杂化 原子在形成分子时,同一原子的 1 个 ns 轨道和 1 个 np 轨道之间进行杂化 的过程称为 sp 杂化。sp 杂化形成 2 个等价的 sp 杂化轨道,每个 sp 杂化轨道各含有 1/2s 和 1/2p 的成分。两个 sp 杂化轨道的夹角为 180°,形成的分子构型呈直线形。因此,sp 杂化轨 道又称直线形杂化轨道。 以 BeCl2 分子的形成为例。Be 原子的价电子构型为 2s22p0。当它与 Cl 原子成键形成 BeCl2 分子时,价电子层 2s 轨道中的 1 个电子跃迁到 1 个 2p 轨道上,使 Be 原子处于激发 态 1s22s12p1。Be 原子的 2s 轨道和刚跃进 1 个电子的 2p 轨道发生杂化,形成两个等同的 sp 杂化轨道。Be 原子的杂化过程如图 3-2 所示。成键时,每个 sp 杂化轨道的大头与 Cl 原子中 成单电子的 3p 原子轨道以“头碰头”的方式发生重叠,形成两个 sp-p 的 σ 键。杂化轨道间的 夹角是 180°,所以 BeCl2分子的空间构型是直线形。空间构型如图 3-3 所示

2s 29 23 2p ]□越日□跳,口 图32Be原子的杂化过程 CaTesa 图33BeCh分子的空间构型 (2)s即杂化原子形成分子时,一个s轨道和两个p轨道进行杂化的过程叫做s杂 化。杂化后,形成3个等同的sp杂化轨道,每个sp杂化轨道各含有1V3s和2/3p成分。杂 化轨道间的夹角为120°,呈平面三角形。 以BF分子的形成为例。B原子的价电子构型是2s2p,成键时,在F原子的影响下, 2s轨道中的一个电子被激发跃迁到一个2印空轨道上。B原子的25轨道与2个含有成单电 子的2p轨道发生杂化,形成三个等同的sp杂化轨道。如图3-4所示。三个杂化轨道分别与 F原子中含有成单电子的2印原子轨道以“头碰头”的方式发生重叠,形成三个。键。实验证 明BF3分子是平面三角形,杂化轨道间夹角是120°,如图3-6a)所示 2s 2p sp- 田□题H□跳,t☐ 图34B原子的杂化过程 (仔)sp杂化原子形成分子时,同一个原子的一个s轨道和三个仰轨道进行杂化的 过程叫做sp杂化。形成四个等同的杂化轨道称为s即杂化轨道,每个杂化轨道各含有14s 和34p成分,杂化轨道间的夹角10928,呈正四面体。例如CH4,C原子的外层电子构型 是2s22p2。C原子杂化时,1个2s电子被激发进入一个2p的空轨道中,使C原子处于激发 态22p2p2p,C原子的2s轨道与3个2印轨道发生杂化,形成4个等同的sp杂化轨 道,C原子的杂化过程如图3-5所示。形成的CH分子空间构型为正四面体,夹角10928', 如图3-6b)所示。 3 2s 2p 风t□越Tttt靴,1tH 图35C原子的杂化过
2s 2p 2s 2p sp 激发 杂化 图 3-2 Be 原子的杂化过程 图 3-3 BeCl2 分子的空间构型 (2)sp2 杂化 原子形成分子时,一个 ns 轨道和两个 np 轨道进行杂化的过程叫做 sp2 杂 化。杂化后,形成 3 个等同的 sp2 杂化轨道,每个 sp2 杂化轨道各含有 1/3s 和 2/3p 成分。杂 化轨道间的夹角为 120°,呈平面三角形。 以 BF3 分子的形成为例。B 原子的价电子构型是 2s22p1,成键时,在 F 原子的影响下, 2s 轨道中的一个电子被激发跃迁到一个 2p 空轨道上。B 原子的 2s 轨道与 2 个含有成单电 子的 2p 轨道发生杂化,形成三个等同的 sp2 杂化轨道。如图 3-4 所示。三个杂化轨道分别与 F 原子中含有成单电子的 2p 原子轨道以“头碰头”的方式发生重叠,形成三个 σ 键。实验证 明 BF3 分子是平面三角形,杂化轨道间夹角是 120°,如图 3-6(a)所示。 2s 2p 2s 2p sp 2 激发 杂化 图 3-4 B 原子的杂化过程 (3) sp3 杂化 原子形成分子时,同一个原子的一个 ns 轨道和三个 np 轨道进行杂化的 过程叫做 sp3 杂化。形成四个等同的杂化轨道称为 sp3 杂化轨道,每个杂化轨道各含有 1/4s 和 3/4p 成分,杂化轨道间的夹角 109°28′,呈正四面体。例如 CH4,C 原子的外层电子构型 是 2s22p2。C 原子杂化时,1 个 2s 电子被激发进入一个 2p 的空轨道中,使 C 原子处于激发 态 1 1 1 1 2 2px2py2pz s、 ,C 原子的 2s 轨道与 3 个 2p 轨道发生杂化,形成 4 个等同的 3 sp 杂化轨 道,C 原子的杂化过程如图 3-5 所示。形成的 CH4分子空间构型为正四面体,夹角 109°28′, 如图 3-6(b)所示。 2s 2p 2s 2p sp 3 激发 杂化 图 3-5 C 原子的杂化过程
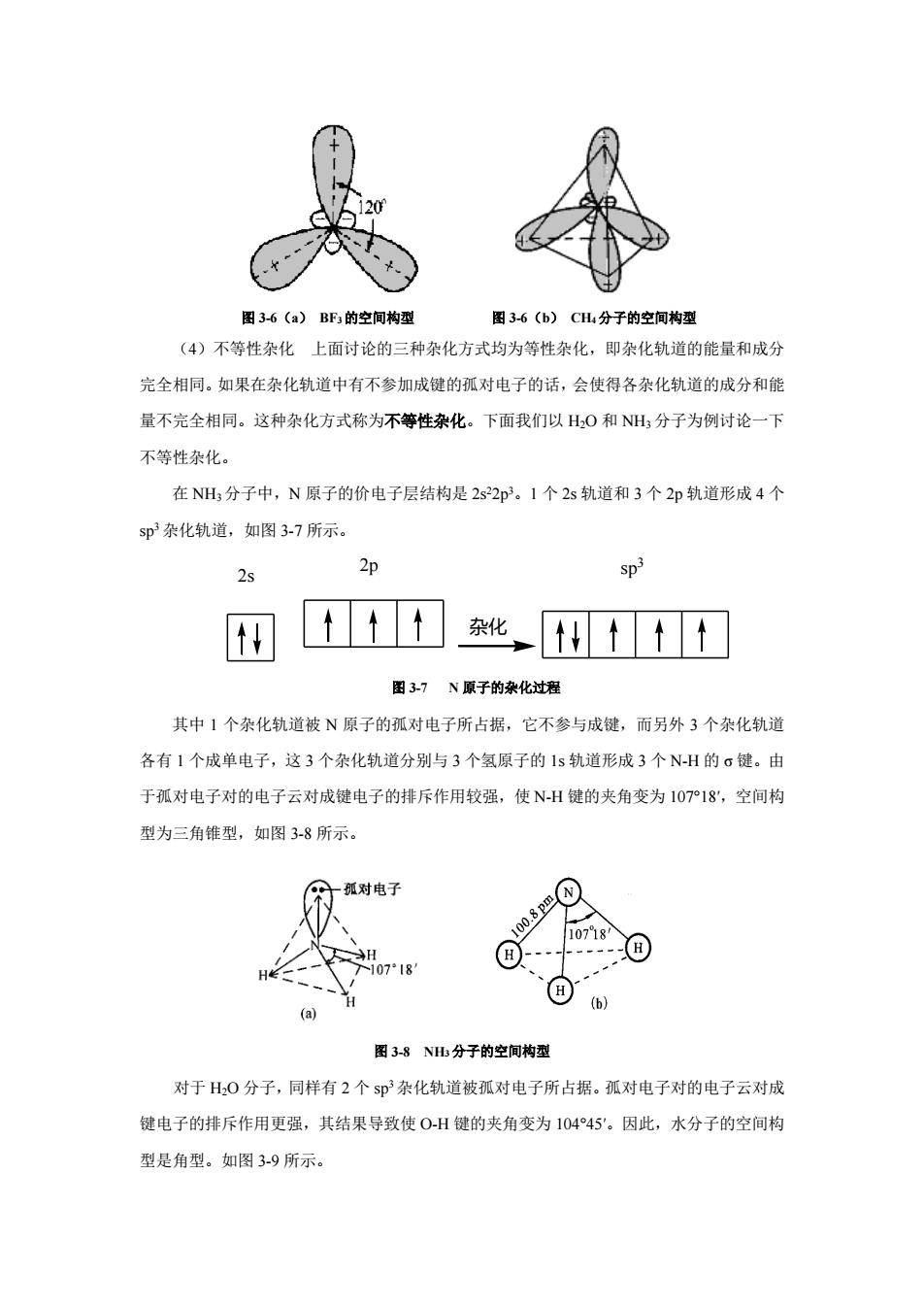
图36(a)BF的空间构型 图36(b)CH分子的空间构型 (4)不等性杂化上面讨论的三种杂化方式均为等性杂化,即杂化轨道的能量和成分 完全相同。如果在杂化轨道中有不参加成键的孤对电子的话,会使得各杂化轨道的成分和能 量不完全相同。这种杂化方式称为不等性杂化。下面我们以H,0和NH,分子为例讨论一下 不等性杂化。 在NH分子中,N原子的价电子层结构是2s22p。1个2s轨道和3个2p轨道形成4个 5p杂化轨道,如图3-7所示。 n 何 化,1t打 图37N原子的杂化过程 其中1个杂化轨道被N原子的孤对电子所占据,它不参与成键,而另外3个杂化轨道 各有1个成单电子,这3个杂化轨道分别与3个氢原子的1s轨道形成3个NH的。键。由 于孤对电子对的电子云对成键电子的排斥作用较强,使NH健的夹角变为107P18,空间构 型为三角锥型,如图3-8所示。 孤对电了 图38N出分子的空间构型 对于H,0分子,同样有2个s即杂化轨道被孤对电子所占据。孤对电子对的电子云对成 键电子的排斥作用更强,其结果导致使OH键的夹角变为10445'。因此,水分子的空间构 型是角型。如图3-9所示
图 3-6(a) BF3的空间构型 图 3-6(b) CH4分子的空间构型 (4)不等性杂化 上面讨论的三种杂化方式均为等性杂化,即杂化轨道的能量和成分 完全相同。如果在杂化轨道中有不参加成键的孤对电子的话,会使得各杂化轨道的成分和能 量不完全相同。这种杂化方式称为不等性杂化。下面我们以 H2O 和 NH3 分子为例讨论一下 不等性杂化。 在 NH3分子中,N 原子的价电子层结构是 2s22p3。1 个 2s 轨道和 3 个 2p 轨道形成 4 个 sp3 杂化轨道,如图 3-7 所示。 2s 2p sp 3 杂化 图 3-7 N 原子的杂化过程 其中 1 个杂化轨道被 N 原子的孤对电子所占据,它不参与成键,而另外 3 个杂化轨道 各有 1 个成单电子,这 3 个杂化轨道分别与 3 个氢原子的 1s 轨道形成 3 个 N-H 的 σ 键。由 于孤对电子对的电子云对成键电子的排斥作用较强,使 N-H 键的夹角变为 107°18′,空间构 型为三角锥型,如图 3-8 所示。 图 3-8 NH3 分子的空间构型 对于 H2O 分子,同样有 2 个 sp3杂化轨道被孤对电子所占据。孤对电子对的电子云对成 键电子的排斥作用更强,其结果导致使 O-H 键的夹角变为 104°45′。因此,水分子的空间构 型是角型。如图 3-9 所示

孤对电子风 0445 0445i 孤对电子 图3-90空间构型 现将杂化类型与空间构型之间的关系归纳成表3-1。 表31杂化类型与分子空间构型之间关系 杂化类型 sp sp 用于杂化的轨道数 2 3 杂化轨道数 3 4 杂化轨道间夹角 180 120° 109.5° 空间构型 直线 平面三角形 正四面体 实例 BeCl2 CO2 BF3 CO32 CHa SO (四)共价键参数 能表征化学键性质的物理量称为键参数。共价键的键参数主要有键能、键长、键角等。 利用键参数可以判断分子的几何构型、分子的极性及热稳定性等性质。 1键能(E) 键能是衡量化学键强弱的物理量,用来反映断开或者形成一个化学键的难易程度。定义 为:在298K和1013kPa下,将1mol气体分子解离为气态原子所需要的能量称为健解离能, 常用单位kJm©l。对于双原子分子,键能就是键解离能。对于多原子分子,键能是各个键解 离能的平均值。单键,双键到叁键,键能越来越大。键能越大,表明键越牢周,由该化学键 形成的分子也越稳定。一些共价键的键能见表3-2。 2.键长(0 分子中两个成键原子核间的平均距离叫键长,常用单位pm(皮米)。一般来说两原子间 的键长越短,表示键越强,共价健越牢周。相同原子间的键长,单键>双键>叁键。一 3.健角 在分子中键与键之间的夹角称为键角。键角和键长都是反应分子几何构型的重要参数。对
图 3-9 H2O 空间构型 现将杂化类型与空间构型之间的关系归纳成表 3-1。 表 3-1 杂化类型与分子空间构型之间关系 杂化类型 sp sp2 sp 3 用于杂化的轨道数 2 3 4 杂化轨道数 2 3 4 杂化轨道间夹角 180° 120° 109.5° 空间构型 直线 平面三角形 正四面体 实例 BeCl2 CO2 BF3 CO3 2- CH4 SO4 2- (四)共价键参数 能表征化学键性质的物理量称为键参数。共价键的键参数主要有键能、键长、键角等。 利用键参数可以判断分子的几何构型、分子的极性及热稳定性等性质。 1.键能(E) 键能是衡量化学键强弱的物理量,用来反映断开或者形成一个化学键的难易程度。定义 为:在 298K 和 101.3kPa 下,将 1mol 气体分子解离为气态原子所需要的能量称为键解离能, 常用单位 kJ/mol。对于双原子分子,键能就是键解离能。对于多原子分子,键能是各个键解 离能的平均值。单键,双键到叁键,键能越来越大。键能越大,表明键越牢固,由该化学键 形成的分子也越稳定。一些共价键的键能见表 3-2。 2.键长(l) 分子中两个成键原子核间的平均距离叫键长,常用单位 pm(皮米)。一般来说两原子间 的键长越短,表示键越强,共价键越牢固。相同原子间的键长,单键>双键>叁键。一 3.键角 在分子中键与键之间的夹角称为键角。键角和键长都是反应分子几何构型的重要参数。对

于双原子分子,分子构型总是直线型的:对于多原子分子,分子中原子在空间的位置不 同,各化学键的夹角不同,分子的几何构型也不同。 三、金属键 (一)金属健的形成 在已知的元素中,金属元素约占80%,和非金属元素相比,它的特点是原子的最外层电 子容易失去,在周态或液态金属中,原子最外层电子可以在遍及整块金属的范围内自由运动, 我们把这些不受约束的电子称为自由电子,当电子从某一原子离开时,原子就变成阳离子, 所以金属内总是包含若原子、阳离子和自由电子。价电子可以自由地从一个原子跑向另一个 原子,这些自由移动的电子起到把许多原了(或离子)粘合在一起的作用,形成金属键。我们 把在金属晶体中的这种由于自由电子运动而使金属原子和金属阳离子间相互结合的化学键 叫金属德。 金属键无方向性和饱和性,无周定的键能。金属键的强弱和自由电子的多少有关,也和 离子半径、电子层结构等其它许多因素有关。 (二)金属晶体 通过金属健作用形成的单质品体称为金属晶体,金属易导电、导热和较好的延展性。 金属的这些性质和金属晶体的结构密不可分。在金属晶体中,存在着许多自由电子,这些自 由电子的运动是没有一定方向的,但在外加电场的条件下自由电子就会发生定向运动,因而 形成电流,所以金属容易导电。金属容易导热,是由于自由电子运动时与金属离子碰撞把能 量从温度高的部分传到温度低的部分,从而使整块金属达到相同的温度。金属品体中由于金 属离子与自由电子间的相互作用没有方向性,各原子层之间发生相对滑动以后,仍可保持这 种相互作用,因而即使在外力作用下,发生形变也不易断裂。 分子间作用力和氢键 一、分子的极性 对于以共价键结合而成的分子,尽管整个分子是电中性的,但分子内部的正、负电荷分 布不一定均匀。假定分子内部存在一个正电荷中心和一个负电荷中心,如果分子内部的正、 负电荷分布均匀,正负电荷中心重叠,这样的分子没有极性,称为非极性分子。如果分子内 部的正、负电荷分布不均匀,正负电荷中心不重叠,这样的分子有极性,称为极性分子。 在整个分子中,根据正负电荷重心是否重合,把分子分为极性分子和非极性分子,分子 的极性与键的极性有关,分为以下几种情况:
于双原子分子,分子构型总是直线型的;对于多原子分子,分子中原子在空间的位置不 同,各化学键的夹角不同,分子的几何构型也不同。 三、金属键 (一)金属键的形成 在已知的元素中,金属元素约占 80%,和非金属元素相比,它的特点是原子的最外层电 子容易失去,在固态或液态金属中,原子最外层电子可以在遍及整块金属的范围内自由运动, 我们把这些不受约束的电子称为自由电子,当电子从某一原子离开时,原子就变成阳离子, 所以金属内总是包含着原子、阳离子和自由电子。价电子可以自由地从一个原子跑向另一个 原子,这些自由移动的电子起到把许多原子(或离子)粘合在一起的作用,形成金属键。我们 把在金属晶体中的这种由于自由电子运动而使金属原子和金属阳离子间相互结合的化学键 叫金属键。 金属键无方向性和饱和性,无固定的键能。金属键的强弱和自由电子的多少有关,也和 离子半径、电子层结构等其它许多因素有关。 (二)金属晶体 通过金属键作用形成的单质晶体称为金属晶体,金属易导电、导热和较好的延展性。 金属的这些性质和金属晶体的结构密不可分。在金属晶体中,存在着许多自由电子,这些自 由电子的运动是没有一定方向的,但在外加电场的条件下自由电子就会发生定向运动,因而 形成电流,所以金属容易导电。金属容易导热,是由于自由电子运动时与金属离子碰撞把能 量从温度高的部分传到温度低的部分,从而使整块金属达到相同的温度。金属晶体中由于金 属离子与自由电子间的相互作用没有方向性,各原子层之间发生相对滑动以后,仍可保持这 种相互作用,因而即使在外力作用下,发生形变也不易断裂。 分子间作用力和氢键 一、分子的极性 对于以共价键结合而成的分子,尽管整个分子是电中性的,但分子内部的正、负电荷分 布不一定均匀。假定分子内部存在一个正电荷中心和一个负电荷中心,如果分子内部的正、 负电荷分布均匀,正负电荷中心重叠,这样的分子没有极性,称为非极性分子。如果分子内 部的正、负电荷分布不均匀,正负电荷中心不重叠,这样的分子有极性,称为极性分子。 在整个分子中,根据正负电荷重心是否重合,把分子分为极性分子和非极性分子,分子 的极性与键的极性有关,分为以下几种情况:

1.对双原子分子来说,分子的极性与化学键的极性一致。由极性键构成的分子为极性 分子,例如HF,HC1,Ⅲ等。由非极性键构成的分子则为非极性分子。例如H,O2,N等。 2.对于多原子分子来说,分子的极性除与键的极性有关外,还与分子的空间构型有关。 由极性健构成多原子分子,空间构型不对称,为极性分子,例如HO,NH,SO2。由极性 键构成多原子分子,如果空间构型对称,则为非极性分子,例如CH4,CO2,CS2等。 分子的极性大小与正负电荷重心间的距离和正负电荷重心所带电荷量的多少有关,称 为偶极矩。所以分子极性的强弱一般用偶极矩“来衡量,若正负电荷重心距离(也称偶极 长)为d,正负电荷重心的电量为q,则有u=dg。 偶极矩u的单位是库米(Cm。 偶极矩是矢量,方向由正电荷重心到负电荷重心。偶极矩为零的分子为非极性分子: 偶极矩不等于0的分子,则为极性分子。分子的偶极矩越大,分子的极性就越大:反之,偶 极矩越小,分子的极性就越小。 二、分子间作用力 分子间作用力是静电引力的一种,但它与化学键又不同,它的能量只是化学键能量的 1/10~1/100. 1873年物理学家范德华首先提出,分子之间存在着作用力,故把这种分子间作用力又称 为范德华力。按照其产生的原因和特点不同,可以分为取向力、诱导力和色散力三种。 1.取向力 取向力产生在极性分子与极性分子之间,当极性分子相互接近时,两极因电性的同性 相斥、异性相吸,使分子发生相对转动,称之为取向。在取向的偶极分子之间,由于静电引 力将相互吸引,当接近到一定距离后,排斥与吸引作用达到相对平衡,体系能量趋于最小值。 这种因极性分子的固有偶极而产生的相互作用,称为取向力。如图3-10所示。 图3-10取向力 图3-11诱导力 取向力的大小,与极性分子的偶极矩有关。分子的极性越大,取向力就越大。 2.诱导力
1.对双原子分子来说,分子的极性与化学键的极性一致。由极性键构成的分子为极性 分子,例如 HF,HCl,HI 等。由非极性键构成的分子则为非极性分子。例如 H2,O2,N2 等。 2.对于多原子分子来说,分子的极性除与键的极性有关外,还与分子的空间构型有关。 由极性键构成多原子分子,空间构型不对称,为极性分子,例如 H2O,NH3,SO2。由极性 键构成多原子分子,如果空间构型对称,则为非极性分子,例如 CH4,CO2,CS2等。 分子的极性大小与正负电荷重心间的距离和正负电荷重心所带电荷量的多少有关,称 为偶极矩。所以分子极性的强弱一般用偶极矩 μ 来衡量,若正负电荷重心距离(也称偶极 长)为 d,正负电荷重心的电量为 q,则有 μ=dq。 偶极矩 μ 的单位是库·米(C·m)。 偶极矩是矢量,方向由正电荷重心到负电荷重心。偶极矩为零的分子为非极性分子; 偶极矩不等于 0 的分子,则为极性分子。分子的偶极矩越大,分子的极性就越大;反之,偶 极矩越小,分子的极性就越小。 二、分子间作用力 分子间作用力是静电引力的一种,但它与化学键又不同,它的能量只是化学键能量的 1/10~1/100。 1873 年物理学家范德华首先提出,分子之间存在着作用力,故把这种分子间作用力又称 为范德华力。按照其产生的原因和特点不同,可以分为取向力、诱导力和色散力三种。 1.取向力 取向力产生在极性分子与极性分子之间,当极性分子相互接近时,两极因电性的同性 相斥、异性相吸,使分子发生相对转动,称之为取向。在取向的偶极分子之间,由于静电引 力将相互吸引,当接近到—定距离后,排斥与吸引作用达到相对平衡,体系能量趋于最小值。 这种因极性分子的固有偶极而产生的相互作用,称为取向力。如图 3-10 所示。 图 3-10 取向力 图 3-11 诱导力 取向力的大小,与极性分子的偶极矩有关。分子的极性越大,取向力就越大。 2.诱导力