
第一章绪论 知识要点 1.有机化合物和有机化学的定义:有机化合物的特性和分类。 2.有机化合物的结构特点及表示方法;共价健的使参数及断裂方式。 3.研究有机化合物的一极程序。 第一节有机化合物和有机化学 一、有机化学起源与发展 有机化合物简称有机物,有机化合物广泛存在于自然界中,与人类的生命活 动密切相关,人类对有机化合物的应用由来已久,最初是从动植物中提取和加工 得到染料、药物和香料等开始。18世纪末人类已经能够得到了枸橼酸、酒石酸、 尿酸和乳酸等纯的化合物。这些从动植物体内得到的化合物与从矿物、水和空气 中得到的物质完全不同。1806年瑞典化学家柏则利乌斯(Bez©lius)把从有生命 的动植物体内得到的化合物定义为有机化合物,研究这些化合物的化学称为有机 化学。并认为有机化合物是在“生命力”的影响下才能生成的神秘物质,人工合 成是不可能的。1828年德国青年化学家维勒(Wohler F)在实验室里通过加热 无机化合物氰酸铵溶液,得到当时公认的有机化合物尿素。随后化学家又 合成了醋酸、油脂等有机化合物,生命力学说才被彻底否定。此后人们又陆续地 合成了许多有机化合物,不断地促进有机化学的发展, 随者科学技术的不断进步,对有机化合物的广泛研究发现,有机化合物都含 有碳元素,绝大多数还含有氢元素,有的还含有氧、氨、卤素、硫、磷等元素。 根据有机化合物的组成,也可以说有机化合物是碳氢化合物及其衍生物。 研究有机化合物的化学称为有机化学(organic chemistry)。有机化学是研究 有机化合物的组成、结构、性质、合成、应用以及它们之间的相互关系和变化规 律的科学。现在虽然仍沿用“有机化合物”和“有机化学”这些名词,但其 中“有机”的含义已发生了变化,失去了其原有意义。 二、有机化合物的特性 有机化合物都含碳元素,由于碳原子的结构和成键特点,使有机化合物的结 构和性质具有特殊性。有机化合物与无机化合物比较,具有以下特性:
第一章 绪 论 知识要点 1.有机化合物和有机化学的定义;有机化合物的特性和分类。 2.有机化合物的结构特点及表示方法;共价键的键参数及断裂方式。 3.研究有机化合物的一般程序。 第一节 有机化合物和有机化学 一、有机化学起源与发展 有机化合物简称有机物,有机化合物广泛存在于自然界中,与人类的生命活 动密切相关,人类对有机化合物的应用由来已久,最初是从动植物中提取和加工 得到染料、药物和香料等开始。18 世纪末人类已经能够得到了枸橼酸、酒石酸、 尿酸和乳酸等纯的化合物。这些从动植物体内得到的化合物与从矿物、水和空气 中得到的物质完全不同。1806 年瑞典化学家柏则利乌斯(Berzelius J)把从有生命 的动植物体内得到的化合物定义为有机化合物,研究这些化合物的化学称为有机 化学。并认为有机化合物是在“生命力”的影响下才能生成的神秘物质,人工合 成是不可能的。1828 年德国青年化学家维勒(Wöhler F)在实验室里通过加热 无机化合物氰酸铵溶液,得到当时公认的有机化合物尿素。随后化学家又 合成了醋酸、油脂等有机化合物,生命力学说才被彻底否定。此后人们又陆续地 合成了许多有机化合物,不断地促进有机化学的发展。 随着科学技术的不断进步,对有机化合物的广泛研究发现,有机化合物都含 有碳元素,绝大多数还含有氢元素,有的还含有氧、氮、卤素、硫、磷等元素。 根据有机化合物的组成,也可以说有机化合物是碳氢化合物及其衍生物。 研究有机化合物的化学称为有机化学(organic chemistry)。有机化学是研究 有机化合物的组成、结构、性质、合成、应用以及它们之间的相互关系和变化规 律的科学。现在虽然仍沿用“有机化合物”和“有机化学”这些名词,但其 中“有机”的含义已发生了变化,失去了其原有意义。 二、有机化合物的特性 有机化合物都含碳元素,由于碳原子的结构和成键特点,使有机化合物的结 构和性质具有特殊性。有机化合物与无机化合物比较,具有以下特性:

1.有机化合物容易燃烧大多数有机化合物容易在空气中燃烧,燃烧时主要 生成二氧化碳和水。而无机化合物一般不易燃烧。 2.有机化合物熔点较低固态有机化合物是靠相对较弱的分子之间作用力 结合而成的分子晶体,破坏这种晶体所需的能量较小,所以有机化合物的熔点较 低,一般不超过400℃。许多有机化合物常温下为液体。而无机化合物中多为离 子键,靠离子间较强的静电作用力形成离子晶体,破坏离子晶体所需的能量较高。 3.有机化合物大多难溶于水而易溶于有机溶剂大多数有机化合物分子的 极性较弱或者是无极性的。根据“相似相溶”原理,它们难溶于极性较强的水, 而易溶于非极性或极性小的有机溶剂。 4.有机化合物一般为非电解质有机化合物中的化学键基本上是共价键,极 性小或无极性。所以一般为非电解质,在水溶液中或熔化状态下难电离,不导电。 5.有机化合物反应速度较慢,反应复杂,常伴有副反应无机化合物的反应 大多是离子反应,反应迅速,瞬间即可完成。而有机化合物分子中的共价键在进 行反应时不易离解为离子,因此比无机化合物反应速度慢,一般需要加热、搅拌 及使用催化剂来加快其反应速度。而且有机化合物进行反应时,受影响的部位可 能不止一个。因此,除主反应外,常伴有副反应发生,反应产物多为混合物。所 以一般书写有机化学反应方程式时只写主产物,反应物与主产物之间用“ 隔开。 6.有机化合物结构复杂、种类繁多由于碳原子之间连接顺序、成键方式和 空间位置的不同,使得有些有机化合物,虽然分子组成相同,但却有不同的分子 结构,性质也不相同,因而不是同一种物质。这种分子组成相同,但具有不同结 构的现象,称为同分异构现象。分子式相同而结构不同的化合物互称为同分异构 体。分子中含碳原子数目越多,同分异构体的数目也就越多。而无机化合物结构 简单,一个分子式只代表一种物质。因此,有机化合物中所含的元素种类虽然 很少,但有机化合物的数目却远远大于无机化合物。 有机化合物一般具有以上通性,但也有例外的情况。例如,四氯化碳不但不 燃烧,而且可用做灭火剂:糖、乙酸、乙醇等在水中极易溶解:作为炸药的梯恩 梯(TNT)、苦味酸等反应都是瞬间完成的 三、有机化学与医药学的关系
1.有机化合物容易燃烧 大多数有机化合物容易在空气中燃烧,燃烧时主要 生成二氧化碳和水。而无机化合物一般不易燃烧。 2.有机化合物熔点较低 固态有机化合物是靠相对较弱的分子之间作用力 结合而成的分子晶体,破坏这种晶体所需的能量较小,所以有机化合物的熔点较 低,一般不超过 400℃。许多有机化合物常温下为液体。而无机化合物中多为离 子键,靠离子间较强的静电作用力形成离子晶体,破坏离子晶体所需的能量较高。 3.有机化合物大多难溶于水而易溶于有机溶剂 大多数有机化合物分子的 极性较弱或者是无极性的。根据“相似相溶”原理,它们难溶于极性较强的水, 而易溶于非极性或极性小的有机溶剂。 4.有机化合物一般为非电解质 有机化合物中的化学键基本上是共价键,极 性小或无极性。所以一般为非电解质,在水溶液中或熔化状态下难电离,不导电。 5.有机化合物反应速度较慢,反应复杂,常伴有副反应 无机化合物的反应 大多是离子反应,反应迅速,瞬间即可完成。而有机化合物分子中的共价键在进 行反应时不易离解为离子,因此比无机化合物反应速度慢,一般需要加热、搅拌 及使用催化剂来加快其反应速度。而且有机化合物进行反应时,受影响的部位可 能不止一个。因此,除主反应外,常伴有副反应发生,反应产物多为混合物。所 以一般书写有机化学反应方程式时只写主产物,反应物与主产物之间用“ ” 隔开。 6.有机化合物结构复杂、种类繁多 由于碳原子之间连接顺序、成键方式和 空间位置的不同,使得有些有机化合物,虽然分子组成相同,但却有不同的分子 结构,性质也不相同,因而不是同一种物质。这种分子组成相同,但具有不同结 构的现象,称为同分异构现象。分子式相同而结构不同的化合物互称为同分异构 体。分子中含碳原子数目越多,同分异构体的数目也就越多。而无机化合物结构 简单,一个分子式只代表一种物质。因此,有机化合物中所含的元素种类虽然 很少,但有机化合物的数目却远远大于无机化合物。 有机化合物一般具有以上通性,但也有例外的情况。例如,四氯化碳不但不 燃烧,而且可用做灭火剂;糖、乙酸、乙醇等在水中极易溶解;作为炸药的梯恩 梯(TNT)、苦味酸等反应都是瞬间完成的。 三、有机化学与医药学的关系

有机化学是医药学的一门重要的专业基础学科。医药学的研究是为人服务的, 人体的组成成分大部分是有机化合物,人体自身的变化就是一系列非常复杂、彼 此制约、相互协调的有机化合物的变化过程。 药学与有机化学密切相关。人类用于防病治病的药物绝大部分是有机化合 物,如对乙酰氨基酚(扑热息痛)、乙酰水杨酸(阿司匹林),特别是中草药的有效 成分几乎全部是有机化合物。中草药主要来自植物:生化药物来自动物组织:抗 生素大多来自微生物,也有合成或半合成品:合成药则是由有机化学的合成原理 和方法制取的。这些有机物质要想符合药用要求,一般都需先用化学方法加工炮 制、提取或精制。对中草药有效成分的分析研究,要经过提取、分离、测定结构、 人工合成等步骤,所有这些研究程序,都离不开有机化学的基本理论和实验方法。 中药具有非常复杂的成分。一种中药往往具有多种功效,这与中药本身含有 多种有效成分有关。为了达到治疗疾病的目的,就必须对中药采用化学方法进行 炮制,保留或增强其有效成分,减轻或消除无用的或有毒副作用的成分。药物的 合成,必须熟悉有机化学反应的特点和方法,才能选择合理的合成路线。此外, 中药的鉴定、贮存、剂型的改革,药物的开发和创新,药物结构与药效关系的研 究,药物的质量管理等,都必须清楚药物的组成或结构、理化性质,具备丰富的 有机化学知识。 学好有机化学是医药各专业学生深入贯通医药学各专业课程的必要条件,也 是应对未来专业岗位、探索医药学未知领域的最基本手段。因此,医药专业的学 生需要掌握一定的有机化学基础理论和基本技能,并且能利用有机化学的理论和 方法去了解中药的主要活性成分、作用机制,以及相应的分离、合成、配伍、分 析研究等一系列技术问题。为毕业以后的实际工作打下牢固的基础。 第二节有机化合物的结构 有机化合物的结构包括分子的组成、分子内原子间的连接顺序、排列方式、 化学键和空间构型及分子中电子云的分布等。有机化合物除含碳元素外,还含有 氢、氧、氮、卤素、硫、磷等元素。有机化合物有上千万种,这与碳原子的结构 及其独特的成键方式是分不开的。 一、碳原子的成键特点 1.碳原子总是4价碳原子的核外电子排布式为1s22s22p2,其最外电子
有机化学是医药学的一门重要的专业基础学科。医药学的研究是为人服务的, 人体的组成成分大部分是有机化合物,人体自身的变化就是一系列非常复杂、彼 此制约、相互协调的有机化合物的变化过程。 药学与有机化学密切相关。人类用于防病治病的药物绝大部分是有机化合 物,如对乙酰氨基酚(扑热息痛)、乙酰水杨酸(阿司匹林),特别是中草药的有效 成分几乎全部是有机化合物。中草药主要来自植物;生化药物来自动物组织;抗 生素大多来自微生物,也有合成或半合成品;合成药则是由有机化学的合成原理 和方法制取的。这些有机物质要想符合药用要求,一般都需先用化学方法加工炮 制、提取或精制。对中草药有效成分的分析研究,要经过提取、分离、测定结构、 人工合成等步骤,所有这些研究程序,都离不开有机化学的基本理论和实验方法。 中药具有非常复杂的成分。一种中药往往具有多种功效,这与中药本身含有 多种有效成分有关。为了达到治疗疾病的目的,就必须对中药采用化学方法进行 炮制,保留或增强其有效成分,减轻或消除无用的或有毒副作用的成分。药物的 合成,必须熟悉有机化学反应的特点和方法,才能选择合理的合成路线。此外, 中药的鉴定、贮存、剂型的改革,药物的开发和创新,药物结构与药效关系的研 究,药物的质量管理等,都必须清楚药物的组成或结构、理化性质,具备丰富的 有机化学知识。 学好有机化学是医药各专业学生深入贯通医药学各专业课程的必要条件,也 是应对未来专业岗位、探索医药学未知领域的最基本手段。因此,医药专业的学 生需要掌握一定的有机化学基础理论和基本技能,并且能利用有机化学的理论和 方法去了解中药的主要活性成分、作用机制,以及相应的分离、合成、配伍、分 析研究等一系列技术问题。为毕业以后的实际工作打下牢固的基础。 第二节 有机化合物的结构 有机化合物的结构包括分子的组成、分子内原子间的连接顺序、排列方式、 化学键和空间构型及分子中电子云的分布等。有机化合物除含碳元素外,还含有 氢、氧、氮、卤素、硫、磷等元素。有机化合物有上千万种,这与碳原子的结构 及其独特的成键方式是分不开的。 一、碳原子的成键特点 1.碳原子总是 4 价 碳原子的核外电子排布式为 1s2 2s2 2p2 ,其最外电子

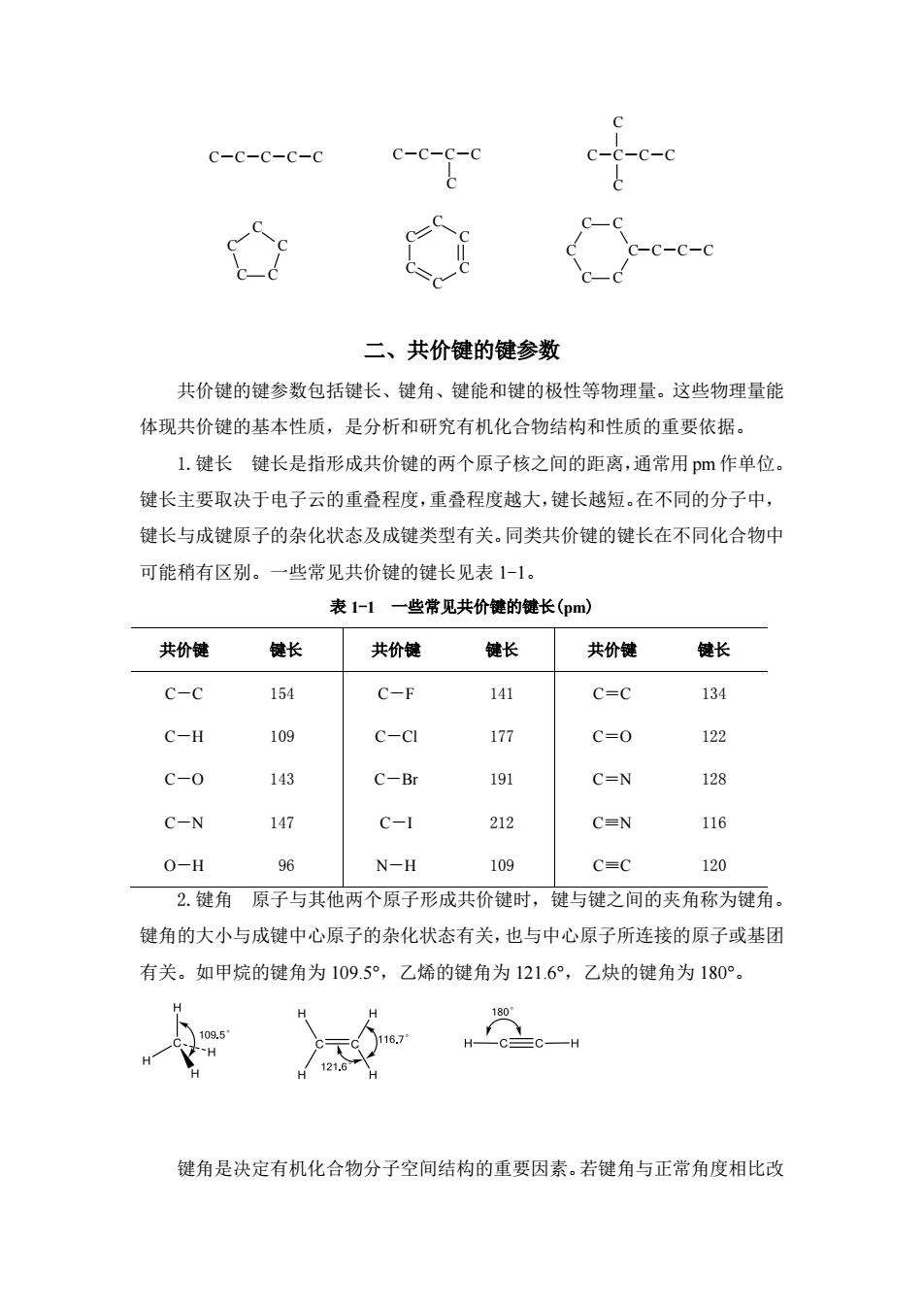
层有4个电子,要通过得到或失去电子达到稳定的电子构型都是不容易的,它往 往通过共用电子对(电子云重叠)与其他原子成键。因此,在有机化合物分子中碳 有4个共价键,碳原子总是4价的。 2.共价键的类型成键时由于原子轨道重叠方式的不同,共价键分为σ键 和π键。两个原子轨道沿着轨道的对称轴方向以“头碰头”的方式相互重叠所形 成的共价键叫。键。s轨道和s轨道之间、s轨道和p轨道之间、p轨道和p轨道 之间均可以形成。键(图1-1)。由两个对称轴相互平行的p轨道以“肩并肩”方 式,从侧面相互重叠所形成的共价键叫π键(图1-2)。 图1-1键的形成 图1-2键的形成 图一1键的形成 图1-2π键的形成 σ键的电子云呈圆柱形对称分布于键轴周围,可以绕键轴自由旋转,说明σ 键电子云比较集中,受两核的约束较大,不易受外电场的影响,因此,。键不易 断裂,性质稳定:而π键的电子云分布于键轴的上下两边,轨道重叠程度较小, 说明π键电子云比较分散,受两核的约束较小,易受外电场的影响,因此,π键 容易断裂,性质较活泼:。键比π键牢固。有机化合物中的单键都是σ键,π键 不能单独存在,只能与σ键共存于双键或叁键之中。 3.碳原子之间的连接方式碳原子不仅能与氢、氧、氮、卤素等原子形成 共价键,而且碳原子之间也可以通过共价键自相结合,称为自相成键。 碳原子之间可以通过共用电子对形成单键、双键或参键。共用一对电子的键叫做 单键,用“一”表示:共用两对电子的键叫做双键,用“一”表示:共用三对 电子的键叫做叁键,用“=”表示。如: HH H-C-C-H HXC-C<H H-C=C-H HH 乙烷 乙烯 乙炔 碳原子之间也可以相互连接成各种不同的链状和环状,从而构成有机化合物 的基本骨架。如:
层有 4 个电子,要通过得到或失去电子达到稳定的电子构型都是不容易的,它往 往通过共用电子对(电子云重叠)与其他原子成键。因此,在有机化合物分子中碳 有 4 个共价键,碳原子总是 4 价的。 2.共价键的类型 成键时由于原子轨道重叠方式的不同,共价键分为 σ 键 和 π 键。两个原子轨道沿着轨道的对称轴方向以“头碰头”的方式相互重叠所形 成的共价键叫 σ 键。s 轨道和 s 轨道之间、s 轨道和 p 轨道之间、p 轨道和 p 轨道 之间均可以形成 σ 键(图 1-1)。由两个对称轴相互平行的 p 轨道以“肩并肩”方 式,从侧面相互重叠所形成的共价键叫 π 键(图 1-2)。 图 1-1 σ 键的形成 图 1-2 π 键的形成 σ 键的电子云呈圆柱形对称分布于键轴周围,可以绕键轴自由旋转,说明 σ 键电子云比较集中,受两核的约束较大,不易受外电场的影响,因此,σ 键不易 断裂,性质稳定;而 π 键的电子云分布于键轴的上下两边,轨道重叠程度较小, 说明 π 键电子云比较分散,受两核的约束较小,易受外电场的影响,因此,π 键 容易断裂,性质较活泼;σ 键比 π 键牢固。有机化合物中的单键都是 σ 键,π 键 不能单独存在,只能与 σ 键共存于双键或叁键之中。 3.碳原子之间的连接方式 碳原子不仅能与氢、氧、氮、卤素等原子形成 共价键,而且碳 原 子 之 间 也 可 以 通 过 共 价 键 自 相 结 合 ,称 为 自相成键 。 碳原子之间可以通过共用电子对形成单键、双键或叁键。共用一对电子的键叫做 单键,用“—”表示;共用两对电子的键叫做双键,用“ ”表示;共用三对 电子的键叫做叁键,用“ ”表示。如: H-C-C-H H H H H C H-C C-H H H H H C 乙烷 乙烯 乙炔 碳原子之间也可以相互连接成各种不同的链状和环状,从而构成有机化合物 的基本骨架。如: 图 1-1 σ 键的形成 图 1-2 π 键的形成
C-C-C-C-C c-c-1 -C-C- 二、共价键的键参数 共价键的键参数包括键长、键角、键能和键的极性等物理量。这些物理量能 体现共价键的基本性质,是分析和研究有机化合物结构和性质的重要依据。 1.键长键长是指形成共价键的两个原子核之间的距离,通常用pm作单位。 键长主要取决于电子云的重叠程度,重叠程度越大,键长越短。在不同的分子中, 键长与成键原子的杂化状态及成键类型有关。同类共价键的键长在不同化合物中 可能稍有区别。 些常见共价键的键长见表1-1。 表1-1一些常见共价键的健长(pm) 共价健 键长 共价健 健长 共价键 键长 c-c C-F 141 C=C 134 C-H 109 C-CI 177 C=0 12 c-0 143 C-Br 多 C=N 128 C-N 147 c-1 212 C=N 116 0-H 96 N-H 109 C≡C 120 2.键角原子与其他两个原子形成共价键时,键与键之间的夹角称为键角。 键角的大小与成键中心原子的杂化状态有关,也与中心原子所连接的原子或基团 有关。如甲烷的键角为109.5°,乙烯的键角为121.6°,乙炔的键角为180° w。 键角是决定有机化合物分子空间结构的重要因素。若键角与正常角度相比改
C C C C C C C C C C C C C C C C C -C-C-C C-C-C-C-C C-C-C-C C C C-C-C-C C 二、共价键的键参数 共价键的键参数包括键长、键角、键能和键的极性等物理量。这些物理量能 体现共价键的基本性质,是分析和研究有机化合物结构和性质的重要依据。 1.键长 键长是指形成共价键的两个原子核之间的距离,通常用 pm 作单位。 键长主要取决于电子云的重叠程度,重叠程度越大,键长越短。在不同的分子中, 键长与成键原子的杂化状态及成键类型有关。同类共价键的键长在不同化合物中 可能稍有区别。一些常见共价键的键长见表 1-1。 表 1-1 一些常见共价键的键长(pm) 共价键 键长 共价键 键长 共价键 键长 C-C 154 C-F 141 C=C 134 C-H 109 C-Cl 177 C=O 122 C-O 143 C-Br 191 C=N 128 C-N 147 C-I 212 C≡N 116 O-H 96 N-H 109 C≡C 120 2.键角 原子与其他两个原子形成共价键时,键与键之间的夹角称为键角。 键角的大小与成键中心原子的杂化状态有关,也与中心原子所连接的原子或基团 有关。如甲烷的键角为 109.5°,乙烯的键角为 121.6°,乙炔的键角为 180°。 键角是决定有机化合物分子空间结构的重要因素。若键角与正常角度相比改

变过大,就会影响分子的稳定性,导致一些特殊的性质。 3.键能双原子分子的共价键裂解时所吸收的能量,称为该共价键的键能 又称为离解能。但对于多原子分子,键能与离解能是不同的,其键能是指分子中 同类共价键的平均离解能。键能是共价键强度的重要标志。一般来说,相同类型 的共价键中,键能越大,共价键越稳定。常见的共价键的键能见表1-2。 表1-2常见共价键的平均键能(kJ/mol) 共价健 健能 共价键 健能 共价健 健能 C-H 414 C-F 485 C=C 611 c-c 347 C-CI 349 C=C 837 C-0 360 C-Br 285 C=N 891 C-N 306 C-1 218 C=0(醛) 736 0-H 464 N-H 389 C=O(酮) 749 4.键的极性两个相同原子形成共价键时,电子云对称分布在两个原子之间 这样的共价键无极性,是非极性共价键。但两个不同原子形成共价键时,由于成 键两原子吸引电子的能力(电负性)不同,电子云偏向电负性较大的原子一端,使 其带有部分负电荷,用“8”表示:电负性较小的原子带部分正电荷,用“8+” 表示。所以两个不同原子形成的共价键具有极性,是极性共价键。如:H+-C心、 HC+C。共价键极性的大小,取决于成键两原子电负性之差,差值越大,键 的极性就越大。有机化学中常见元素的电负性值见表1-3。 表1-3有机化学中常见元素的电负性值 元素H C N O F CI Br I S.P 电负性2.12.53.03.54.03.02.92.52.52.2 键的极性大小一般用偶极矩()表示,偶极矩数值越大,表明键的极性越大。 偶极矩就是正或负电荷中心的电荷量()与两电荷中心之间距离(d)的乘积,即4 =qXd。偶极矩的SI单位为库仑米(Cm)。常用的单位为德拜(Debye),简写 为D,1D=3.34×10-0℃m。常见共价键的偶极矩见表1-4。偶极矩具有方向性, 用十→表示,箭头指向带负电荷一端。如:
变过大,就会影响分子的稳定性,导致一些特殊的性质。 3.键能 双原子分子的共价键裂解时所吸收的能量,称为该共价键的键能, 又称为离解能。但对于多原子分子,键能与离解能是不同的,其键能是指分子中 同类共价键的平均离解能。键能是共价键强度的重要标志。一般来说,相同类型 的共价键中,键能越大,共价键越稳定。常见的共价键的键能见表 1-2。 表 1-2 常见共价键的平均键能(kJ/mol) 共价键 键能 共价键 键能 共价键 键能 C-H 414 C-F 485 C=C 611 C-C 347 C-Cl 349 C≡C 837 C-O 360 C-Br 285 C≡N 891 C-N 306 C-I 218 C=O(醛) 736 O-H 464 N-H 389 C=O(酮) 749 4.键的极性 两个相同原子形成共价键时,电子云对称分布在两个原子之间, 这样的共价键无极性,是非极性共价键。但两个不同原子形成共价键时,由于成 键两原子吸引电子的能力(电负性)不同,电子云偏向电负性较大的原子一端,使 其带有部分负电荷,用“δ -”表示;电负性较小的原子带部分正电荷,用“δ +” 表示。所以两个不同原子形成的共价键具有极性,是极性共价键。如:H δ+ -Clδ- 、 H3C δ+ -Clδ-。共价键极性的大小,取决于成键两原子电负性之差,差值越大,键 的极性就越大。有机化学中常见 元 素的 电 负 性值 见 表 1-3。 表 1-3 有机化学中常见元素的电负性值 元 素 H C N O F Cl Br I S P 电负性 2.1 2.5 3.0 3.5 4.0 3.0 2.9 2.5 2.5 2.2 键的极性大小一般用偶极矩(µ)表示,偶极矩数值越大,表明键的极性越大。 偶极矩就是正或负电荷中心的电荷量(q)与两电荷中心之间距离(d )的乘积,即 µ =q×d。偶极矩的 SI 单位为库仑·米(C·m)。常用的单位为德拜(Debye),简写 为 D,1D=3.34×10-30C·m。常见共价键的偶极矩见表 1-4。偶极矩具有方向性, 用 表示,箭头指向带负电荷一端。如: CH3 I H Cl δ δ δ δ + - + -
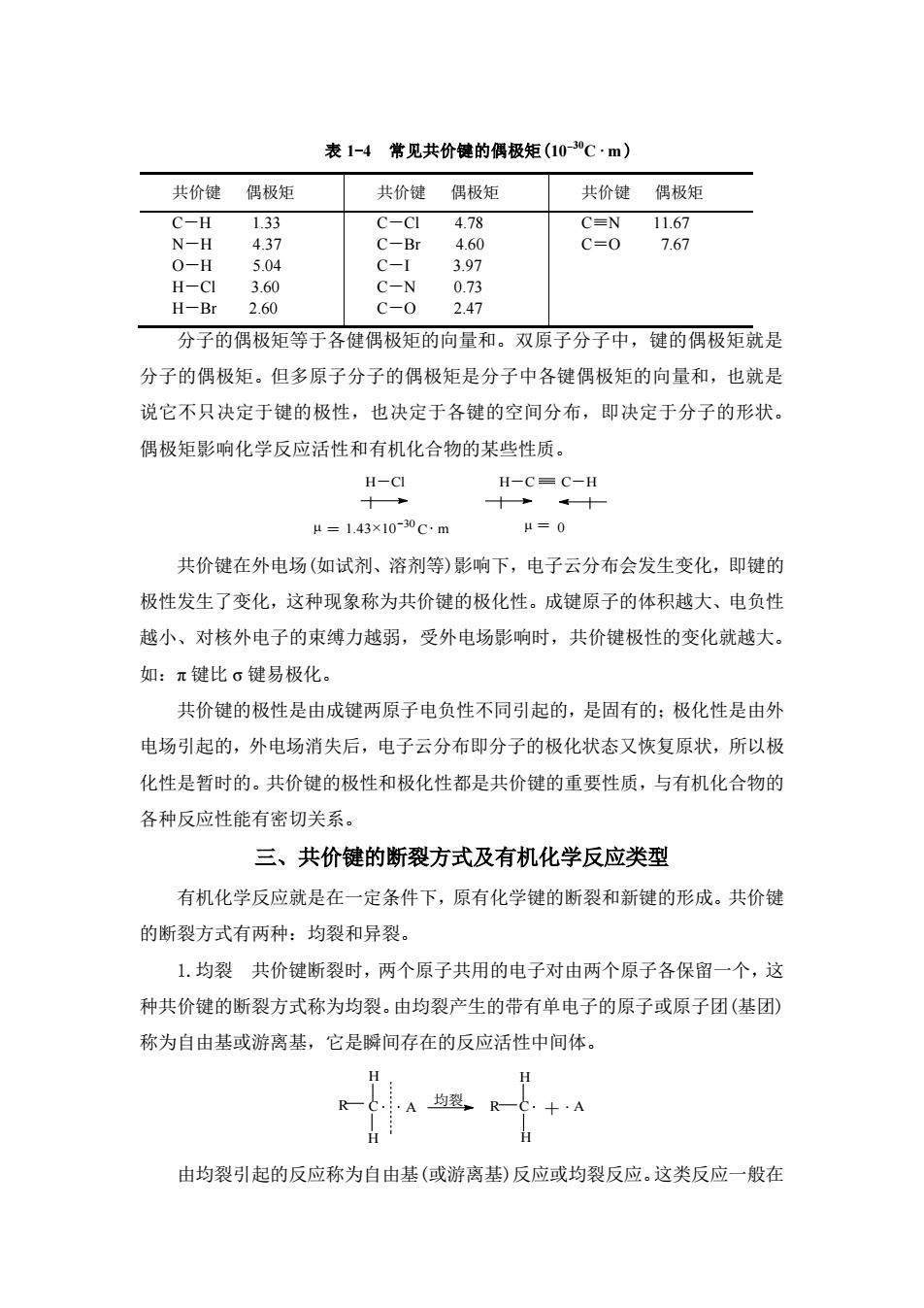
表1-4常见共价键的偶极矩(10”C·m) 共价键偶极矩 共价键偶极矩 共价键偶极矩 C-H1.33 C-C14.78 CEN 11.67 N-H 4.3 C-Br 4.60 C=0 7.67 0-H 5.04 C-1 3.97 H-CI 3.6 C-N 0.73 H-Br 2.60 C-0 2.47 分子的偶极矩等于各健偶极矩的向量和。双原子分子中,键的偶极矩就是 分子的偶极矩。但多原子分子的偶极矩是分子中各键偶极矩的向量和,也就是 说它不只决定于键的极性,也决定于各键的空间分布,即决定于分子的形状。 偶极矩影响化学反应活性和有机化合物的某些性质。 H-CI 十+ μ=1.43×10-30cm μ=0 共价键在外电场(如试剂、溶剂等)影响下,电子云分布会发生变化,即键的 极性发生了变化,这种现象称为共价键的极化性。成键原子的体积越大、电负性 越小、对核外电子的束缚力越弱,受外电场影响时,共价键极性的变化就越大 如:π键比。键易极化。 共价键的极性是由成键两原子电负性不同引起的,是固有的:极化性是由外 电场引起的,外电场消失后,电子云分布即分子的极化状态又恢复原状,所以极 化性是暂时的。共价键的极性和极化性都是共价键的重要性质,与有机化合物的 各种反应性能有密切关系。 三、共价键的断裂方式及有机化学反应类型 有机化学反应就是在一定条件下,原有化学键的断裂和新键的形成。共价键 的断裂方式有两种:均裂和异裂。 1.均裂共价键断裂时,两个原子共用的电子对由两个原子各保留一个,这 种共价键的断裂方式称为均裂。由均裂产生的带有单电子的原子或原子团(基团) 称为自由基或游离基,它是瞬间存在的反应活性中间体。 H A均器,R 十A 由均裂引起的反应称为自由基(或游离基)反应或均裂反应。这类反应一般在
表 1-4 常见共价键的偶极矩(10ˉ30C ·m ) 共价键 偶极矩 共价键 偶极矩 共价键 偶极矩 C-H 1.33 N-H 4.37 O-H 5.04 H-Cl 3.60 H-Br 2.60 C-Cl 4.78 C-Br 4.60 C-I 3.97 C-N 0.73 C-O 2.47 C≡N 11.67 C=O 7.67 分子的偶极矩等于各健偶极矩的向量和。双原子分子中,键的偶极矩就是 分子的偶极矩。但多原子分子的偶极矩是分子中各键偶极矩的向量和,也就是 说它不只决定于键的极性,也决定于各键的空间分布,即决定于分子的形状。 偶极矩影响化学反应活性和有机化合物的某些性质。 H-Cl H-C C-H μ = 1.43×10 μ = 0 -30C m 共价键在外电场(如试剂、溶剂等)影响下,电子云分布会发生变化,即键的 极性发生了变化,这种现象称为共价键的极化性。成键原子的体积越大、电负性 越小、对核外电子的束缚力越弱,受外电场影响时,共价键极性的变化就越大。 如:π 键比 σ 键易极化。 共价键的极性是由成键两原子电负性不同引起的,是固有的;极化性是由外 电场引起的,外电场消失后,电子云分布即分子的极化状态又恢复原状,所以极 化性是暂时的。共价键的极性和极化性都是共价键的重要性质,与有机化合物的 各种反应性能有密切关系。 三、共价键的断裂方式及有机化学反应类型 有机化学反应就是在一定条件下,原有化学键的断裂和新键的形成。共价键 的断裂方式有两种:均裂和异裂。 1.均裂 共价键断裂时,两个原子共用的电子对由两个原子各保留一个,这 种共价键的断裂方式称为均裂。由均裂产生的带有单电子的原子或原子团(基团) 称为自由基或游离基,它是瞬间存在的反应活性中间体。 R C A H R C H + A H H 均裂 由均裂引起的反应称为自由基(或游离基)反应或均裂反应。这类反应一般在

较高温度或光照等条件下进行。自由基反应包括自由基取代反应和自由基加成反 应。自由基反应参与许多有机体的生理或病理反应代谢过程,是有机化学中的重 要反应之一。 2异裂共价键断裂时,两个原子共用的电子对归一个原子所有,产生正、 负离子,这种共价键的断裂方式称为异裂。碳与其他原子间的。键异裂可得到碳 正离子或碳负离子。它们也是瞬间存在的反应活性中间体,与可以稳定存在的无 机物的正、负离子不同。 H H ++:A H A异裂R一C:+A 由异裂引起的反应称为离子型反应或异裂反应。这类反应除了催化剂外,多 在极性溶剂中进行。根据反应试剂的类型不同,离子型反应又可分为: 「亲电取代反应 亲电反应 离子型反应 (亲电加成反应 亲核取代反应 亲核反应 【亲核加成反应 四、有机化合物结构的表示方法 有机化合物一般用能表明分子组成和结构的结构式(蛛网式)、结构简式和 键线式表示。因为有机化合物普遍存在着同分异构现象,往往几种物质具有相同 的分子式。所以有机化合物一般不用分子式表示。 结构式中用短线代表共价键,标出分子中每个原子之间的连接顺序和成键方 式。为了简便,通常用的是结构简式,省略表示化学键的短线,合并相同碳原子 上的氢原子等。结构式和结构简式都能反映有机化合物的分子中原子种类和数目 原子间的连接顺序和方式。另外还可以用只由短线和除碳、碳氢基团以外的其他 原子(基团)来表示的键线式。一般有环状结构的有机化合物多用键线式。见表 1-5。 表1-5结构式、结构简式和键线式示例 名称、分子式 结构式 结构简式 键线式
较高温度或光照等条件下进行。自由基反应包括自由基取代反应和自由基加成反 应。自由基反应参与许多有机体的生理或病理反应代谢过程,是有机化学中的重 要反应之一。 2.异裂 共价键断裂时,两个原子共用的电子对归一个原子所有,产生正、 负离子,这种共价键的断裂方式称为异裂。碳与其他原子间的 σ 键异裂可得到碳 正离子或碳负离子。它们也是瞬间存在的反应活性中间体,与可以稳定存在的无 机物的正、负离子不同。 R C A H R C H 异裂 + A + - H H R C A H R C H 异裂 + A + - H H 由异裂引起的反应称为离子型反应或异裂反应。这类反应除了催化剂外,多 在极性溶剂中进行。根据反应试剂的类型不同,离子型反应又可分为: 离子型反应 亲电反应 亲核反应 亲电取代反应 亲核取代反应 亲电加成反应 亲核加成反应 四、有机化合物结构的表示方法 有机化合物一般用能表明分子组成和结构的结构式(蛛网式)、结构简式和 键线式表示。因为有机化合物普遍存在着同分异构现象,往往几种物质具有相同 的分子式。所以有机化合物一般不用分子式表示。 结构式中用短线代表共价键,标出分子中每个原子之间的连接顺序和成键方 式。为了简便,通常用的是结构简式,省略表示化学键的短线,合并相同碳原子 上的氢原子等。结构式和结构简式都能反映有机化合物的分子中原子种类和数目、 原子间的连接顺序和方式。另外还可以用只由短线和除碳、碳氢基团以外的其他 原子(基团)来表示的键线式。一般有环状结构的有机化合物多用键线式。见表 1-5。 表 1-5 结构式、结构简式和键线式示例 名称、分子式 结构式 结构简式 键线式
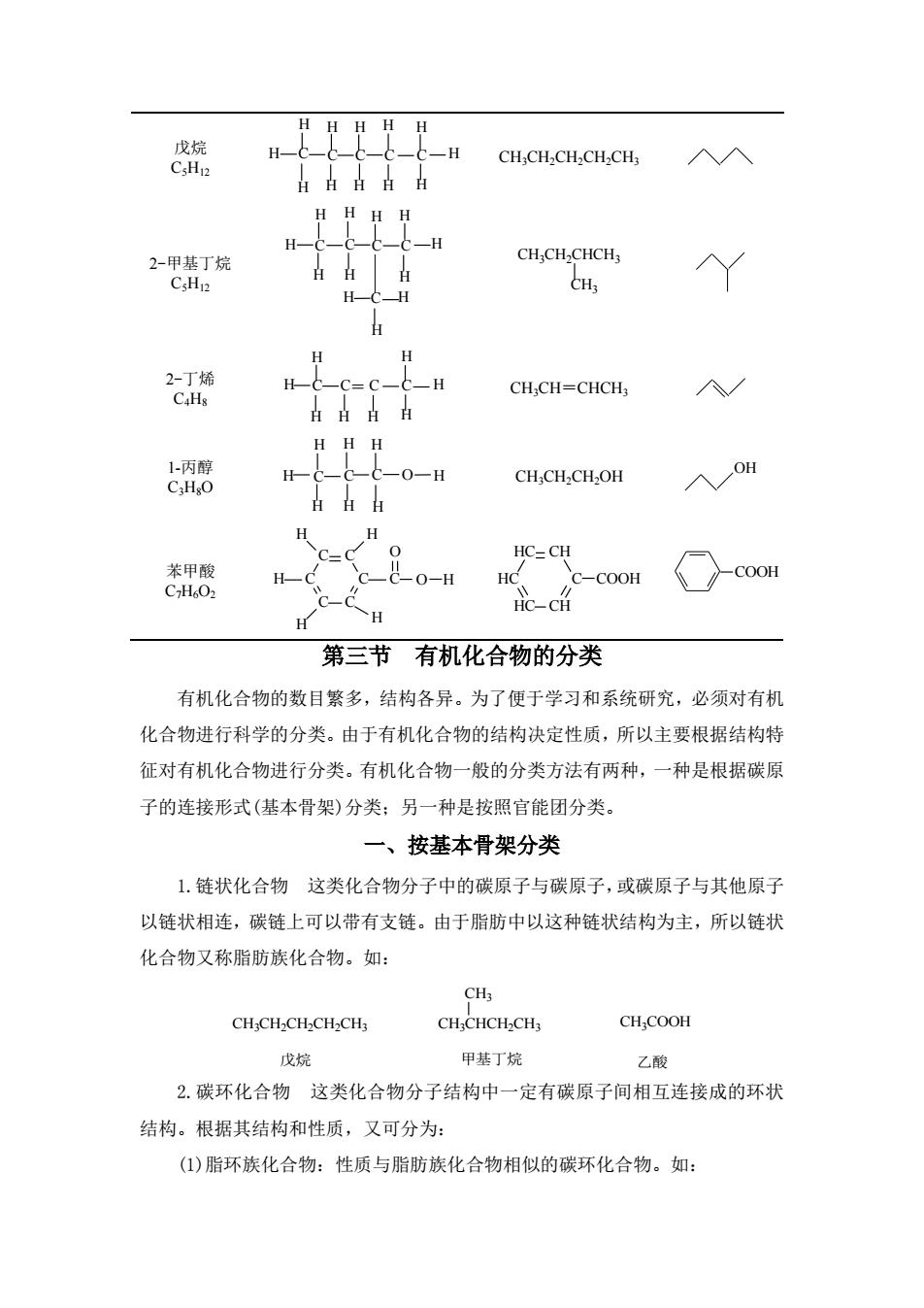
戊烷 c-H CH:CH2CH2CH2CH; 入入 HHHH H -H 2-甲基丁烷 CHCH CHCH H H 2-丁烯 Hc-c-c-c-H CHCH=CHCH C.Hs 日日点H HHH 小丙醇 CHO H-c-C-c-0-H CH CHCHOH OH H H C=c HC=CH 装甲酸 CHO C-C-0-H Hc C-COOH COOH HC-CH H H 第三节有机化合物的分类 有机化合物的数目繁多,结构各异。为了便于学习和系统研究,必须对有机 化合物进行科学的分类。由于有机化合物的结构决定性质,所以主要根据结构特 征对有机化合物进行分类。有机化合物一般的分类方法有两种,一种是根据碳原 子的连接形式(基本骨架)分类:另一种是按照官能团分类。 一、按基本骨架分类 1.链状化合物这类化合物分子中的碳原子与碳原子,或碳原子与其他原子 以链状相连,碳链上可以带有支链。由于脂肪中以这种链状结构为主,所以链状 化合物又称脂肪族化合物。如: CH:CH-CH-CH CH: CHCHCH-CHs CHCOOH 戊烷 甲基丁烷 乙酸 2.碳环化合物这类化合物分子结构中一定有碳原子间相互连接成的环状 结构。根据其结构和性质,又可分为: (1)脂环族化合物:性质与脂肪族化合物相似的碳环化合物。如:
戊烷 C5H12 C C C C C H H H H H H H H H H H H CH3CH2CH2CH2CH3 2-甲基丁烷 C5H12 H C C C C C H H H H H H H H H H H CH3CH2CHCH3 CH3 2-丁烯 C4H8 C C C C H H H H H H H = H CH3CH=CHCH3 1-丙醇 C3H8O C C C H H H H H H H O H CH3CH2CH2OH OH 苯甲酸 C7H6O2 C C C C C C C H H H H H O H O C HC C CH C CH COOH H H COOH 第三节 有机化合物的分类 有机化合物的数目繁多,结构各异。为了便于学习和系统研究,必须对有机 化合物进行科学的分类。由于有机化合物的结构决定性质,所以主要根据结构特 征对有机化合物进行分类。有机化合物一般的分类方法有两种,一种是根据碳原 子的连接形式(基本骨架)分类;另一种是按照官能团分类。 一、按基本骨架分类 1.链状化合物 这类化合物分子中的碳原子与碳原子,或碳原子与其他原子 以链状相连,碳链上可以带有支链。由于脂肪中以这种链状结构为主,所以链状 化合物又称脂肪族化合物。如: CH3CH2CH2CH2CH3 CH3COOH 戊烷 甲基丁烷 乙酸 CH3CHCH2CH3 CH3 2.碳环化合物 这类化合物分子结构中一定有碳原子间相互连接成的环状 结构。根据其结构和性质,又可分为: (1)脂环族化合物:性质与脂肪族化合物相似的碳环化合物。如:

OH DCt, cH 〉CHGH 环戊烷 甲基环丙烷 薄荷醇 (②)芳香族化合物:大多含有苯环结构,而且具有特殊性质的化合物。如: ◆ ○c4, 甲茶 3.杂环化合物这类化合物分子中的环是由碳原子和氧、氨、硫等原子 连接而成的。如: 吡略 呋喃 噻吩 二、按官能团分类 有机化合物分子中最容易发生化学反应的原子或原子团(基团)称为官能团。 含有相同官能团的有机化合物,其主要化学性质相似。常见的官能团及化合物 类别见表1-6。 表1-6常见的官能团及化合物的类别 宫能团 化合物类别 官能团 化合物类别 碳碳双键 烯烃 羰基 >C=0 醛、酮 碳碳叁健 -C≡C 炔烃 氨基 -NH2 卤原子 -X 卤代烃 酯基 -C-OR 酯 0 羟基 -0H 醇、酚 酰基 酰基化合物 巯基 -SH 硫醇、硫酚 氰基 -CN 硝基 -NO 硝基化合物
环戊烷 甲基环丙烷 薄荷醇 CH3 CH3 CH(CH3 )2 OH (2)芳香族化合物:大多含有苯环结构,而且具有特殊性质的化合物。如: CH3 苯 萘 甲苯 3.杂环化合物 这类化合物分子中的环是由碳原子和氧、氮、硫等原子 连接而成的。如: C O CH3 OC2H5 + C2H5 + OH NaOC2H5 C O CH2 OC2H5 H 1 C O CH3 C O CH2 OC2H5 H + 2 吡咯 呋喃 噻吩 二、按官能团分类 有机化合物分子中最容易发生化学反应的原子或原子团(基团)称为官能团。 含有相同官能团的有机化合物,其主要化学性质相似。常见的官能团及化合物 类别见表 1-6。 表 1-6 常见的官能团及化合物的类别 官能团 化合物类别 官能团 化合物类别 碳碳双键 C C 烯 烃 羰基 C O 醛、酮 碳碳叁键 -C≡C- 炔 烃 氨基 -NH2 胺 卤原子 -X 卤代烃 O O 酯基 C R 酯 羟基 -OH 醇、酚 O 酰基 C R 酰基化合物 巯基 -SH 硫醇、硫酚 氰基 -CN 腈 醚键 C O C 醚 硝基 -NO2 硝基化合物 O S