
第四章芳香烃 知识要点 1.莱及其同系物的定义、结构、命名和理化性质。 2苯环亲电取代反应的定位规律及其应用。 3.稠环芳春烃的命名和理化性质:休克尔H口ck©)规则。 芳香烃简称芳烃,是芳香族化合物的母体,通常用A-H表示。芳香族化合 物原来是指从天然植物树脂和香精油中提取得到的一些具有芳香气味的化合物, 后来发现它们大多含有苯环结构,因而将含苯环结构的化合物称为芳香族化合 物。进一步研究发现许多含苯环结构的化合物不仅无香味,有的甚至还具有令人 不愉快的气味。因此,沿用至今的“芳香”一词已失去其原来的含义。现在的芳 香烃是指具有特殊稳定性的环状结构,难以发生加成和氧化反应,而易发生取代 反应的一类有机化合物。 根据分子中是否含有苯环,芳香烃分为苯系芳香烃和非苯芳香烃。 苯系芳香烃中根据所含苯环的数目和连接方式,又分为单环芳香烃、多环芳 香烃和稠环芳香烃。单环芳香烃是指分子中只含一个苯环的芳香烃。主要包括苯 和苯的同系物。 C) ○-cH,C〉c,cH 苯 甲苯 乙苯 多环芳香烃是分子中含有两个或两个以上独立苯环的芳香烃。如: O-cC〉 联苯 二苯甲烷 稠环芳香烃是分子中两个或两个以上的苯环彼此间通过共用两个相邻碳原 子结合而成的芳香烃。如 ◇ 第一节苯及其同系物
第四章 芳香烃 知识要点 1. 苯及其同系物的定义、结构、命名和理化性质。 2. 苯环亲电取代反应的定位规律及其应用。 3. 稠环芳香烃的命名和理化性质;休克尔(Hückel)规则。 芳香烃简称芳烃,是芳香族化合物的母体,通常用 Ar-H 表示。芳香族化合 物原来是指从天然植物树脂和香精油中提取得到的一些具有芳香气味的化合物, 后来发现它们大多含有苯环结构,因而将含苯环结构的化合物称为芳香族化合 物。进一步研究发现许多含苯环结构的化合物不仅无香味,有的甚至还具有令人 不愉快的气味。因此,沿用至今的“芳香”一词已失去其原来的含义。现在的芳 香烃是指具有特殊稳定性的环状结构,难以发生加成和氧化反应,而易发生取代 反应的一类有机化合物。 根据分子中是否含有苯环,芳香烃分为苯系芳香烃和非苯芳香烃。 苯系芳香烃中根据所含苯环的数目和连接方式,又分为单环芳香烃、多环芳 香烃和稠环芳香烃。单环芳香烃是指分子中只含一个苯环的芳香烃。主要包括苯 和苯的同系物。 如: CH3 CH2CH3 苯 甲苯 乙苯 多环芳香烃是分子中含有两个或两个以上独立苯环的芳香烃。如: CH2 联苯 二苯甲烷 1 ‘ 1 3 2 4 5 6 2’ 3‘ 4’ 6’ 5‘ 稠环芳香烃是分子中两个或两个以上的苯环彼此间通过共用两个相邻碳原 子结合而成的芳香烃。如: 萘 蒽 菲 第一节 苯及其同系物

一、苯的结构 苯是最简单的芳香烃,经元素分析及相对分子量测定,确定苯的分子式为 CH6。从苯分子中碳与氢的比例1:1来看,苯应该是一个高度不饱和的化合物, 但实际上苯很稳定,难以进行加成反应,不易被氧化,不使高锰酸钾溶液褪色 而容易发生取代反应。苯的一元取代物只有一种,说明苯分子中的6个氢原子是 完全等同的。1865年德国化学家凯库勒(A.K©kulé)提出苯具有环状结构。苯分 子中6个C组成六元环,碳原子之间以间隔的单双键相连,每个碳原子连接】 个氢原子。 苯的凯库勒结构式可以解释苯的一元取代物只有1种,苯经催化加氢可以得 到环己烷等一些客观事实,但却不能解释为什么苯有3个双键却不易发生加成反 应,为什么苯的邻位二元取代物只有1种。 现代物理学方法研究表明,苯分子的6个碳原子和6个氢原子在同一平面, 6个碳原子组成一个正六边形,键角均为120°,碳碳键长都是139pm。见图 4-1。 图4-1 图4-1苯环的共轭大π键及电子云分布示意图 杂化轨道理论认为苯分子中的碳原子都是sp杂化,每个碳原子都以sp杂化 轨道形成2个C-Cc键和1个C-HG键,构成1个平面。每个碳原子还有1个 未杂化的p轨道,均垂直于环平面而相互平行。每个P轨道都可以与两个相邻碳 原子的p轨道侧面重叠,6个p轨道之间相互重叠的程度完全相同,形成了包含 6个碳原子的环状闭合π-π共轭体系,称为大π键。π电子云位于碳环平面的上 方和下方,电子云密度均匀,环上没有单键和双键之别。见图4-1。苯的结构仍 然用凯库勒结构式表示,还常用圆圈代表大π键,用○表示苯分子。 苯环结构的共轭体系中,π电子不局限于两个碳原子之间,而为多个原子共 享的离域现象,使体系内能降低,苯的结构稳定。苯环的闭合共轭体系难以破坏
一、苯的结构 苯是最简单的芳香烃,经元素分析及相对分子量测定,确定苯的分子式为 C6H6 。从苯分子中碳与氢的比例 1∶1 来看,苯应该是一个高度不饱和的化合物, 但实际上苯很稳定,难以进行加成反应,不易被氧化,不使高锰酸钾溶液褪色, 而容易发生取代反应。苯的一元取代物只有一种,说明苯分子中的 6 个氢原子是 完全等同的。1865 年德国化学家凯库勒(A.Kekulé)提出苯具有环状结构。苯分 子中 6 个 C 组成六元环,碳原子之间以间隔的单双键相连,每个碳原子连接 1 个氢原子。 C C C C C C H H H H H H 或 苯的凯库勒结构式可以解释苯的一元取代物只有 1 种,苯经催化加氢可以得 到环己烷等一些客观事实,但却不能解释为什么苯有 3 个双键却不易发生加成反 应,为什么苯的邻位二元取代物只有 1 种。 现代物理学方法研究表明,苯分子的 6 个碳原子和 6 个氢原子在同一平面, 6 个碳原子组成一个正六边形,键角均为 120°,碳碳键长都是 139 pm。见图 4-1。 图 4-1 苯环的共轭大 π 键及电子云分布示意图 杂化轨道理论认为苯分子中的碳原子都是 sp²杂化,每个碳原子都以 sp²杂化 轨道形成 2 个 C-C σ 键和 1 个 C-H σ 键,构成 1 个平面。每个碳原子还有 1 个 未杂化的 p 轨道,均垂直于环平面而相互平行。每个 p 轨道都可以与两个相邻碳 原子的 p 轨道侧面重叠,6 个 p 轨道之间相互重叠的程度完全相同,形成了包含 6 个碳原子的环状闭合 π-π 共轭体系,称为大 π 键。π 电子云位于碳环平面的上 方和下方,电子云密度均匀,环上没有单键和双键之别。见图 4-1。苯的结构仍 然用凯库勒结构式表示,还常用圆圈代表大 π 键,用 表示苯分子。 苯环结构的共轭体系中,π 电子不局限于两个碳原子之间,而为多个原子共 享的离域现象,使体系内能降低,苯的结构稳定。苯环的闭合共轭体系难以破坏, 图 4-1
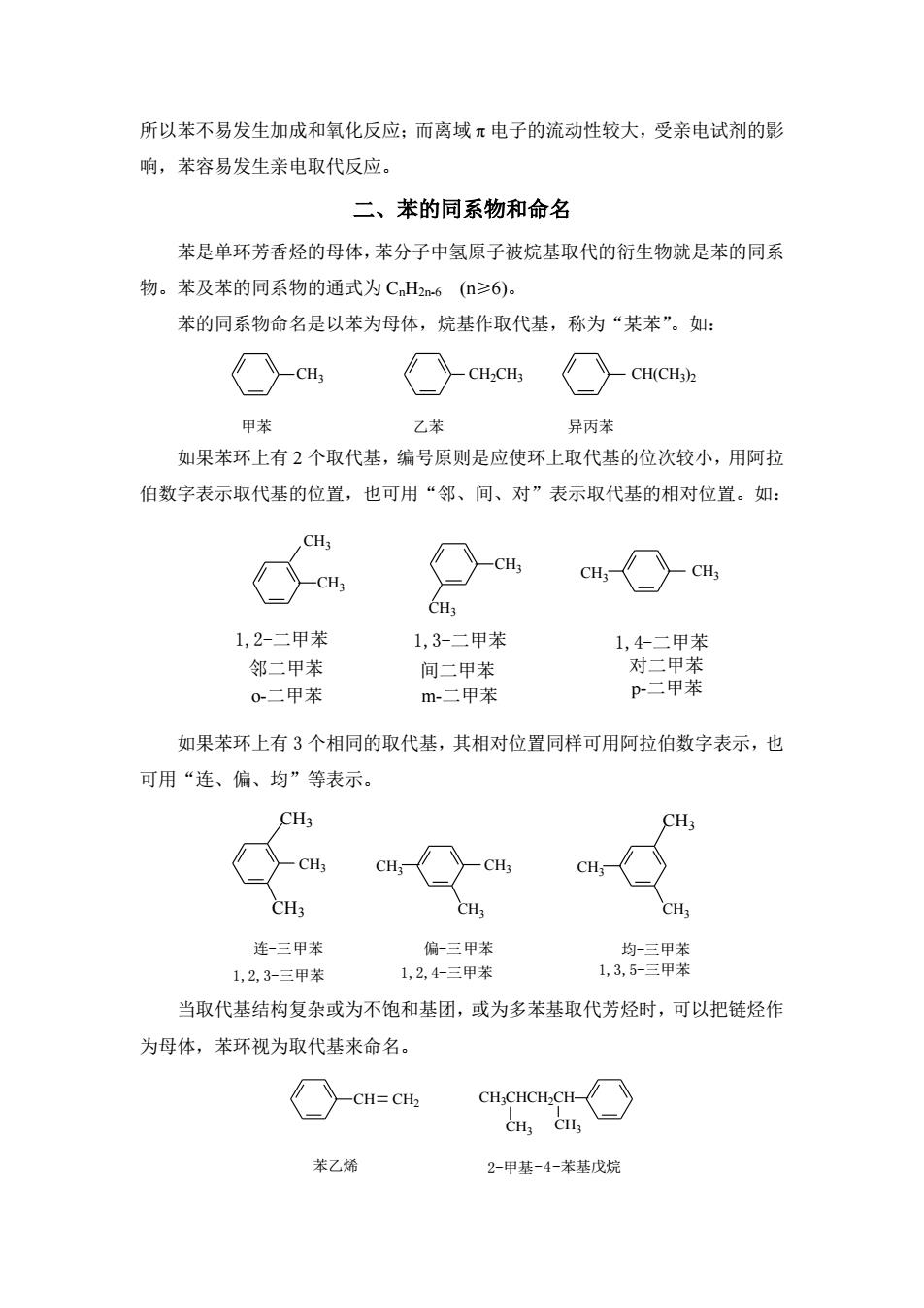
所以苯不易发生加成和氧化反应:而离域π电子的流动性较大,受亲电试剂的影 响,苯容易发生亲电取代反应。 二、苯的同系物和命名 苯是单环芳香烃的母体,苯分子中氢原子被烷基取代的衍生物就是苯的同系 物。苯及苯的同系物的通式为CH2n6(≥6)。 苯的同系物命名是以苯为母体,烷基作取代基,称为“某苯”。如: CH, -,), 甲 乙苯 异丙苯 如果苯环上有2个取代基,编号原则是应使环上取代基的位次较小,用阿拉 伯数字表示取代基的位置,也可用“邻、间、对”表示取代基的相对位置。如: CH, 1,2-二甲苯 1,3-二甲苯 1,4二甲茶 邻二甲苯 间二甲苯 对二甲苯 0-二甲苯 m二甲苯 p二甲苯 如果苯环上有3个相同的取代基,其相对位置同样可用阿拉伯数字表示,也 可用“连、偏、均”等表示。 CH3 CH, 〉CH cH-〉cH, CH3 CH3 CH 连-三甲苯 偏三甲苯 1,2,3-三甲苯 1,2,4三甲苯 当取代基结构复杂或为不饱和基团,或为多苯基取代芳烃时,可以把链烃作 为母体,苯环视为取代基来命名。 《〉-cH=cH CHCHCH.CH-〉 CHa CH3 苯乙烯 2-甲基-4-苯基戊烷
所以苯不易发生加成和氧化反应;而离域 π 电子的流动性较大,受亲电试剂的影 响,苯容易发生亲电取代反应。 二、苯的同系物和命名 苯是单环芳香烃的母体,苯分子中氢原子被烷基取代的衍生物就是苯的同系 物。苯及苯的同系物的通式为 CnH2n-6 (n≥6)。 苯的同系物命名是以苯为母体,烷基作取代基,称为“某苯”。如: CH(CH3 ) CH3 CH2CH3 2 甲苯 乙苯 异丙苯 如果苯环上有 2 个取代基,编号原则是应使环上取代基的位次较小,用阿拉 伯数字表示取代基的位置,也可用“邻、间、对”表示取代基的相对位置。如: 1,2-二甲苯 1,3-二甲苯 1,4-二甲苯 CH3 CH3 CH3 CH3 CH3 CH3 邻二甲苯 间二甲苯 对二甲苯 o-二甲苯 m-二甲苯 p-二甲苯 如果苯环上有 3 个相同的取代基,其相对位置同样可用阿拉伯数字表示,也 可用“连、偏、均”等表示。 连-三甲苯 偏-三甲苯 均-三甲苯 1,2,3-三甲苯 1,2,4-三甲苯 1,3,5-三甲苯 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 当取代基结构复杂或为不饱和基团,或为多苯基取代芳烃时,可以把链烃作 为母体,苯环视为取代基来命名。 CH CH2 CH3 CH3 CH3CHCH2CH 苯乙烯 2-甲基-4-苯基戊烷
芳烃分子中去掉1个H后剩下的基团称为芳香烃基或芳基,常用“Ar-”表 示。常见的芳基有:苯基CHs-(phenyl),可用“ph-”表示:苯甲基或称苄基 C6H-CH-。 -CH 苯基 苯甲基或苄基 邻甲苯基 三、苯及其同系物的物理性质 苯及其同系物一般为具有特殊气味的液体,不溶于水,是许多有机物的良好 溶剂。苯及其同系物的蒸气有毒,对中枢神经和造血器官有损害,长期接触会导 致白细胞减少和头晕乏力等,使用时需注意采取防护措施。 苯及同系物密度都小于1,但比链烃、脂环烃高。沸点随分子中碳原子数的 增加而升高,同碳原子数的各种异构体沸点相差不大。熔点的变化与结构的对称 性有关,对称性较好的分子熔点较高。苯及同系物的物理常数见表4-1。 表41苯及其同系物的物理常数 化合物 熔点(℃) 沸点(℃) 密度(gcm) 5.3 80.1 0.8765 甲苯 -95 110.6 0.8669 邻二甲苯 -25 144.4 0.8802 间二甲苯 -48 1391 0.8642 对二甲苯 13 138.4 0.8610 -93 136.2 0.8667 丙苯 -99 159.2 0.8620 异丙苯 -96 152.4 0.8617 四、苯及其同系物的化学性质 苯环的特殊结构使苯的化学性质与不饱和烃有显著不同,具有芳香性。即较 难发生加成反应和氧化反应,而一定条件下容易发生取代反应。 (一)亲电取代反应 苯环富有π电子,易受亲电试剂的进攻,反应中苯环上的氢原子易被一X、 一NO2、一SO,H等原子或原子团所取代,发生亲电取代反应。 1.卤代反应在铁粉或三卤化铁的催化下,苯与卤素作用生成卤代苯。由于 氟代反应太剧烈不易控制,而碘不活泼难以反应,所以苯的卤代反应通常是氯代
芳烃分子中去掉 1 个 H 后剩下的基团称为芳香烃基或芳基,常用“Ar-”表 示。常见的芳基有:苯基 C6H5-(phenyl),可用“Ph-”表示;苯甲基或称苄基 C6H5-CH2-。 苯基 CH3 CH2 苯甲基或苄基 邻甲苯基 三、苯及其同系物的物理性质 苯及其同系物一般为具有特殊气味的液体,不溶于水,是许多有机物的良好 溶剂。苯及其同系物的蒸气有毒,对中枢神经和造血器官有损害,长期接触会导 致白细胞减少和头晕乏力等,使用时需注意采取防护措施。 苯及同系物密度都小于 1,但比链烃、脂环烃高。沸点随分子中碳原子数的 增加而升高,同碳原子数的各种异构体沸点相差不大。熔点的变化与结构的对称 性有关,对称性较好的分子熔点较高。苯及同系物的物理常数见表 4-1。 表 4-1 苯及其同系物的物理常数 化合物 熔点(℃) 沸点(℃) 密度(g∙cm -3 ) 苯 5.3 80.1 0.8765 甲苯 - 95 110.6 0.8669 邻二甲苯 - 25 144.4 0.8802 间二甲苯 - 48 139.1 0.8642 对二甲苯 13 138.4 0.8610 乙苯 - 93 136.2 0.8667 丙苯 - 99 159.2 0.8620 异丙苯 - 96 152.4 0.8617 四、苯及其同系物的化学性质 苯环的特殊结构使苯的化学性质与不饱和烃有显著不同,具有芳香性。即较 难发生加成反应和氧化反应,而一定条件下容易发生取代反应。 (一)亲电取代反应 苯环富有π电子,易受亲电试剂的进攻,反应中苯环上的氢原子易被-X、 -NO2、-SO3H 等原子或原子团所取代,发生亲电取代反应。 1.卤代反应 在铁粉或三卤化铁的催化下,苯与卤素作用生成卤代苯。由于 氟代反应太剧烈不易控制,而碘不活泼难以反应,所以苯的卤代反应通常是氯代
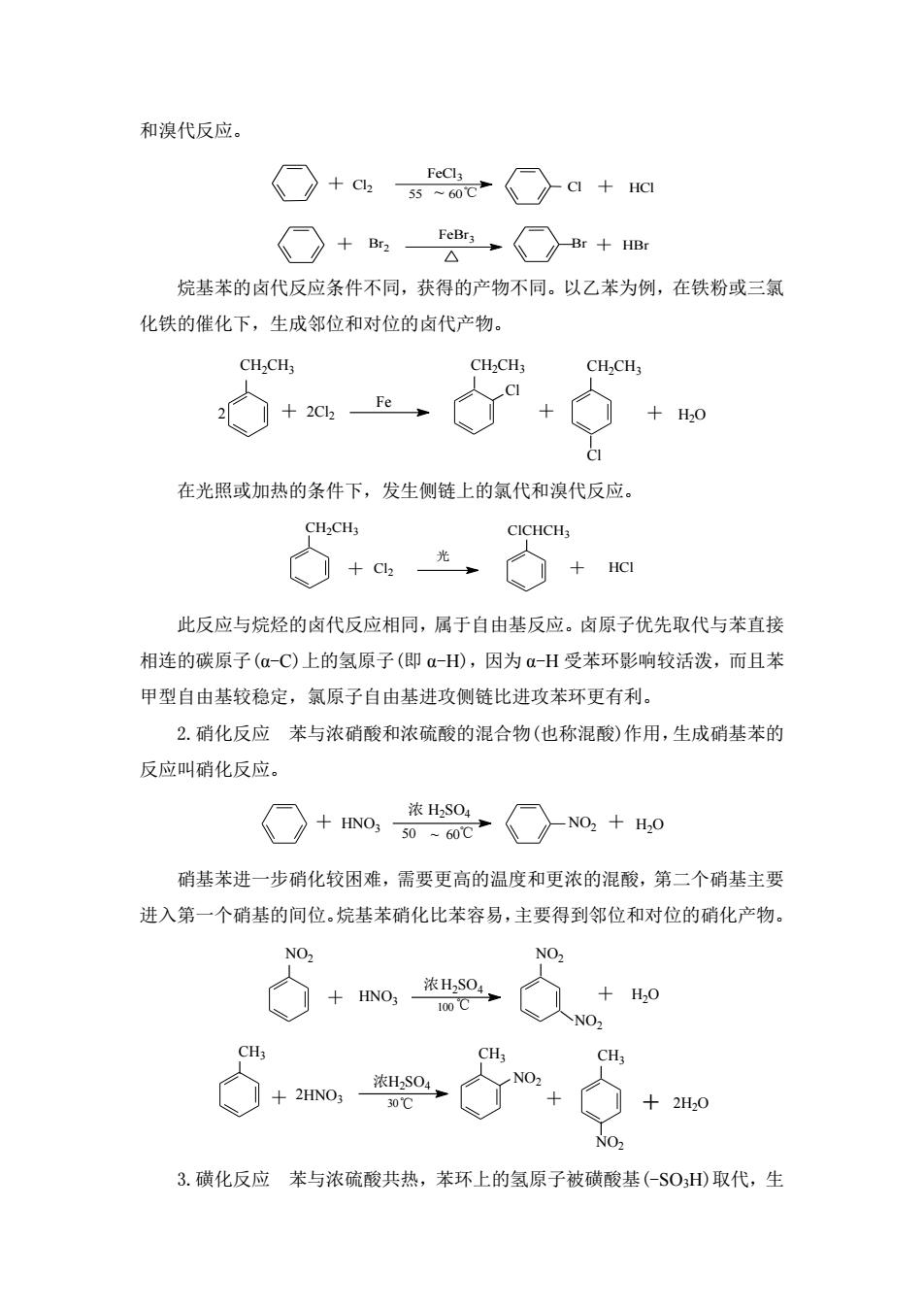
和溴代反应。 ○+a4ae○a+a ○+,O+m 烷基苯的卤代反应条件不同,获得的产物不同。以乙苯为例,在铁粉或三氯 化铁的催化下,生成邻位和对位的卤代产物。 CH2CHs CH2CH3 CH2CH3 2◇+2e→ CI +H0 在光照或加热的条件下,发生侧链上的氯代和溴代反应。 CICHCH ◇+、◇+ 此反应与烷烃的卤代反应相同,属于自由基反应。卤原子优先取代与苯直接 相连的碳原子(αC)上的氢原子(即α-HD),因为a-H受苯环影响较活泼,而且苯 甲型自由基较稳定,氯原子自由基进攻侧链比进攻苯环更有利。 2.硝化反应苯与浓硝酸和浓硫酸的混合物(也称混酸)作用,生成硝基苯的 反应叫硝化反应。 ○+o,t2○o,+o 硝基苯进一步硝化较困难,需要更高的温度和更浓的混酸,第二个硝基主要 进入第一个硝基的间位.烷基苯硝化比苯容易,主要得到邻位和对位的硝化产物。 NO NO +H0 NO, CH 3.磺化反应苯与浓硫酸共热,苯环上的氢原子被磺酸基(-$0H)取代,生
和溴代反应。 Cl2 FeCl3 Cl HCl 55 ~ 60 + ℃ + Br2 FeBr3 + Br + HBr 烷基苯的卤代反应条件不同,获得的产物不同。以乙苯为例,在铁粉或三氯 化铁的催化下,生成邻位和对位的卤代产物。 Cl2 Fe Cl CH2CH3 CH2CH3 Cl CH2CH3 2 + 2 + + H2O 在光照或加热的条件下,发生侧链上的氯代和溴代反应。 Cl2 HCl CH2CH3 ClCHCH3 光 + + 此反应与烷烃的卤代反应相同,属于自由基反应。卤原子优先取代与苯直接 相连的碳原子(α-C)上的氢原子(即 α-H),因为 α-H 受苯环影响较活泼,而且苯 甲型自由基较稳定,氯原子自由基进攻侧链比进攻苯环更有利。 2.硝化反应 苯与浓硝酸和浓硫酸的混合物(也称混酸)作用,生成硝基苯的 反应叫硝化反应。 50 ~ 60 HNO3 浓 H2SO4 + + H2O ℃ NO2 硝基苯进一步硝化较困难,需要更高的温度和更浓的混酸,第二个硝基主要 进入第一个硝基的间位。烷基苯硝化比苯容易,主要得到邻位和对位的硝化产物。 HNO3 H2SO4 NO2 NO2 浓 NO2 + 100℃ + H2O 浓 ℃ CH3 HNO3 H2SO4 NO2 NO2 30 CH3 CH3 + 2 + + 2H2O 3.磺化反应 苯与浓硫酸共热,苯环上的氢原子被磺酸基(-SO3H)取代,生

成苯磺酸。苯磺酸同样条件下可以水解,所以磺化反应是一个可逆反应。 {○+Hs0:so{○〉so,H+0 4.傅-克(Friedel-Crafts)反应苯环上引入烷基或酰基的反应称为傅-克烷 基化反应和傅-克酰基化反应。反应是法国的傅瑞德尔(C.Friedel)和美国的克拉 弗茨O.M.Crafts)两位化学家发现的,简称傅-克反应。 在无水三氯化铝催化下,苯与卤代烷作用生成烷基苯的反应是烷基化反应。 {○+cHaa无水a〈○c,aH+Ha 提供烷基的试剂称为烷基化试剂。常用的烷基化试剂除了卤代烷外,还有醇、 烯烃等。烷基化试剂含3个或3个以上碳原子时,反应中烷基容易异构化,产物 不止1种。如: CH2CH-CHs CHCHCHs +2cH,CcH,a无水AC ○+◇+0 正丙苯引%~5%异丙苯66%H% 在无水三氯化铝催化下,苯与酰卤或酸酐等作用生成酮的反应是酰基化反 应 ○+R8-a0,C8-+阳 5.苯环上亲电取代反应机制苯的取代反应都是亲电取代反应。亲电试剂 E进攻富有π电子的苯环,产生碳正离子中间体。碳正离子中间体不稳定,很 容易失去1个质子,生成取代产物。 O+E总国X也O+r 如:在苯的氯代反应中,第一步,氯与三氯化铁作用,形成亲电试剂氯正离 子。 C2+FcCl3=C+(FeC4厂 第二步,氯正离子进攻苯环,生成碳正离子中间体。 O+。国X
成苯磺酸。苯磺酸同样条件下可以水解,所以磺化反应是一个可逆反应。 H2SO4 H2O SO3 + SO3H + 4.傅-克(Friedel-Crafts)反应 苯环上引入烷基或酰基的反应称为傅-克烷 基化反应和傅-克酰基化反应。反应是法国的傅瑞德尔(C.Friedel)和美国的克拉 弗茨(J.M.Crafts)两位化学家发现的,简称傅-克反应。 在无水三氯化铝催化下,苯与卤代烷作用生成烷基苯的反应是烷基化反应。 CH3CH2Cl AlCl3 CH2CH3 HCl + 无水 + 提供烷基的试剂称为烷基化试剂。常用的烷基化试剂除了卤代烷外,还有醇、 烯烃等。烷基化试剂含 3 个或 3 个以上碳原子时,反应中烷基容易异构化,产物 不止 1 种。如: AlCl CH 无水 3 3CH2CH2Cl CH2CH2CH3 CH3CHCH3 正丙苯31% 35% 异丙苯 65% 69% ~ H + 2 + + 2HCl 在无水三氯化铝催化下,苯与酰卤或酸酐等作用生成酮的反应是酰基化反 应。 AlCl 无水 3 R-C-C HCl l O -C-R O + + 5.苯环上亲电取代反应机制 苯的取代反应都是亲电取代反应。亲电试剂 E + 进攻富有 π 电子的苯环,产生碳正离子中间体。碳正离子中间体不稳定,很 容易失去 1 个质子,生成取代产物。 + H E + E+ 慢 快 E + H+ 如:在苯的氯代反应中,第一步,氯与三氯化铁作用,形成亲电试剂氯正离 子。 Cl2 + FeCl3 Cl + +〔 FeCl4 〕 - 第二步,氯正离子进攻苯环,生成碳正离子中间体。 + H 慢 + Cl + Cl

第三步,碳正离子中间体失去1个H,生成氯苯 国X.O+” 硝化反应中,浓硫酸的作用是使硝酸变为亲电试剂硝酰正离子:磺化反应中 亲电试剂是缺电子的中性分子SO3,S带部分正电荷:傅-克反应中,亲电试剂 是烃基正离子。亲电试剂的形成如下: HNO3 H2SO4 三NO2+HSO4+HO 2H2S04、=SO3+HS04+H3O RCI AICls R+AICl 烷基化反应中产生烷基异构是因为碳正离子的稳定性不同(3℃>2℃>1℃), 碳正离子会自动重排,形成更稳定的碳正离子。如正丙基碳正离子(1)发生重 排,形成异丙基碳正离子(2):异丁基碳正离子(1)重排,形成叔丁基碳正离子 (39. CHCH,CH→CHCH CH,CHCH2→CH CH (二)加成反应 苯及其同系物的性质稳定,不易发生加成反应。在特殊条件下,也可以加氢、 加氯,并且一般是3个双键同时发生反应。 +3hw○ Ni + (三)氧化反应 苯环较稳定,一般不会被氧化。但烷基苯的侧链只要有-H就容易被氧化, 而且不论侧链多长,氧化的结果都是侧链被氧化为羧基。 ☐aa4aao代〈○〉cooH
第三步,碳正离子中间体失去 1 个 H +,生成氯苯。 + 快 C + H+ l H Cl 硝化反应中,浓硫酸的作用是使硝酸变为亲电试剂硝酰正离子;磺化反应中, 亲电试剂是缺电子的中性分子 SO3,S 带部分正电荷;傅-克反应中,亲电试剂 是烃基正离子。亲电试剂的形成如下: - HNO3 + H2SO4 NO2 + + HSO4 + H2O - H2 HSO4 SO4 SO3 H3O + + 2 + RCl + AlCl3 R + + AlCl4 烷基化反应中产生烷基异构是因为碳正离子的稳定性不同(3 o C +>2 o C +>1 o C +), 碳正离子会自动重排,形成更稳定的碳正离子。如正丙基碳正离子(1 o)发生重 排,形成异丙基碳正离子(2o );异丁基碳正离子(1o )重排,形成叔丁基碳正离子 (3o )。 CH3CHCH2 + CH3C+ CH3 CH3 CH3 CH3CH2CH2 + CH3CH+ CH3 (二)加成反应 苯及其同系物的性质稳定,不易发生加成反应。在特殊条件下,也可以加氢、 加氯,并且一般是 3 个双键同时发生反应。 H2 Ni + 3 200℃,加压 + 3 Cl2 日光 50æ Cl Cl Cl Cl Cl Cl (三)氧化反应 苯环较稳定,一般不会被氧化。但烷基苯的侧链只要有 α-H 就容易被氧化, 而且不论侧链多长,氧化的结果都是侧链被氧化为羧基。 COOH KMnO4 / H+ CH2CH3

COOH KMnO/H' CH(CH)2 COOH 若苯环侧链上不含Q一H,一般不能被氧化。 烷基苯的侧链氧化反应,多用于合成苯甲酸或鉴别烷基苯。当用酸性高锰酸 钾做氧化剂时,随着苯环的侧链氧化反应的发生,高锰酸钾的颜色逐渐褪去,这 可作为苯环上有无含有α-H的侧链的鉴别反应。 课堂互动 用化学方法鉴别下列化合物: 0◇②◇,◇4 五、苯环亲电取代反应的定位规律 (一)定位规律 根据苯的结构,当苯发生亲电取代反应时,其一元取代物只有一种。但一元 取代苯再继续进行取代时,取代基的位置就有三种可能,即第一个取代基的邻位、 间位和对位。苯环上的取代基会影响苯环亲电取代反应的活性,并且对第二个取 代基进入苯环的位置具有支配作用。我们将苯环上原有的取代基称为定位基。 1.邻、对位定位基邻、对位定位基一般使新引入的取代基主要进入其邻位 和对位。该类定位基中与苯环相连的原子不含重键,且多数有未共用电子对。属 于这类定位基的主要有: -NR2、-NH、OH、-OR、-NHCOR、-OCOR、-R、-Ar、-X 2.间位定位基间位定位基一般使新引入的取代基主要进入其间位。该类定 位基中与苯环相连的原子一般含有重键或带正电荷。属于这类定位基的主要有: -NR3、-NO2、CN、-SOH、-CHO、-COOH 邻、对位定位基(除卤素外)一般使苯环活化,即使苯环的亲电取代反应变得 比苯容易。如甲苯的氯代比苯更容易,主要生成邻-氯甲苯和对-氯甲苯。间位定 位基可使苯环钝化,使苯环发生亲电取代反应变得比苯困难。如硝基苯继续硝化 要求更高的反应条件,主要生成间-二硝基苯。 (二)定位规律的解释
COOH KMnO4 / H+ CH(CH3 )2 CH3 COOH 若苯环侧链上不含 α-H,一般不能被氧化。 烷基苯的侧链氧化反应,多用于合成苯甲酸或鉴别烷基苯。当用酸性高锰酸 钾做氧化剂时,随着苯环的侧链氧化反应的发生,高锰酸钾的颜色逐渐褪去,这 可作为苯环上有无含有 α-H 的侧链的鉴别反应。 课堂互动 用化学方法鉴别下列化合物: (1) CH3 CH3 (2) (3) 五、苯环亲电取代反应的定位规律 (一)定位规律 根据苯的结构,当苯发生亲电取代反应时,其一元取代物只有一种。但一元 取代苯再继续进行取代时,取代基的位置就有三种可能,即第一个取代基的邻位、 间位和对位。苯环上的取代基会影响苯环亲电取代反应的活性,并且对第二个取 代基进入苯环的位置具有支配作用。我们将苯环上原有的取代基称为定位基。 1.邻、对位定位基 邻、对位定位基一般使新引入的取代基主要进入其邻位 和对位。该类定位基中与苯环相连的原子不含重键,且多数有未共用电子对。属 于这类定位基的主要有: -NR2、-NH2、-OH、-OR、-NHCOR、-OCOR、-R、-Ar、-X 2.间位定位基 间位定位基一般使新引入的取代基主要进入其间位。该类定 位基中与苯环相连的原子一般含有重键或带正电荷。属于这类定位基的主要有: -N +R3、-NO2、-CN、-SO3H、-CHO、-COOH 邻、对位定位基(除卤素外)一般使苯环活化,即使苯环的亲电取代反应变得 比苯容易。如甲苯的氯代比苯更容易,主要生成邻-氯甲苯和对-氯甲苯。间位定 位基可使苯环钝化,使苯环发生亲电取代反应变得比苯困难。如硝基苯继续硝化 要求更高的反应条件,主要生成间-二硝基苯。 (二)定位规律的解释

定位规律是电子效应(诱导效应和共轭效应)影响的结果。苯环是1个电子云 分布均匀的闭合共轭体系。当苯环上有1个取代基时,苯环上电子云密度分布发 生改变。取代基通过诱导效应和共轭效应,可使苯环的电子云密度增大或降低, 而且还会使环上出现电子云密度大小交替的现象,导致环上各个位置的取代难易 程度不同。 1.邻、对位定位基的影响这类定位基一般有供电子效应,能使苯环电子云 密度增大(除卤素外),尤其是邻位和对位的电子云密度增加更显著,更有利于亲 电反应发生。 在甲苯中,甲基是供电子基,有供电子诱导效应,而且甲基的C-Hσ轨道与 苯环的大π键存在部分重叠,形成了。超共轭效应。甲基的诱导效应和超共轭效 应方向一致,都使苯环上的电子云密度增大,使甲苯比苯更容易发生亲电取代反 应。而且电子效应沿共轭体系传递,使甲基邻位和对位的电子云密度增大更多, 所以主要生成邻、对位取代的产物。 当苯环上连有-OH、O、-NH等取代基时,由于氧、氮等原子电负性较 大,有吸电子诱导效应,使苯环上电子云密度减小:但同时氧、氮等原子的轨 道上有未共用电子对与苯环形成供电子的p共轭效应。由于共轭效应大于诱导 效应,结果是苯环上的电子云密度增大,而且邻位和对位上电子云密度增加更多, 所以苯环上发生亲电取代反应的活性增大,取代作用主要发生在邻位和对位。 卤原子对苯环的影响也是两种电子效应综合的结果。卤素原子电负性较大, 具有较强的吸电子诱导效应,因此卤代苯会使苯环上的电子云密度减小,苯环上 发生亲电取代反应的活性减小。而卤素原子轨道上的未共用电子对也会与苯环 形成pπ共轭,而共轭效应又会使其邻位和对位的电子云密度减小不多。所以卤 素产生邻、对位的定位效应。 H-C-H 2.间位定位基的影响以硝基苯为例。硝基有吸电子诱导效应,同时硝基中 氮氧π键与苯环的大π形成π-π共轭效应,因氧和氮的电负性都比碳大,使共轭体 系的电子云移向硝基。诱导效应和共轭效应方向一致,均使苯环上的电子云密度
定位规律是电子效应(诱导效应和共轭效应)影响的结果。苯环是1个电子云 分布均匀的闭合共轭体系。当苯环上有1个取代基时,苯环上电子云密度分布发 生改变。取代基通过诱导效应和共轭效应,可使苯环的电子云密度增大或降低, 而且还会使环上出现电子云密度大小交替的现象,导致环上各个位置的取代难易 程度不同。 1.邻、对位定位基的影响 这类定位基一般有供电子效应,能使苯环电子云 密度增大(除卤素外),尤其是邻位和对位的电子云密度增加更显著,更有利于亲 电反应发生。 在甲苯中,甲基是供电子基,有供电子诱导效应,而且甲基的C-H σ轨道与 苯环的大π键存在部分重叠,形成了σ-π超共轭效应。甲基的诱导效应和超共轭效 应方向一致,都使苯环上的电子云密度增大,使甲苯比苯更容易发生亲电取代反 应。而且电子效应沿共轭体系传递,使甲基邻位和对位的电子云密度增大更多, 所以主要生成邻、对位取代的产物。 当苯环上连有-OH、-OR、-NH2等取代基时,由于氧、氮等原子电负性较 大,有吸电子诱导效应,使苯环上电子云密度减小;但同时氧、氮等原子的p轨 道上有未共用电子对与苯环形成供电子的 p-π共轭效应。由于共轭效应大于诱导 效应,结果是苯环上的电子云密度增大,而且邻位和对位上电子云密度增加更多, 所以苯环上发生亲电取代反应的活性增大,取代作用主要发生在邻位和对位。 卤原子对苯环的影响也是两种电子效应综合的结果。卤素原子电负性较大, 具有较强的吸电子诱导效应,因此卤代苯会使苯环上的电子云密度减小,苯环上 发生亲电取代反应的活性减小。而卤素原子p轨道上的未共用电子对也会与苯环 形成p-π共轭,而共轭效应又会使其邻位和对位的电子云密度减小不多。所以卤 素产生邻、对位的定位效应。 H H C H X N O O 2.间位定位基的影响 以硝基苯为例。硝基有吸电子诱导效应,同时硝基中 氮氧π键与苯环的大π形成π-π共轭效应,因氧和氮的电负性都比碳大,使共轭体 系的电子云移向硝基。诱导效应和共轭效应方向一致,均使苯环上的电子云密度

降低,尤其是硝基的邻、对位电子云密度降低较多,所以硝基苯进行亲电取代反 应比苯难,且主要产物是间位取代物, (三)定位规律的应用 应用苯环上取代基的定位规律,可以合理设计合成路线,以及预测取代反应 的主要产物。例如,由苯制备邻硝基氯苯,因为-C1是邻、对位定位基,要先氯 代后硝化。而制备间硝基氯苯,则需要先硝化后氯代。 HNO3、HSO4 NO NO HNOHS04 二取代苯进行取代时,可应用定位效应推测导入基团的位置。两个基团定位 效应一致,取代基的作用具有加和性。两个基团定位效应不一致时,定位效应强 的起主导作用:活化基的作用超过钝化基。此外应用定位效应时还应考虑空间效 应。 0 空间效应 OH CH空效 CH. COOH 课堂互动 指出下列化合物硝化时导入硝基的位置: CI NO 3)】 NO 第二节稠环芳香烃
降低,尤其是硝基的邻、对位电子云密度降低较多,所以硝基苯进行亲电取代反 应比苯难,且主要产物是间位取代物。 (三)定位规律的应用 应用苯环上取代基的定位规律,可以合理设计合成路线,以及预测取代反应 的主要产物。例如,由苯制备邻硝基氯苯,因为-Cl是邻、对位定位基,要先氯 代后硝化。而制备间硝基氯苯,则需要先硝化后氯代。 Cl Cl NO2 Cl2 、Fe HNO3 、H2SO4 Cl NO2 Cl2 、FeCl HNO3 、H2SO4 3 NO2 二取代苯进行取代时,可应用定位效应推测导入基团的位置。两个基团定位 效应一致,取代基的作用具有加和性。两个基团定位效应不一致时,定位效应强 的起主导作用;活化基的作用超过钝化基。此外应用定位效应时还应考虑空间效 应。 OH CH3 CH3 COOH NO2 CH3 OH CH3 空间效应 空间效应 课堂互动 指出下列化合物硝化时导入硝基的位置: Cl OCH3 NO2 CH3 NO2 OH Cl CCl3 Cl (1) (2) (3) (4) (5) (6) 第二节 稠环芳香烃