
芳香烃 芳香烃简称芳烃,是芳香族化合物的母体,通常用-H表示。芳香族化合 物原来是指从天然植物树脂和香精油中提取得到的一些具有芳香气味的化合物, 后来发现它们大多含有苯环结构,因而将含苯环结构的化合物称为芳香族化合物。 苯系芳香烃中根据所含苯环的数目和连接方式,又分为单环芳香烃、多环芳 香烃和稠环芳香烃。单环芳香烃是分子中只含一个苯环的芳香烃,包括苯和苯的 同系物。 一、苯的结构 苯是最简单的芳香烃,经元素分析及相对分子量测定,确定苯的分子式为 CH。从苯分子中碳与氢的比例1:1来看,苯应该是一个高度不饱和的化合物, 但实际上苯很稳定,难以进行加成反应,不易被氧化,不使高锰酸钾褪色,而容 易发生取代反应。苯的一元取代物只有一种,说明苯分子中的6个氢原子是完全 等同的。1865年凯库勒(A.Kekuleé)提出苯具有环状结构。苯分子中6个C组成 六元环,碳原子之间以间隔的单双键相连,每个碳原子连接一个氢原子。 H H H 苯的凯库勒结构式可以解释苯的一元取代物只有一种,苯经催化加氢可以得 到环己烷等一些客观事实,但却不能解释为什么苯有3个双键却不易发生加成反 应,为什么苯的邻位二元取代物只有一种。 现代物理学方法研究表明,苯分子的6个碳原子和6个氢原子在同一平面, 6个碳原子组成一个正六边形,键角均为120°,C-C键长都是139pm。见下 图
芳香烃 芳香烃简称芳烃,是芳香族化合物的母体,通常用 Ar-H 表示。芳香族化合 物原来是指从天然植物树脂和香精油中提取得到的一些具有芳香气味的化合物, 后来发现它们大多含有苯环结构,因而将含苯环结构的化合物称为芳香族化合物。 苯系芳香烃中根据所含苯环的数目和连接方式,又分为单环芳香烃、多环芳 香烃和稠环芳香烃。单环芳香烃是分子中只含一个苯环的芳香烃,包括苯和苯的 同系物。 一、苯的结构 苯是最简单的芳香烃,经元素分析及相对分子量测定,确定苯的分子式为 C6H6 。从苯分子中碳与氢的比例 1∶1 来看,苯应该是一个高度不饱和的化合物, 但实际上苯很稳定,难以进行加成反应,不易被氧化,不使高锰酸钾褪色,而容 易发生取代反应。苯的一元取代物只有一种,说明苯分子中的 6 个氢原子是完全 等同的。1865 年凯库勒(A.Kekulé)提出苯具有环状结构。苯分子中 6 个 C 组成 六元环,碳原子之间以间隔的单双键相连,每个碳原子连接一个氢原子。 C C C C C C H H H H H H 或 苯的凯库勒结构式可以解释苯的一元取代物只有一种,苯经催化加氢可以得 到环己烷等一些客观事实,但却不能解释为什么苯有 3 个双键却不易发生加成反 应,为什么苯的邻位二元取代物只有一种。 现代物理学方法研究表明,苯分子的 6 个碳原子和 6 个氢原子在同一平面, 6 个碳原子组成一个正六边形,键角均为 120°,C-C 键长都是 139 pm。见下 图

图苯环的共邦大π健及电子云分布示意图 杂化轨道理论认为苯分子中的碳原子都是s即染化,每个碳原子都以sp杂化 轨道形成两个C-Cc键和一个C-HG键,构成一个平面。每个碳原子还有一个未 杂化的p轨道,均垂直于环平面而相互平行。每个p轨道都可以与两个相邻碳原 子的p轨道侧面重叠,6个p轨道之间相互重叠的程度完全相同,形成了包含6 个碳原子的环状闭合ππ共轭体系,称为大π键。苯的结构仍然用凯库勒结构式 表示,还常用圆圈代表大π键,用○表示苯分子 二、苯的同系物和命名 苯是单环芳香烃的母体,苯分子中氢原子被烃基取代的衍生物就是苯的同系 物。 苯的同系物命名是以苯为母体,烷基作取代基,称为“某苯”。如: C -cHcts cuct): 甲花 乙茶 异丙苯 如果苯环上有两个取代基,编号原则是应使环上取代基的位次较小,用阿拉 伯数字表示取代基的位置,也可用“邻、间、对”表示取代基的相对位置。如: 〉-c cn, CH 1,2-二甲苯 1.3-二甲苯 1,4二甲苯 邻-二甲苯 间装 对-二甲苯 0-二甲举 p二甲苯 如果苯环上有3个相同的取代基,其相对位置同样可用阿拉伯数字表示,也 可用“连、偏、均”等表示
图 苯环的共轭大 π 键及电子云分布示意图 杂化轨道理论认为苯分子中的碳原子都是 sp²杂化,每个碳原子都以 sp²杂化 轨道形成两个 C-Cσ 键和一个 C-Hσ 键,构成一个平面。每个碳原子还有一个未 杂化的 p 轨道,均垂直于环平面而相互平行。每个 p 轨道都可以与两个相邻碳原 子的 p 轨道侧面重叠,6 个 p 轨道之间相互重叠的程度完全相同,形成了包含 6 个碳原子的环状闭合 π-π 共轭体系,称为大 π 键。苯的结构仍然用凯库勒结构式 表示,还常用圆圈代表大 π 键,用 表示苯分子。 二、苯的同系物和命名 苯是单环芳香烃的母体,苯分子中氢原子被烃基取代的衍生物就是苯的同系 物。 苯的同系物命名是以苯为母体,烷基作取代基,称为“某苯”。如: CH(CH3 ) CH3 CH2CH3 2 甲苯 乙苯 异丙苯 如果苯环上有两个取代基,编号原则是应使环上取代基的位次较小,用阿拉 伯数字表示取代基的位置,也可用“邻、间、对”表示取代基的相对位置。如: 1,2-二甲苯 1,3-二甲苯 1,4-二甲苯 CH3 CH3 CH3 CH3 CH3 CH3 邻-二甲苯 间-二甲苯 对-二甲苯 o-二甲苯 m-二甲苯 p-二甲苯 如果苯环上有 3 个相同的取代基,其相对位置同样可用阿拉伯数字表示,也 可用“连、偏、均”等表示

CH3 一CH3 CH: CH CH. 连-三甲苯 偏三甲苯 1,2,3-三甲苯 1,2,4-三甲苯 芳烃分子中去掉一个H后剩下的基团称为芳香烃基或芳基,常用“Ar~”表 示。常见的芳基有:苯基C6Hs-(phenyl),可用“Ph-”表示:苯甲基或称苄基 C6HCH-。 Q CH: cn, 苯基 苯甲基或苄基 邻甲苯基 三、苯及其同系物的物理性质 苯及其同系物一般为具有特殊气味的液体,不溶于水,是许多有机物的良好 溶剂。苯及其同系物的蒸气有毒,对中枢神经和造血器官有损害,长期接触会导 致白细胞减少和头晕乏力等,使用时需注意采取防护措施。 苯及同系物密度都小于1,但比链烃、脂环烃高 四、苯及其同系物的化学性质 苯环的特殊结构使苯的化学性质与不饱和烃有显著不同,具有芳香性。即较 难发生加成反应和氧化反应,而一定条件下容易发生取代反应。 (一)取代反应 1.卤代反应在铁粉或三卤化铁的催化下,苯与卤素作用生成卤代苯。由于 氟代反应太剧烈不易控制,而碘不活泼难以反应,所以苯的卤代反应通常是氯代 和溴代反应。 +asc-○a+a ○+,+He
连-三甲苯 偏-三甲苯 均-三甲苯 1,2,3-三甲苯 1,2,4-三甲苯 1,3,5-三甲苯 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 芳烃分子中去掉一个 H 后剩下的基团称为芳香烃基或芳基,常用“Ar-”表 示。常见的芳基有:苯基 C6H5-(phenyl),可用“Ph-”表示;苯甲基或称苄基 C6H5-CH2-。 苯基 CH3 CH2 苯甲基或苄基 邻甲苯基 三、苯及其同系物的物理性质 苯及其同系物一般为具有特殊气味的液体,不溶于水,是许多有机物的良好 溶剂。苯及其同系物的蒸气有毒,对中枢神经和造血器官有损害,长期接触会导 致白细胞减少和头晕乏力等,使用时需注意采取防护措施。 苯及同系物密度都小于 1,但比链烃、脂环烃高 四、苯及其同系物的化学性质 苯环的特殊结构使苯的化学性质与不饱和烃有显著不同,具有芳香性。即较 难发生加成反应和氧化反应,而一定条件下容易发生取代反应。 (一) 取代反应 1.卤代反应 在铁粉或三卤化铁的催化下,苯与卤素作用生成卤代苯。由于 氟代反应太剧烈不易控制,而碘不活泼难以反应,所以苯的卤代反应通常是氯代 和溴代反应。 Cl2 FeCl3 Cl HCl 55 ~ 60 + ℃ + Br2 FeBr3 + Br + HBr
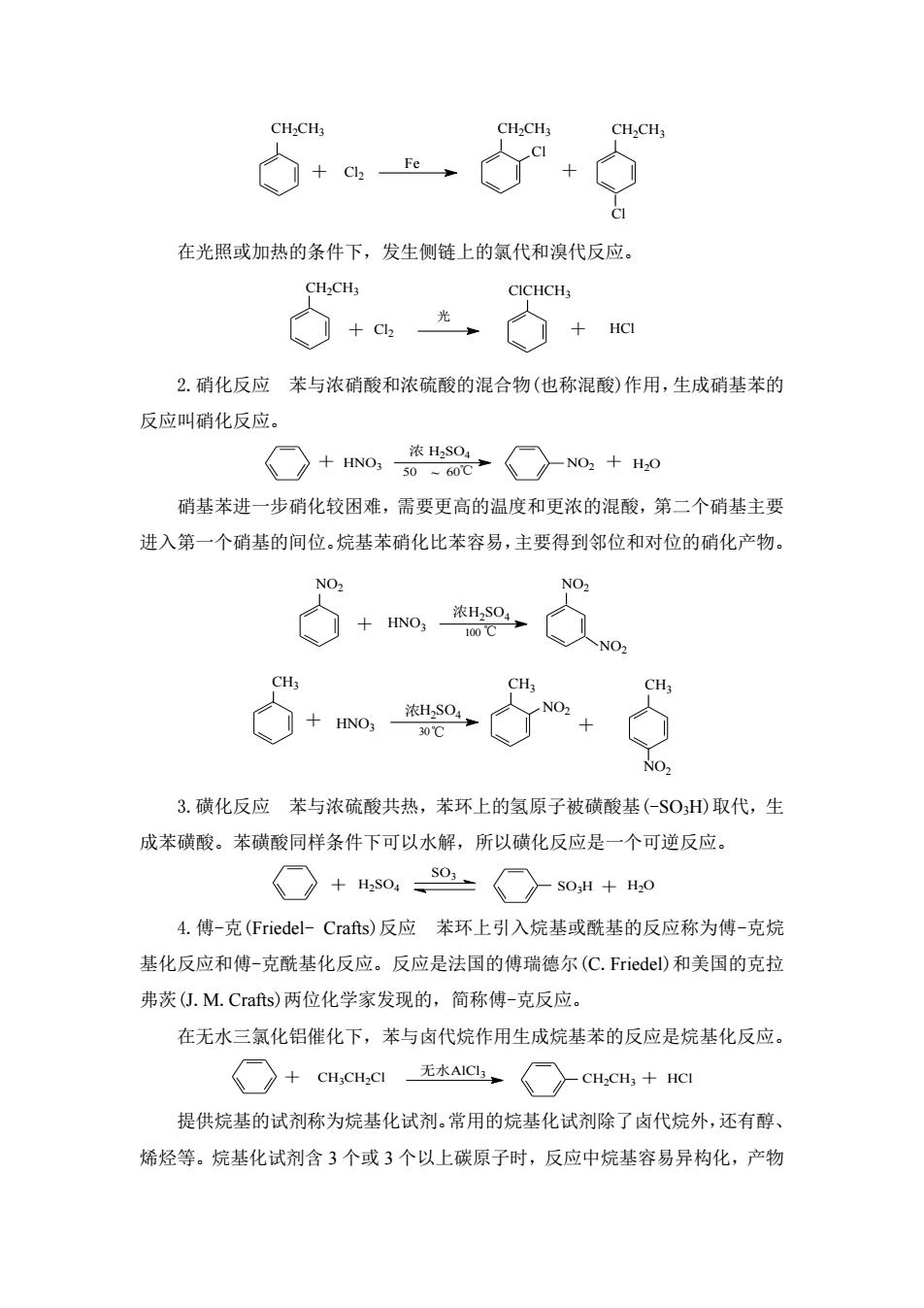
在光照或加热的条件下,发生侧链上的氯代和溴代反应。 CH:CH3 CICHCH, ◇+老,◇+阳 2.硝化反应苯与浓硝酸和浓硫酸的混合物(也称混酸)作用,生成硝基苯的 反应叫硝化反应。 ○+o,w02〈○N0,+H0 硝基苯进一步硝化较困难,需要更高的温度和更浓的混酸,第二个硝基主要 进入第一个硝基的间位。烷基苯硝化比苯容易,主要得到邻位和对位的硝化产物。 大+o个 人NO2 3.磺化反应苯与浓硫酸共热,苯环上的氢原子被磺酸基($OHD)取代,生 成苯磺酸。苯磺酸同样条件下可以水解,所以磺化反应是一个可逆反应。 ☐+s0,o{○〉s0,H+H0 4.傅-克(Friedel-Crafts)反应苯环上引入烷基或酰基的反应称为傅-克烷 基化反应和傅-克酰基化反应。反应是法国的傅瑞德尔(C.Friedel)和美国的克拉 弗茨(.M.Crafts)两位化学家发现的,简称傅-克反应。 在无水三氯化铝催化下,苯与卤代烷作用生成烷基苯的反应是烷基化反应。 ○+CH.CHCI无水Aa,○cHeH,+HC 提供烷基的试剂称为烷基化试剂。常用的烷基化试剂除了卤代烷外,还有醇、 烯烃等。烷基化试剂含3个或3个以上碳原子时,反应中烷基容易异构化,产物
Cl2 Fe Cl CH2CH3 CH2CH3 Cl CH2CH3 + + 在光照或加热的条件下,发生侧链上的氯代和溴代反应。 Cl2 HCl CH2CH3 ClCHCH3 光 + + 2.硝化反应 苯与浓硝酸和浓硫酸的混合物(也称混酸)作用,生成硝基苯的 反应叫硝化反应。 50 ~ 60 HNO3 浓 H2SO4 + ℃ NO2 + H2O 硝基苯进一步硝化较困难,需要更高的温度和更浓的混酸,第二个硝基主要 进入第一个硝基的间位。烷基苯硝化比苯容易,主要得到邻位和对位的硝化产物。 HNO3 H2SO4 NO2 NO2 浓 NO2 + 100℃ 浓 ℃ CH3 HNO3 H2SO4 NO2 NO2 30 CH3 CH3 + + 3.磺化反应 苯与浓硫酸共热,苯环上的氢原子被磺酸基(-SO3H)取代,生 成苯磺酸。苯磺酸同样条件下可以水解,所以磺化反应是一个可逆反应。 H2SO4 H2O SO3 + SO3H + 4.傅-克(Friedel- Crafts)反应 苯环上引入烷基或酰基的反应称为傅-克烷 基化反应和傅-克酰基化反应。反应是法国的傅瑞德尔(C.Friedel)和美国的克拉 弗茨(J.M.Crafts)两位化学家发现的,简称傅-克反应。 在无水三氯化铝催化下,苯与卤代烷作用生成烷基苯的反应是烷基化反应。 CH3CH2Cl AlCl3 CH2CH3 HCl + 无水 + 提供烷基的试剂称为烷基化试剂。常用的烷基化试剂除了卤代烷外,还有醇、 烯烃等。烷基化试剂含 3 个或 3 个以上碳原子时,反应中烷基容易异构化,产物
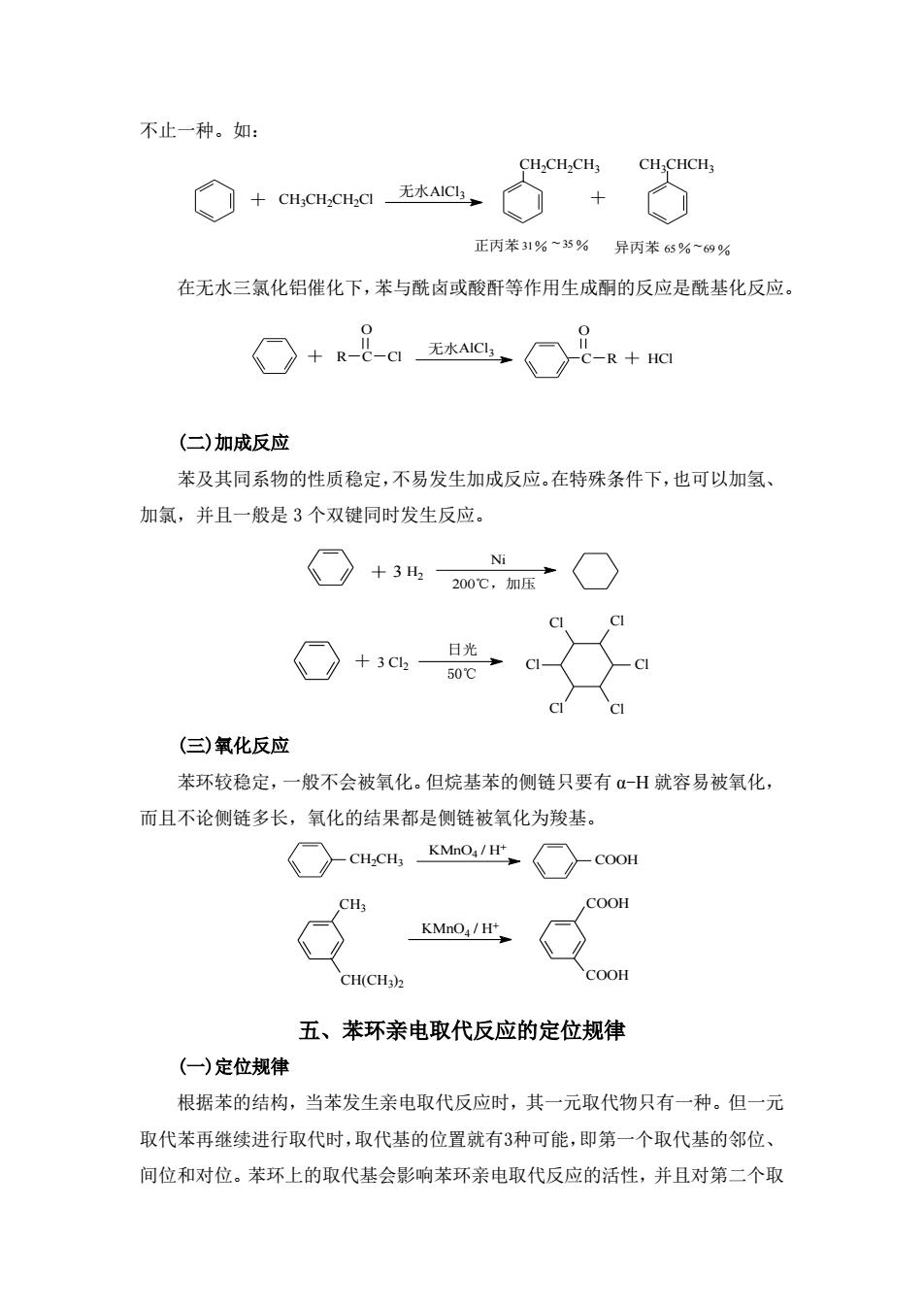
不止一种。如: CH-CH.CHCH CHCH ◇+CNAICG◇+◇ 正丙苯3引%~35%异丙苯65%~69% 在无水三氯化铝催化下,苯与酰卤或酸酐等作用生成酮的反应是酰基化反应。 O+8-。@,O8+阳 (二)加成反应 苯及其同系物的性质稳定,不易发生加成反应。在特殊条件下,也可以加氢、 加氯,并且一般是3个双键同时发生反应。 CI ○+3c (三)氧化反应 苯环较稳定,一般不会被氧化。但烷基苯的侧链只要有α-H就容易被氧化 而且不论侧链多长,氧化的结果都是侧链被氧化为羧基。 ○CH.CHKM/○-cooH COOH KMnO/H CH(CHh COOH 五、苯环亲电取代反应的定位规律 (一)定位规律 根据苯的结构,当苯发生亲电取代反应时,其一元取代物只有一种。但一元 取代苯再继续进行取代时,取代基的位置就有3种可能,即第一个取代基的邻位、 间位和对位。苯环上的取代基会影响苯环亲电取代反应的活性,并且对第二个取
不止一种。如: AlCl CH 无水 3 3CH2CH2Cl CH2CH2CH3 CH3CHCH3 正丙苯31% 35% 异丙苯 65% 69% ~ ~ + + 在无水三氯化铝催化下,苯与酰卤或酸酐等作用生成酮的反应是酰基化反应。 AlCl 无水 3 R-C-C HCl l O -C-R O + + (二)加成反应 苯及其同系物的性质稳定,不易发生加成反应。在特殊条件下,也可以加氢、 加氯,并且一般是 3 个双键同时发生反应。 H2 Ni + 3 200℃,加压 + 3 Cl2 日光 50℃ Cl Cl Cl Cl Cl Cl (三)氧化反应 苯环较稳定,一般不会被氧化。但烷基苯的侧链只要有 α-H 就容易被氧化, 而且不论侧链多长,氧化的结果都是侧链被氧化为羧基。 COOH KMnO4 / H+ CH2CH3 COOH KMnO4 / H+ CH(CH3 )2 CH3 COOH 五、苯环亲电取代反应的定位规律 (一)定位规律 根据苯的结构,当苯发生亲电取代反应时,其一元取代物只有一种。但一元 取代苯再继续进行取代时,取代基的位置就有3种可能,即第一个取代基的邻位、 间位和对位。苯环上的取代基会影响苯环亲电取代反应的活性,并且对第二个取

代基进入苯环的位置具有支配作用。我们将苯环上原有的取代基称为定位基。 1.邻、对位定位基邻、对位定位基一般使新引入的取代基主要进入其邻位 和对位。该类定位基中与苯环相连的原子不含重键,且多数有未共用电子对。属 于这类定位基的主要有: -NR2、-NH2、-OH、-OR、-NHCOR、-OCOR、-R、-Ar、-X 2.间位定位基间位定位基一般使新引入的取代基主要进入其间位。该类定 位基中与苯环相连的原子一般含有重键或带正电荷。属于这类定位基的主要有: -NR3、-NO2、-CN、-SOH、-CHO、-COOH 邻、对位定位基(除卤素外)一般使苯环活化,即使苯环的亲电取代反应变得 比苯容易。间位定位基可使苯环钝化,使苯环发生亲电取代反应变得比苯困难, (二)定位规律的解释 1.邻、对位定位基的影响这类定位基一般有供电子效应,能使苯环电子云 密度增大(除卤素外),尤其是邻位和对位的电子云密度增加更显著,更有利于亲 电反应发生。 2间位定位基的影响以硝基苯为例。硝基有吸电子诱导效应,同时硝基中 氮氧π键与苯环的大π形成ππ共轭效应,因氧和氮的电负性都比碳大,使 共轭体系的电子云移向硝基。诱导效应和共轭效应方向一致,均使苯环上的电子 云密度降低,尤其是硝基的邻、对位电子云密度降低较多,所以硝基苯进行亲电 取代反应比苯难,且主要产物是间位取代物。 (三)定位规律的应用 应用苯环上取代基的定位规律,可以合理设计合成路线,以及预测取代反应 的主要产物。例如,由苯制备邻硝基氯苯,因为-C1是邻、对位定位基,要先氯 化后硝化。而制备间硝基氯苯,则需要先硝化后氯代。 六、稠环芳香烃
代基进入苯环的位置具有支配作用。我们将苯环上原有的取代基称为定位基。 1.邻、对位定位基 邻、对位定位基一般使新引入的取代基主要进入其邻位 和对位。该类定位基中与苯环相连的原子不含重键,且多数有未共用电子对。属 于这类定位基的主要有: -NR2、-NH2、-OH、-OR、-NHCOR、-OCOR、-R、-Ar、-X 2.间位定位基 间位定位基一般使新引入的取代基主要进入其间位。该类定 位基中与苯环相连的原子一般含有重键或带正电荷。属于这类定位基的主要有: -N +R3、 -NO2、 -CN、 -SO3H、 -CHO、 -COOH 邻、对位定位基(除卤素外)一般使苯环活化,即使苯环的亲电取代反应变得 比苯容易。间位定位基可使苯环钝化,使苯环发生亲电取代反应变得比苯困难。 (二)定位规律的解释 1.邻、对位定位基的影响 这类定位基一般有供电子效应,能使苯环电子云 密度增大(除卤素外),尤其是邻位和对位的电子云密度增加更显著,更有利于亲 电反应发生。 2.间位定位基的影响 以硝基苯为例。硝基有吸电子诱导效应,同时硝基中 氮氧 π 键与苯环的大 π 形成 π-π 共轭效应,因氧和氮的电负性都比碳大,使 共轭体系的电子云移向硝基。诱导效应和共轭效应方向一致,均使苯环上的电子 云密度降低,尤其是硝基的邻、对位电子云密度降低较多,所以硝基苯进行亲电 取代反应比苯难,且主要产物是间位取代物。 (三) 定位规律的应用 应用苯环上取代基的定位规律,可以合理设计合成路线,以及预测取代反应 的主要产物。例如,由苯制备邻硝基氯苯,因为-Cl是邻、对位定位基,要先氯 化后硝化。而制备间硝基氯苯,则需要先硝化后氯代。 Cl Cl NO2 Cl2 、Fe HNO3 、H2SO4 Cl NO2 Cl2 、FeCl HNO3 、H2SO4 3 NO2 六、稠环芳香烃

(一)萘 萘的分子式为CHg,由两个苯环稠合而成。 OH ℃o州 a-茶酚 B-蔡碳酸 萘为白色片状晶体,有特殊的气味,熔点80.5℃,沸点218℃,易升华,不 溶于水,能溶于有机溶剂。 萘具有与苯相似的性质,但比苯活泼一些。萘分子的电子云分布不是完全平 均化,a-位电子云密度较大,所以a位比阝-位更易发生反应。 二、蒽和菲 蒽为无色片状晶体,有蓝紫色荧光,熔点216℃,沸点340℃:菲是具有金 属光泽的无色片状晶体,熔点100℃,沸点340℃。都不溶于水,而易溶于苯。 各种留体药物中都含有环戊烷并多氢菲的结构
(一)萘 萘的分子式为 C10H8,由两个苯环稠合而成。 α α α α β β β β 1 2 3 5 4 6 7 8 SO3H OH 萘 α -萘酚 β -萘磺酸 萘为白色片状晶体,有特殊的气味,熔点 80.5℃,沸点 218℃,易升华,不 溶于水,能溶于有机溶剂。 萘具有与苯相似的性质,但比苯活泼一些。萘分子的电子云分布不是完全平 均化,α-位电子云密度较大,所以 α-位比 β-位更易发生反应。 二、蒽和菲 蒽 菲 1 2 3 5 4 6 7 8 9 10 1 2 6 5 4 3 7 8 9 10 蒽为无色片状晶体,有蓝紫色荧光,熔点 216℃,沸点 340℃;菲是具有金 属光泽的无色片状晶体,熔点 100℃,沸点 340℃。都不溶于水,而易溶于苯。 各种甾体药物中都含有环戊烷并多氢菲的结构