
氧化还原反应 一、氧化数的概念 氧化数(oxidation number)又称氧化值,是为表示各元素在化合物中所处的化合状态 而引进的一个概念。1970年国际纯粹与应用化学联合会(IUPAC)对氧化数作了如下定义: 氧化数是某元素一个原子的形式电荷数(或表观电荷数),这种电荷数是假设把每个键中的 电子指定给电负性更大的原子而求得。离子化合物中,简单阴、阳离子所带的电荷数就是该 元素原子的氧化数,例如CaC2中,Ca的氧化数为+2,C1的氧化数为-1。对共价化合物来 说,共用电子对偏向电负性较大的原子,如HC1(HC)中,共用电子对偏向C1,则C的 氧化数为-1,H的氧化数为+1。 为确定元素原子的氧化数,其规则如下: (1)在单质中,元素原子的氧化数为零。 (2)在化合物中,H的氧化数一般为+1,只有在活泼金属的氢化物(如NaH、CaH,) 中,其氧化数为-1:0的氧化数一般为-2,但在过氧化物(如H,O2、Na,02)中,其氧化数 为,在超氧化物(如K0)中,其氧化数为分在氟化物(如O、O,)中,其氧化数 分别为+1、+2:F的氧化数总为-1。 (3)单原子构成的离子的电荷数等于其氧化数,例如C中钙的氧化数为+2。复杂离 子的电荷数等于其中各原子的氧化数之和,例如C0,2的电荷数为2,其数值等于组成碳酸 根的C原子和0原子的氧化数之和。分子中各原子氧化数之和为0: 【例】计算下列物质中S的氧化数:S02、S0,2、Na2S06。 解:设S的氧化数为x,因为O的氧化数为-2,Na的氧化数为+H,则根据氧化数规则 得, 在S02中:x+4×(-2)=-2,x=+6 在S02中:2x+3×(2)=2,x=+2 在Na2S,0中:2×(+1)+4x+6×(←2)=0,x=+2.5 【例】求FeO,中Fe的氧化数 解:设F®的氧化数为x,因为0的氧化数为-2,则根据氧化数规则得: +4*网=0=号 可见,同一元素在不同化合物中的氧化数可能不同。氧化数并不是一个元素原子所带的
氧化还原反应 一、氧化数的概念 氧化数(oxidation number)又称氧化值,是为表示各元素在化合物中所处的化合状态 而引进的一个概念。1970 年国际纯粹与应用化学联合会(IUPAC)对氧化数作了如下定义: 氧化数是某元素一个原子的形式电荷数(或表观电荷数),这种电荷数是假设把每个键中的 电子指定给电负性更大的原子而求得。离子化合物中,简单阴、阳离子所带的电荷数就是该 元素原子的氧化数,例如 CaCl2 中,Ca 的氧化数为+2,Cl 的氧化数为-1。对共价化合物来 说,共用电子对偏向电负性较大的原子,如 HCl(H:Cl)中,共用电子对偏向 Cl,则 Cl 的 氧化数为-1,H 的氧化数为+1。 为确定元素原子的氧化数,其规则如下: (1)在单质中,元素原子的氧化数为零。 (2)在化合物中,H 的氧化数一般为+1,只有在活泼金属的氢化物(如 NaH、CaH2) 中,其氧化数为-1;O 的氧化数一般为-2,但在过氧化物(如 H2O2、Na2O2)中,其氧化数 为-1,在超氧化物(如 KO2)中,其氧化数为- 2 1 ,在氟化物(如 O2F2、OF2)中,其氧化数 分别为+1、+2;F 的氧化数总为-1。 (3)单原子构成的离子的电荷数等于其氧化数,例如 Ca 2+中钙的氧化数为+2。复杂离 子的电荷数等于其中各原子的氧化数之和,例如 CO3 2-的电荷数为-2,其数值等于组成碳酸 根的 C 原子和 O 原子的氧化数之和。分子中各原子氧化数之和为 0。 【例】计算下列物质中 S 的氧化数:SO4 2-、S2O3 2-、Na2S4O6。 解:设 S 的氧化数为 x,因为 O 的氧化数为-2,Na 的氧化数为+l,则根据氧化数规则 得, 在 SO4 2-中: x + 4 × (-2) =-2,x = +6 在 S2O3 2-中:2x + 3 × (-2) = -2,x = +2 在 Na2S4O6 中:2 × (+1)+4 x + 6 × (-2) = 0,x = +2.5 【例】求 Fe3O4 中 Fe 的氧化数。 解:设 Fe 的氧化数为 x,因为 O 的氧化数为-2,则根据氧化数规则得; 3x + 4 × (-2) = 0,x = 8 3 可见,同一元素在不同化合物中的氧化数可能不同。氧化数并不是一个元素原子所带的

真实电荷数,与化合价的概念是不同的。氧化数可以为整数、分数(小数)、正数、负数 也可以为零。 二、氧化还原反应的基本概念 氧化还原反应的本质是反应中有电子得失(或偏移)。反应物质间有电子得失(或偏移) 的反应称为氧化还原反应。 根据氧化数的概念,有元素氧化数在化学反应前后发生变化的反应为氧化还原反应,元 素氧化数发生变化的实质是元素原子间发生了电子得失或偏移。 (一)氧化剂和还原剂 在氧化还原反应中,元素氧化数升高的过程称为氧化,也叫氧化反应,元素氧化数升高 的反应物称为还原剂(reducing agent),还原剂失电子被氧化,生成的物质叫氧化产物:元 素氧化数降低的过程称为还原,也叫还原反应,元素氧化数降低的反应物称为氧化剂 (oxidizing agent),氧化剂得电子被还原,生成的物质叫还原产物。 例如下列反应中: 化剂 此反应中C的氧化数从0升高至+4,C元素被氧化,生成C02,碳是还原剂,二氧化 碳为氧化产物:硝酸中N的氧化数从+5降低至+4,N元素被还原,生成NO2,硝酸是氧化 剂,二氧化氮为还原产物。 氧化剂和还原剂是同一物质的氧化还原反应称为自身氧化还原反应 例如: 2KC1O=2KCI+O,↑ 如果自身氧化还原反应中的某个元素既发生氧化反应又发生还原反应,这种反应叫做歧 化反应。 例如: +HO-HCIO+HC 4KCI0=3KC0+KC (二)氧化反应和还原反应 氧化还原反应一般可看作由氧化反应和还原反应两个半反应构成。 例如:
真实电荷数,与化合价的概念是不同的。氧化数可以为整数、分数(小数)、正数、负数, 也可以为零。 二、氧化还原反应的基本概念 氧化还原反应的本质是反应中有电子得失(或偏移)。反应物质间有电子得失(或偏移) 的反应称为氧化还原反应。 根据氧化数的概念,有元素氧化数在化学反应前后发生变化的反应为氧化还原反应,元 素氧化数发生变化的实质是元素原子间发生了电子得失或偏移。 (一)氧化剂和还原剂 在氧化还原反应中,元素氧化数升高的过程称为氧化,也叫氧化反应,元素氧化数升高 的反应物称为还原剂(reducing agent),还原剂失电子被氧化,生成的物质叫氧化产物;元 素氧化数降低的过程称为还原,也叫还原反应,元素氧化数降低的反应物称为氧化剂 (oxidizing agent),氧化剂得电子被还原,生成的物质叫还原产物。 例如下列反应中: 3 2 2 2 0 +4 5 +4 C + = 4 N O + C O + 2H O 4H N O 还原剂 氧化剂 还原产物 氧化产物 此反应中 C 的氧化数从 0 升高至+4,C 元素被氧化,生成 CO2,碳是还原剂,二氧化 碳为氧化产物;硝酸中 N 的氧化数从+5 降低至+4,N 元素被还原,生成 NO2,硝酸是氧化 剂,二氧化氮为还原产物。 氧化剂和还原剂是同一物质的氧化还原反应称为自身氧化还原反应。 例如: 2KClO3=2KCl + O2 ↑ 如果自身氧化还原反应中的某个元素既发生氧化反应又发生还原反应,这种反应叫做歧 化反应。 例如: 2 2 0 1 1 Cl + H O= HClO + HCl 3 4 5 7 1 4K ClO = 3K ClO + K Cl (二)氧化反应和还原反应 氧化还原反应一般可看作由氧化反应和还原反应两个半反应构成。 例如:

Cu2*+Zn Cu+Zn2 反应可以看成由两个半反应组成: 氧化反应:Zn=Zn2+2e 还原反应:Cu2+2cCu 每个半反应中氧化型物质(氧化数较高的物质)和还原型物质(氧化数较低的物质) 成对出现,称为氧化还原电对(redoxeler coup),简称电对。上述反应中的两个氧化还 原电对为Cu2Cu,Zn亿n。电对通常书写为“氧化型还原型(Ox/Red)”。 氧化还原半反应通式可写做: 氧化型+ne三还原型 或 Ox+ne'Red 上述电对中的氧化型物质得电子,在反应中作氧化剂:还原型物质失电子,在反应中 作还原剂。氧化还原反应的实质也可以理解为两个电对之间的电子转移。 氧化型物质的氧化能力与还原型物质的还原能力存在如下关系,氧化型物质的氧化能 力越强,其对应的还原型物质的还原能力越弱:氧化型物质的氧化能力越弱,其对应的还原 型物质的还原能力越强。例如,MnO,Mn2“电对中,MnO,氧化能力较强,是强氧化剂,而 Mn还原能力弱,是弱还原剂:Zn亿n电对中,Zn*是弱氧化剂,而Zn是强还原剂。 三、氧化还原反应方程式的配平 氧化还原反应体系一般较为复杂,除氧化剂和还原剂外,还有介质的参与。配平氧化还 原方程式的方法很多,常用的有氧化数法、离子电子法。 (一)氧化数法 1配平原则 (1)元素原子氧化数升高的总数等于元素原子氧化数降低的总数: (2)反应前后各元素原子的总数相等。 2.配平步骤 现以Cu+HNO(稀)→CuNO+NC为例说明氧化数法配平氧化还原反应方程式的 步骤 (1)写出未配平的反应方程式,标出反应前后氧化数发生变化的元素原子的氧化数
2+ 2+ Cu + Zn Cu + Zn 反应可以看成由两个半反应组成: 氧化反应: 2+ - Zn Zn +2e 还原反应: 2+ - Cu +2e Cu 每个半反应中氧化型物质(氧化数较高的物质)和还原型物质(氧化数较低的物质) 成对出现,称为氧化还原电对(redox electric couple),简称电对。上述反应中的两个氧化还 原电对为 Cu2+/Cu,Zn2+/Zn。电对通常书写为“氧化型/还原型(Ox/Red)”。 氧化还原半反应通式可写做: - 氧化型 + ne 还原型 或 - Ox + ne Red 上述电对中的氧化型物质得电子,在反应中作氧化剂;还原型物质失电子,在反应中 作还原剂。氧化还原反应的实质也可以理解为两个电对之间的电子转移。 氧化型物质的氧化能力与还原型物质的还原能力存在如下关系,氧化型物质的氧化能 力越强,其对应的还原型物质的还原能力越弱;氧化型物质的氧化能力越弱,其对应的还原 型物质的还原能力越强。例如,MnO4 - /Mn2+电对中,MnO4 -氧化能力较强,是强氧化剂,而 Mn2+还原能力弱,是弱还原剂;Zn2+/Zn 电对中,Zn2+是弱氧化剂,而 Zn 是强还原剂。 三、氧化还原反应方程式的配平 氧化还原反应体系一般较为复杂,除氧化剂和还原剂外,还有介质的参与。配平氧化还 原方程式的方法很多,常用的有氧化数法、离子-电子法。 (一)氧化数法 1.配平原则 (1)元素原子氧化数升高的总数等于元素原子氧化数降低的总数; (2)反应前后各元素原子的总数相等。 2.配平步骤 现以 Cu + HNO ( ) Cu (NO ) + NO 3 3 2 稀 为例说明氧化数法配平氧化还原反应方程式的 步骤。 (1)写出未配平的反应方程式,标出反应前后氧化数发生变化的元素原子的氧化数
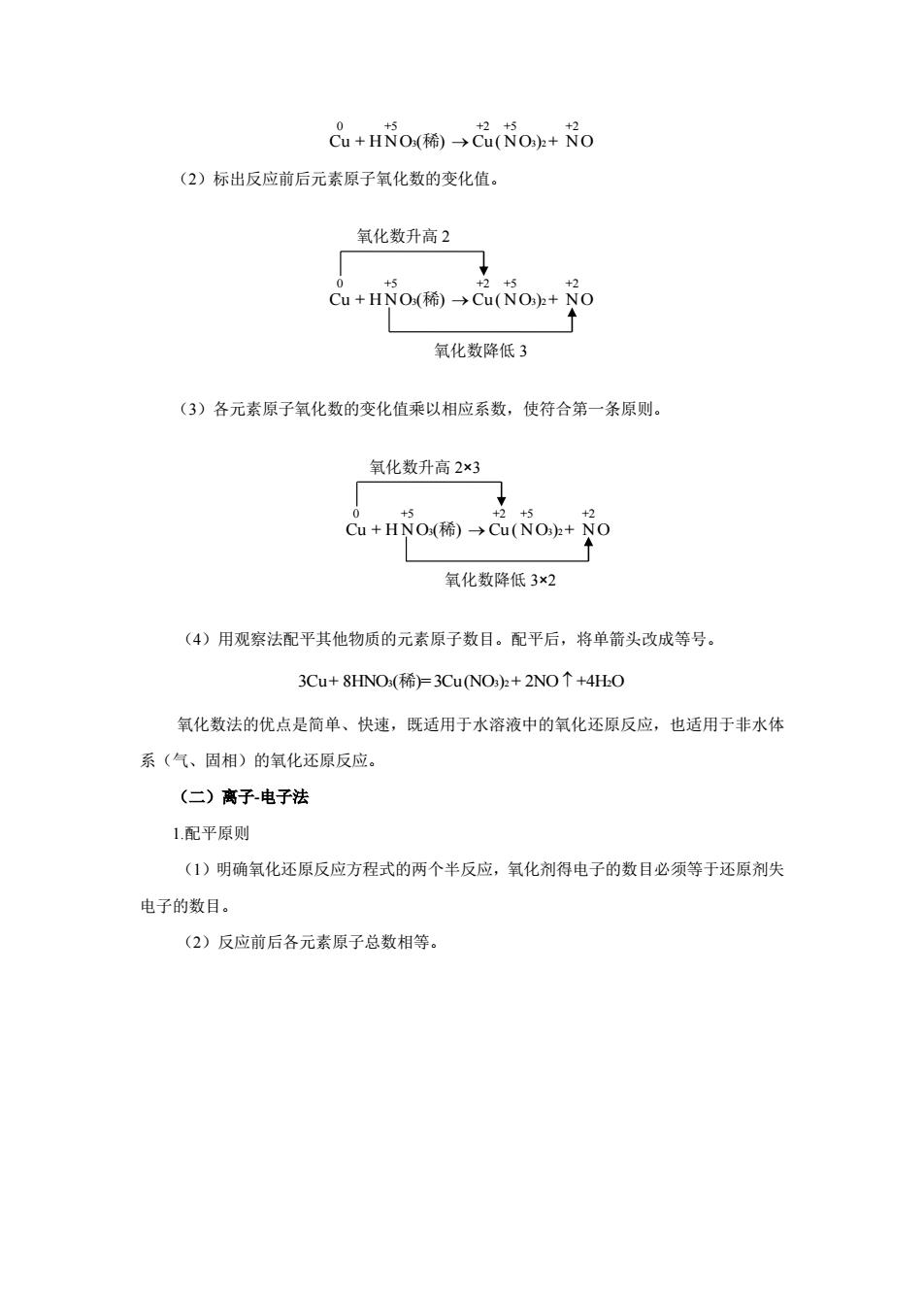
0 +5 +2+5 +2 Cu+HNO(稀)→Cu(NO+NO (2)标出反应前后元素原子氧化数的变化值。 氧化数升高2 0 +5 +2+5 x2 Cu+HNO(稀)→Cu(NOh+NO 氧化数降低3 (3)各元素原子氧化数的变化值乘以相应系数,使符合第一条原则。 氧化数升高2×3 0 +5 +2+5 +2 Cu+HNO(稀)→Cu(NOh+NO 氧化数降低3×2 (4)用观察法配平其他物质的元素原子数目。配平后,将单箭头改成等号。 3Cu+8HNO(稀)=3 Cu(NO3)2+2NO个+4HO 氧化数法的优点是简单、快速,既适用于水溶液中的氧化还原反应,也适用于非水体 系(气、固相)的氧化还原反应。 (二)高子电子法 1.配平原则 (1)明确氧化还原反应方程式的两个半反应,氧化剂得电子的数目必须等于还原剂失 电子的数目。 (2)反应前后各元素原子总数相等
3 3 2 0 +5 +2 +5 +2 Cu + H NO ( ) Cu ( NO ) + NO 稀 (2)标出反应前后元素原子氧化数的变化值。 3 3 2 0 +5 +2 +5 +2 Cu + H NO ( ) Cu ( NO ) + NO 稀 (3)各元素原子氧化数的变化值乘以相应系数,使符合第一条原则。 3 3 2 0 +5 +2 +5 +2 Cu + H NO ( ) Cu ( NO ) + NO 稀 (4)用观察法配平其他物质的元素原子数目。配平后,将单箭头改成等号。 3Cu+ 8HNO ( )= 3Cu(NO ) + 2NO +4H O 3 3 2 2 稀 氧化数法的优点是简单、快速,既适用于水溶液中的氧化还原反应,也适用于非水体 系(气、固相)的氧化还原反应。 (二)离子-电子法 1.配平原则 (1)明确氧化还原反应方程式的两个半反应,氧化剂得电子的数目必须等于还原剂失 电子的数目。 (2)反应前后各元素原子总数相等。 氧化数降低 3×2 氧化数降低 3 氧化数升高 2×3 氧化数升高 2