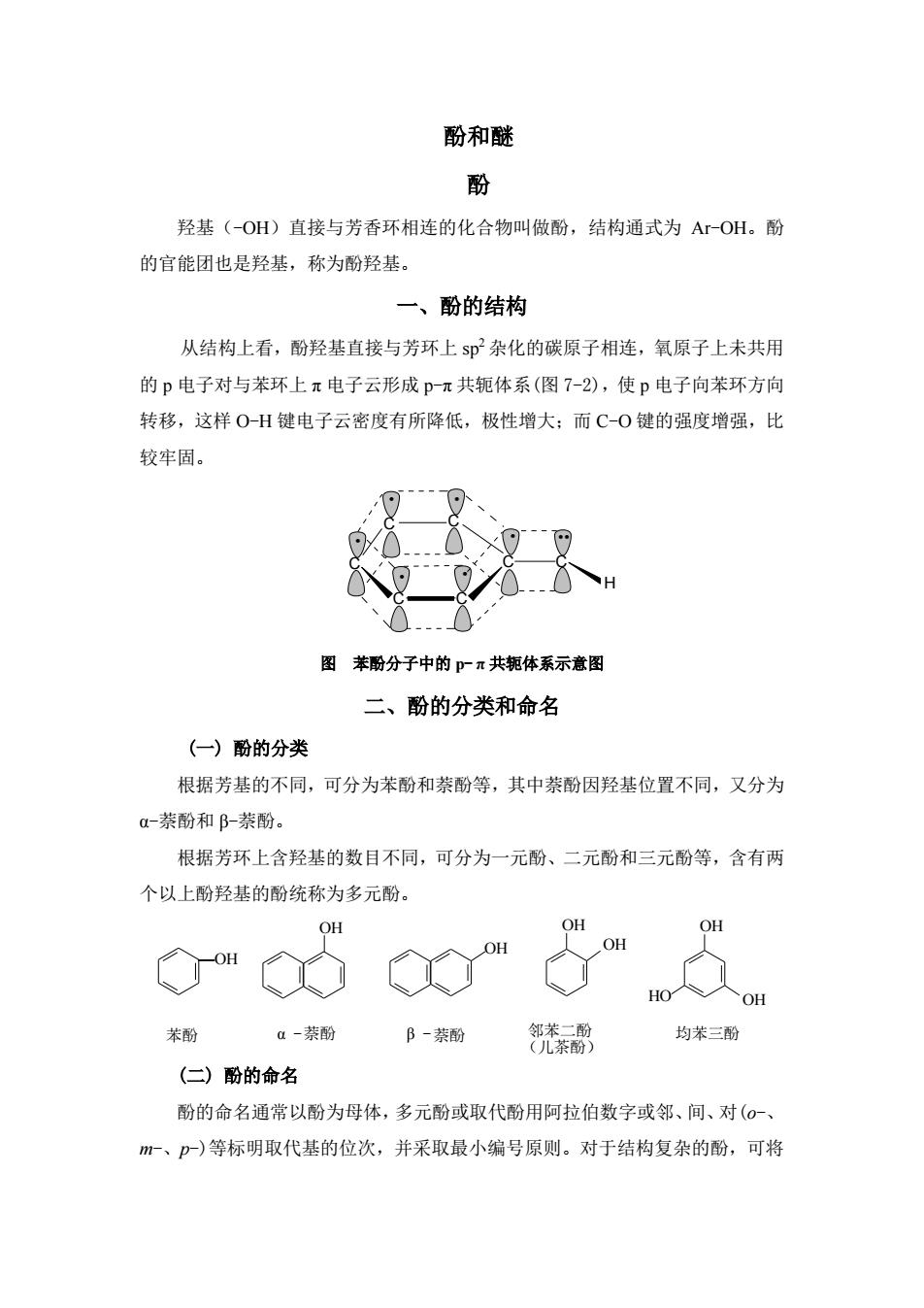
酚和醚 酚 羟基(-OH)直接与芳香环相连的化合物叫做酚,结构通式为ArOH。酚 的官能团也是羟基,称为酚羟基。 一、酚的结构 从结构上看,酚羟基直接与芳环上即杂化的碳原子相连,氧原子上未共用 的p电子对与苯环上π电子云形成Pπ共轭体系(图7-2),使p电子向苯环方向 转移,这样0H键电子云密度有所降低,极性增大:而C-0键的强度增强,比 较牢固。 图苯酚分子中的广π共钜体系示意图 二、酚的分类和命名 (一)酚的分类 根据芳基的不同,可分为苯酚和萘酚等,其中萘酚因羟基位置不同,又分为 a-萘酚和阝-萘酚。 根据芳环上含羟基的数目不同,可分为一元酚、二元酚和三元酚等,含有两 个以上酚羟基的酚统称为多元酚。 OH OH OH 苯酚 a一萘酚 B-茶酚 邻巷茶副 均苯三酚 (二)酚的命名 酚的命名通常以酚为母体,多元酚或取代酚用阿拉伯数字或邻、间、对(0 m-、P)等标明取代基的位次,并采取最小编号原则。对于结构复杂的酚,可将
酚和醚 酚 羟基(-OH)直接与芳香环相连的化合物叫做酚,结构通式为 Ar-OH。酚 的官能团也是羟基,称为酚羟基。 一、酚的结构 从结构上看,酚羟基直接与芳环上 sp 2 杂化的碳原子相连,氧原子上未共用 的 p 电子对与苯环上 π 电子云形成 p-π 共轭体系(图 7-2),使 p 电子向苯环方向 转移,这样 O-H 键电子云密度有所降低,极性增大;而 C-O 键的强度增强,比 较牢固。 C C C C C C C H · · · · · · ·· 图 苯酚分子中的 p- π 共轭体系示意图 二、酚的分类和命名 (一) 酚的分类 根据芳基的不同,可分为苯酚和萘酚等,其中萘酚因羟基位置不同,又分为 α-萘酚和 β-萘酚。 根据芳环上含羟基的数目不同,可分为一元酚、二元酚和三元酚等,含有两 个以上酚羟基的酚统称为多元酚。 —OH OH OH HO OH OH OH OH 苯酚 邻苯二酚 (儿茶酚) α -萘酚 β -萘酚 均苯三酚 (二) 酚的命名 酚的命名通常以酚为母体,多元酚或取代酚用阿拉伯数字或邻、间、对(o-、 m-、p-)等标明取代基的位次,并采取最小编号原则。对于结构复杂的酚,可将
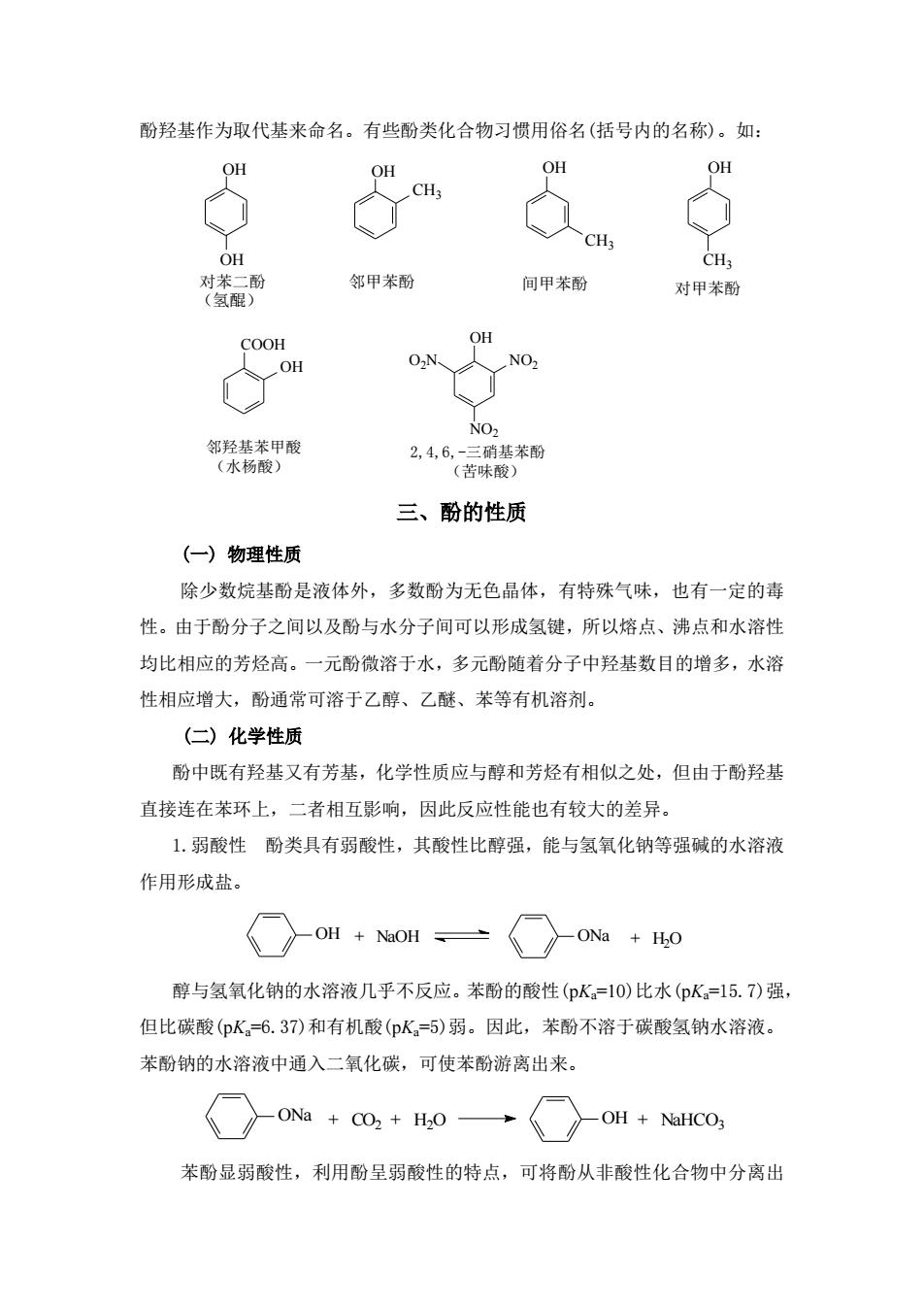
酚羟基作为取代基来命名。有些酚类化合物习惯用俗名(括号内的名称)。如: OH OH OH OH CH 人CH H 邻甲苯酚 间甲苯酚 对甲苯酚 COOH OH OH 02N NO2 邻羟基苯甲酸 (水杨酸) 三、酚的性质 (一)物理性质 除少数烷基酚是液体外,多数酚为无色晶体,有特殊气味,也有一定的毒 性。由于酚分子之间以及酚与水分子间可以形成氢键,所以熔点、沸点和水溶性 均比相应的芳烃高。一元酚微溶于水,多元酚随着分子中羟基数目的增多,水溶 性相应增大,酚通常可溶于乙醇、乙醚、苯等有机溶剂。 (二)化学性质 酚中既有羟基又有芳基,化学性质应与醇和芳烃有相似之处,但由于酚羟基 直接连在苯环上,二者相互影响,因此反应性能也有较大的差异。 1.弱酸性酚类具有弱酸性,其酸性比醇强,能与氢氧化钠等强碱的水溶液 作用形成盐 ○oi+oH、一○o0+io 醇与氢氧化钠的水溶液几乎不反应。苯酚的酸性(pK=10)比水(pK=15.7)强 但比碳酸(pK。6.37)和有机酸(pK。=5)弱。因此,苯酚不溶于碳酸氢钠水溶液。 苯酚钠的水溶液中通入二氧化碳,可使苯酚游离出来。 Coa+o+Ho→{○oH+aico, 苯酚显弱酸性,利用酚呈弱酸性的特点,可将酚从非酸性化合物中分离出
酚羟基作为取代基来命名。有些酚类化合物习惯用俗名(括号内的名称)。如: OH OH OH OH OH CH3 CH3 对苯二酚 邻甲苯酚 间甲苯酚 对甲苯酚 (氢醌) CH3 OH COOH 邻羟基苯甲酸 2,4,6,-三硝基苯酚 (水杨酸) (苦味酸) OH NO2 NO2 O2N 三、酚的性质 (一) 物理性质 除少数烷基酚是液体外,多数酚为无色晶体,有特殊气味,也有一定的毒 性。由于酚分子之间以及酚与水分子间可以形成氢键,所以熔点、沸点和水溶性 均比相应的芳烃高。一元酚微溶于水,多元酚随着分子中羟基数目的增多,水溶 性相应增大,酚通常可溶于乙醇、乙醚、苯等有机溶剂。 (二) 化学性质 酚中既有羟基又有芳基,化学性质应与醇和芳烃有相似之处,但由于酚羟基 直接连在苯环上,二者相互影响,因此反应性能也有较大的差异。 1.弱酸性 酚类具有弱酸性,其酸性比醇强,能与氢氧化钠等强碱的水溶液 作用形成盐。 OH + NaOH ONa + H2O 醇与氢氧化钠的水溶液几乎不反应。苯酚的酸性(pKa=10)比水(pKa=15.7)强, 但比碳酸(pKa=6.37)和有机酸(pKa=5)弱。因此,苯酚不溶于碳酸氢钠水溶液。 苯酚钠的水溶液中通入二氧化碳,可使苯酚游离出来。 + CO2 + H2O + NaHCO3 ONa OH 苯酚显弱酸性,利用酚呈弱酸性的特点,可将酚从非酸性化合物中分离出

来。先在混合物中加入碱液,使酚变成水溶性的酚钠,可将它与其他非酸性的有 机化合物分开。然后在水溶液通入C02即可游离出酚。 2.酚醚的生成由于酚羟基的氧与苯环形成p一π共轭,C-0键增强,酚羟基 之间就很难发生脱水反应,因此,酚醚不能由酚羟基间直接脱水得到。通常采用 酚钠与卤代烷或硫酸烷基酯等烷基化试剂制备酚醚。如: +aa◇oa+ 或(CH5hSO4 苯甲醚 酚类易发生氧化反应,有机合成中常利用这个反应使酚暂时转变为醚,完成 反应后再恢复原来的羟基,用以“保护酚羟基”。 OH m一 3.酯的生成酚也可以生成酯,但它不能与酸直接脱水成酯。采用酸酐或酰 氯等酰基化试剂与酚或酚钠作用可制得酚酯。如: 0 0 0 ○ou+QHg一o-da+cHoa 醋酸酐 醋酸苯酯 4.与三氯化铁的显色反应大多数酚都能与三氯化铁显色,不同的酚与三氯 化铁产生不同的颜色。例如:苯酚、间苯二酚遇三氯化铁溶液呈紫色,邻苯二酚、 对苯二酚则显绿色,甲苯酚遇三氯化铁呈蓝色,1,2,3-苯三酚显棕红色等。这种 显色反应,可以作为酚的定性检验。但具有羟基与双键碳原子相连(烯醇式)结构 的化合物大多也能与三氯化铁的水溶液发生显色反应, 5.氧化反应酚比醇容易被氧化,空气中的氧就能将酚慢慢氧化。苯酚氧化 后变为粉红色、红色、暗红色,颜色逐渐变深。苯酚若用重铬酸钾的硫酸溶液氧 化,则生成对苯醌 6.苯环上的取代反应酚羟基是强的邻、对位定位基,能使苯环活化,容易 发生卤代、硝化和磺化等亲电取代反应。 (1)卤代反应:苯酚与溴水在常温下即可作用,生成2,4,6-三溴苯酚的白色 沉淀。三溴苯酚溶解度很小,很稀的苯酚溶液与溴水作用也能生成三溴苯酚沉淀
来。先在混合物中加入碱液,使酚变成水溶性的酚钠,可将它与其他非酸性的有 机化合物分开。然后在水溶液通入 CO2 即可游离出酚。 2.酚醚的生成 由于酚羟基的氧与苯环形成 p-π 共轭,C-O 键增强,酚羟基 之间就很难发生脱水反应,因此,酚醚不能由酚羟基间直接脱水得到。通常采用 酚钠与卤代烷或硫酸烷基酯等烷基化试剂制备酚醚。如: ONa CH3 I 或 (CH3 )2SO4 OCH3 苯甲醚 + + NaI 酚类易发生氧化反应,有机合成中常利用这个反应使酚暂时转变为醚,完成 反应后再恢复原来的羟基,用以“保护酚羟基”。 OCH3 + + CH3 HI I OH 3.酯的生成 酚也可以生成酯,但它不能与酸直接脱水成酯。采用酸酐或酰 氯等酰基化试剂与酚或酚钠作用可制得酚酯。如: O O 醋酸酐 醋酸苯酯 CH3 CH3 O O OH + C O C O CCH3 + CH3C OH 4.与三氯化铁的显色反应 大多数酚都能与三氯化铁显色,不同的酚与三氯 化铁产生不同的颜色。例如:苯酚、间苯二酚遇三氯化铁溶液呈紫色,邻苯二酚、 对苯二酚则显绿色,甲苯酚遇三氯化铁呈蓝色,1,2,3-苯三酚显棕红色等。这种 显色反应,可以作为酚的定性检验。但具有羟基与双键碳原子相连(烯醇式)结构 的化合物大多也能与三氯化铁的水溶液发生显色反应。 5.氧化反应 酚比醇容易被氧化,空气中的氧就能将酚慢慢氧化。苯酚氧化 后变为粉红色、红色、暗红色,颜色逐渐变深。苯酚若用重铬酸钾的硫酸溶液氧 化,则生成对苯醌。 6.苯环上的取代反应 酚羟基是强的邻、对位定位基,能使苯环活化,容易 发生卤代、硝化和磺化等亲电取代反应。 (1)卤代反应:苯酚与溴水在常温下即可作用,生成 2,4,6-三溴苯酚的白色 沉淀。三溴苯酚溶解度很小,很稀的苯酚溶液与溴水作用也能生成三溴苯酚沉淀
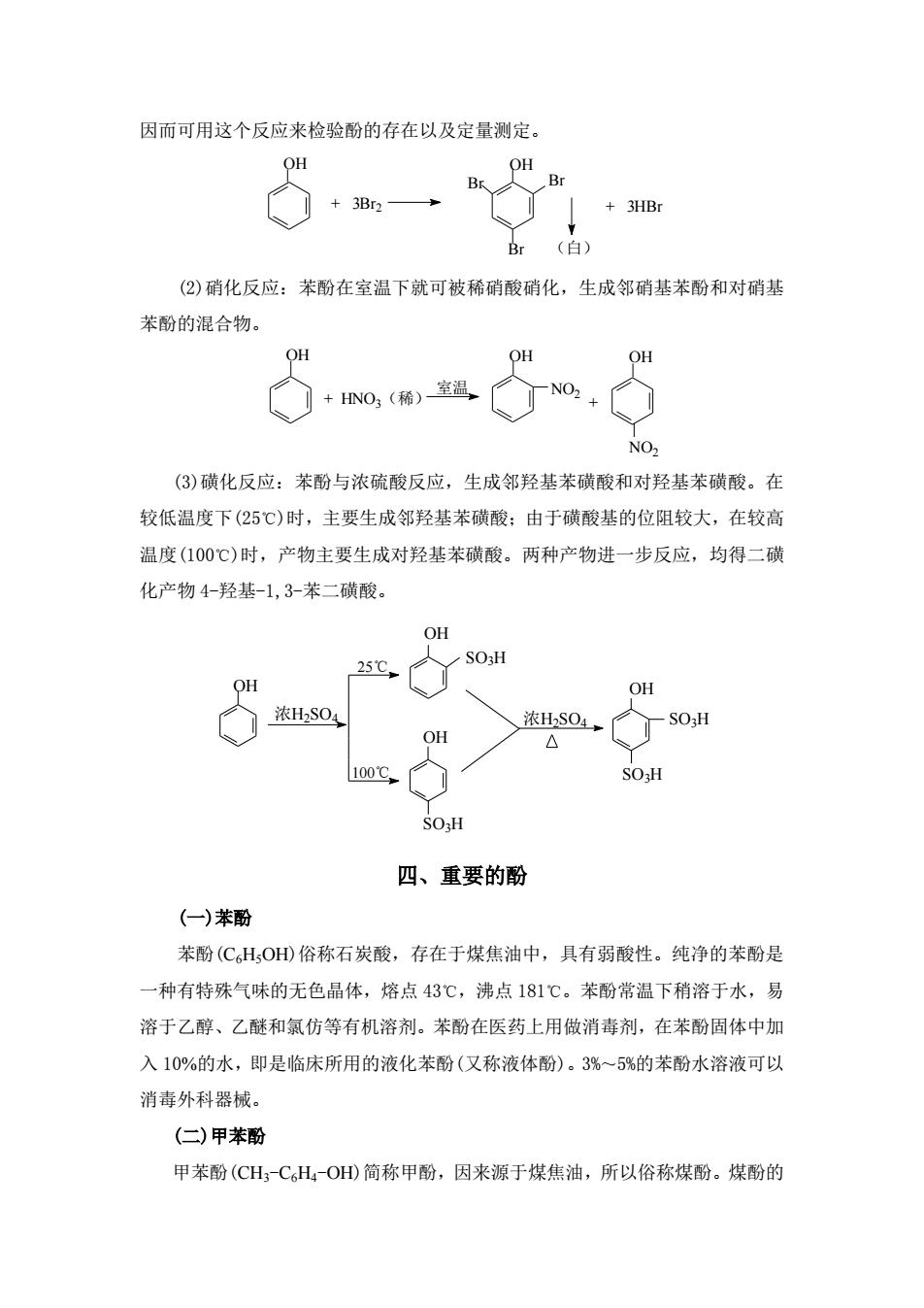
因而可用这个反应来检验酚的存在以及定量测定。 OH OH +3HB (白) (②)硝化反应:苯酚在室温下就可被稀硝酸硝化,生成邻硝基苯酚和对硝基 苯酚的混合物。 OH OH NO,(稀)室温 o+ NO (③)磺化反应:苯酚与浓硫酸反应,生成邻羟基苯磺酸和对羟基苯磺酸。在 较低温度下(25℃)时,主要生成邻羟基苯磺酸:由于磺酸基的位阻较大,在较高 温度(100℃)时,产物主要生成对羟基苯磺酸。两种产物进一步反应,均得二磺 化产物4-羟基-1,3-苯二磺酸。 OH 25℃, SO3H OH OH 浓Hs0 OH 浓S04, △ 100C SO:H SO3H 四、重要的酚 (一)苯酚 苯酚(C6HOHD俗称石炭酸,存在于煤焦油中,具有弱酸性。纯净的苯酚是 一种有特殊气味的无色晶体,熔点43℃,沸点181℃。苯酚常温下稍溶于水,易 溶于乙醇、乙醚和氯仿等有机溶剂。苯酚在医药上用做消毒剂,在苯酚固体中加 入10%的水,即是临床所用的液化苯酚(又称液体酚)。3%~5%的苯酚水溶液可以 消毒外科器械。 (二)甲苯酚 甲苯酚(CH,CHOH)简称甲酚,因来源于煤焦油,所以俗称煤酚。煤酚的
因而可用这个反应来检验酚的存在以及定量测定。 + 3Br2 Br + 3HBr OH Br OH Br (白) (2)硝化反应:苯酚在室温下就可被稀硝酸硝化,生成邻硝基苯酚和对硝基 苯酚的混合物。 OH + HNO3(稀) OH NO2 + OH NO2 室温 (3)磺化反应:苯酚与浓硫酸反应,生成邻羟基苯磺酸和对羟基苯磺酸。在 较低温度下(25℃)时,主要生成邻羟基苯磺酸;由于磺酸基的位阻较大,在较高 温度(100℃)时,产物主要生成对羟基苯磺酸。两种产物进一步反应,均得二磺 化产物 4-羟基-1,3-苯二磺酸。 浓H2SO4 OH OH SO3H OH SO3H 浓H2SO4 SO3H OH SO3H 25 100 ℃ ℃ 四、重要的酚 (一)苯酚 苯酚(C6H5OH)俗称石炭酸,存在于煤焦油中,具有弱酸性。纯净的苯酚是 一种有特殊气味的无色晶体,熔点 43℃,沸点 181℃。苯酚常温下稍溶于水,易 溶于乙醇、乙醚和氯仿等有机溶剂。苯酚在医药上用做消毒剂,在苯酚固体中加 入 10%的水,即是临床所用的液化苯酚(又称液体酚)。3%~5%的苯酚水溶液可以 消毒外科器械。 (二)甲苯酚 甲苯酚(CH3-C6H4-OH)简称甲酚,因来源于煤焦油,所以俗称煤酚。煤酚的

杀菌力比苯酚强,因难溶于水,易溶于肥皂溶液,故配制成47%~53%的肥皂溶 液,称为煤酚皂溶液,俗称“来苏儿”(Lyso)。 (三)苯二酚 苯二酚具有邻、间、对三种异构体,邻苯二酚又名儿茶酚:间苯二酚又名雷 琐辛:对苯二酚又名氢醒。其中邻苯二酚和对苯二酚易被氧化,故常作为还原剂 和抗氧剂。 醚 醚可看作是醇或酚羟基中的氢被烃基取代的产物,也可看作是水分子中的两 个氢原子被烃基取代后生成的化合物。 一、醚的结构 醚分子是由两个烃基通过氧原子连接而成。通式为RO-R(R')、 Ar-O-Ar(Ar')或R-O-Ar,醚的官能团称为醚键(-O-).醚的氧原子为sp杂化, C-0-C的键角约为110°,所以醚具有极性。 二、醚的分类和命名 (一)醚的分类 根据醚分子中的两个烃基,醚可以分为单醚、混醚和环醚。单醚又称为对称 醚,指连在氧原子上的两个烃基相同。混醚又称为不对称醚,指连在氧原子上的 两个烃基不同。根据分子中是否含有芳基,醚又可分为脂肪醚和芳香醚。 烃基与氧原子形成环状结构,称为环醚。但三元环醚性质比较特殊,称为环 氧化合物: (仁)酰的命名 单醚可根据烃基的名称,省略“基”字,直接称为“某醚”;混醚一般按由 小到大的顺序先命名烃基,最后加个“醚”字:命名芳香混醚时,要把芳香烃基 的名称放在脂肪烃基名称的前面。如: CHOCH; CHCHOCH-CHs 甲醚 乙醚
杀菌力比苯酚强,因难溶于水,易溶于肥皂溶液,故配制成 47%~53%的肥皂溶 液,称为煤酚皂溶液,俗称“来苏儿”(Lysol)。 (三)苯二酚 苯二酚具有邻、间、对三种异构体,邻苯二酚又名儿茶酚;间苯二酚又名雷 琐辛;对苯二酚又名氢醌。其中邻苯二酚和对苯二酚易被氧化,故常作为还原剂 和抗氧剂。 醚 醚可看作是醇或酚羟基中的氢被烃基取代的产物,也可看作是水分子中的两 个氢原子被烃基取代后生成的化合物。 一、醚的结构 醚分子是由两个烃基通过氧原子连接而成。通式为 R-O-R(R')、 Ar-O-Ar(Ar')或 R-O-Ar,醚的官能团称为醚键(-O-)。醚的氧原子为 sp3 杂化, C-O-C 的键角约为 110°,所以醚具有极性。 二、醚的分类和命名 (一) 醚的分类 根据醚分子中的两个烃基,醚可以分为单醚、混醚和环醚。单醚又称为对称 醚,指连在氧原子上的两个烃基相同。混醚又称为不对称醚,指连在氧原子上的 两个烃基不同。根据分子中是否含有芳基,醚又可分为脂肪醚和芳香醚。 烃基与氧原子形成环状结构,称为环醚。但三元环醚性质比较特殊,称为环 氧化合物。 (二) 醚的命名 单醚可根据烃基的名称,省略“基”字,直接称为“某醚”;混醚一般按由 小到大的顺序先命名烃基,最后加个“醚”字;命名芳香混醚时,要把芳香烃基 的名称放在脂肪烃基名称的前面。如: CH3OCH3 甲醚 乙醚 二苯醚 CH3CH2OCH2CH3 —O—

○-OCHs H.C○-ocH,cH, CH,CH-OCH-CHz 苯甲醚 对甲苯乙醚 乙基乙烯基醚 三、醚的性质 ((一)物理性质 大多数醚在室温下为液体,有香味,由于分子中没有与氧原子相连的氢,所 以醚分子间没有氢键,其沸点比相应的醇低,而与分子量相当的烷烃相近。低级 醚沸点低,具有高度的挥发性,极易着火,使用时要小心,注意通风。 (二)化学性质 醚较稳定,是一类不活泼的化合物(环醚除外),其稳定性稍次于烷烃。在室 温下与氧化剂、还原剂、强碱、稀酸都不反应。但醚可以发生一些特殊的反应。 1.Zaozi001盐的生成醚键上的氧原子具有未共用电子对,能与强酸中的 H离子结合形成类似盐类结构的化合物—Zaozi001盐。因此,醚溶于强酸如 HSO4、HCI等。如: H CH,0-CH+HS04(浓)→(CH0CH)寸+Hs0 Zaozi001盐是一种弱碱强酸盐,仅在浓酸中才稳定,遇水很快分解为原来 的醚。 2.醚键的断裂醚对碱比较稳定,但与浓的强酸(如氢碘酸或氢溴酸)共热, 醚键可断裂。如 H CH,-0-CH5+H(浓)→[C2HsOCHsT'T→CH,OH+CHI 混合醚键断裂时,由于小烃基的空间位阻效应小,有利于卤负离子的进攻, 因此总是趋向于形成小烃基的卤代烷:芳醚则生成卤代烃和酚。如: Ⅲ+CH-O-CH,CH,CH3→CHI+CHCH,CH,OH 四、重要的醚 (一)乙醚 乙醚(CH,CH,OCH:CHs)是常见和重要的醚,常温下为易挥发的无色液体,沸 点34.5℃。乙醚易燃易爆。乙醚微溶于水,能溶解多种有机物,其本身性质比较 稳定,常用作有机溶剂和萃取剂。无水乙醚可用于药物合成。 (仁)环氧乙烷
—OCH3 H3C— —OCH2CH3 CH3CH2OCH=CH2 苯甲醚 对甲苯乙醚 乙基乙烯基醚 三、醚的性质 (一) 物理性质 大多数醚在室温下为液体,有香味,由于分子中没有与氧原子相连的氢,所 以醚分子间没有氢键,其沸点比相应的醇低,而与分子量相当的烷烃相近。低级 醚沸点低,具有高度的挥发性,极易着火,使用时要小心,注意通风。 (二) 化学性质 醚较稳定,是一类不活泼的化合物(环醚除外),其稳定性稍次于烷烃。在室 温下与氧化剂、还原剂、强碱、稀酸都不反应。但醚可以发生一些特殊的反应。 1. Zaozi001 盐的生成 醚键上的氧原子具有未共用电子对,能与强酸中的 H +离子结合形成类似盐类结构的化合物——Zaozi001 盐。因此,醚溶于强酸如 H2SO4、HCl 等。如: C2H5—O—C2H5 + H2SO4(浓) (C2H5—O—C2H5) + + HSO4 H Zaozi001 盐是一种弱碱强酸盐,仅在浓酸中才稳定,遇水很快分解为原来 的醚。 2.醚键的断裂 醚对碱比较稳定,但与浓的强酸(如氢碘酸或氢溴酸)共热, 醚键可断裂。如: [ C2H5OH + C2H5 C I 2H5O C2H5 ] + I - H C2H5 O C2H5 + HI(浓) 混合醚键断裂时,由于小烃基的空间位阻效应小,有利于卤负离子的进攻, 因此总是趋向于形成小烃基的卤代烷;芳醚则生成卤代烃和酚。如: CH3 HI + CH3 O CH2CH2CH3 I + CH3CH2CH2OH 四、重要的醚 (一)乙醚 乙醚(CH3CH2OCH2CH3)是常见和重要的醚,常温下为易挥发的无色液体,沸 点 34.5℃。乙醚易燃易爆。乙醚微溶于水,能溶解多种有机物,其本身性质比较 稳定,常用作有机溶剂和萃取剂。无水乙醚可用于药物合成。 (二)环氧乙烷

环氧乙烷(。)是一种最简单和最重要的环醚,为无色气体,沸点1℃, 能溶于水、醇、乙醚中,环氧乙烷与空气的混合物容易爆炸,其爆炸的范围是 3.6%~78%(体积比),一般是把它压缩保存在钢瓶中。 (三)冠醚 冠醚是分子中含有多个-OCH2CH2单位的大环多醚。由于它们的形状像皇冠, 故称为冠醚。冠醚的命名比较特殊:“X-冠-Y”。X代表环上的原子总数,Y代 表氧原子数。 18-冠-6 15-冠-5 冠醚的大环结构中间留有“空穴”,由于氧原子上具有未共用电子对,故可通 过配位键与金属离子形成配合物。各种冠醚的“空穴”大小不同,可以选择性结合 不同的金属离子。利用冠醚的这一重要特点,可以分离金属离子。 冠醚还是一种相转移催化剂(PTC),将不能溶解于有机溶剂的离子型化合物 转移到有机相中进行化学反应。其原理是当冠醚与金属离子配位时,金属离子被 包围在冠醚的“空穴”中,而冠醚配合物的外层结构具有亲脂性,故形成的配合 物可以溶解于有机溶剂中,这样就将金属离子转移到有机相中,使有机物与无机 物处于同一相,从而大大加快反应速度。但是,冠醚的合成比较困难,毒性较大, 对皮肤和眼都有刺激性,应用受到某些限制
环氧乙烷( O H2C CH2 )是一种最简单和最重要的环醚,为无色气体,沸点 11℃, 能溶于水、醇、乙醚中,环氧乙烷与空气的混合物容易爆炸,其爆炸的范围是 3.6%~78%(体积比),一般是把它压缩保存在钢瓶中。 (三)冠醚 冠醚是分子中含有多个-OCH2CH2-单位的大环多醚。由于它们的形状像皇冠, 故称为冠醚。冠醚的命名比较特殊:“X-冠-Y”。X 代表环上的原子总数,Y 代 表氧原子数。 O O O O O O O O O O O O 18-冠-6 或 O O O O O 15-冠-5 冠醚的大环结构中间留有“空穴”,由于氧原子上具有未共用电子对,故可通 过配位键与金属离子形成配合物。各种冠醚的“空穴”大小不同,可以选择性结合 不同的金属离子。利用冠醚的这一重要特点,可以分离金属离子。 冠醚还是一种相转移催化剂(PTC),将不能溶解于有机溶剂的离子型化合物 转移到有机相中进行化学反应。其原理是当冠醚与金属离子配位时,金属离子被 包围在冠醚的“空穴”中,而冠醚配合物的外层结构具有亲脂性,故形成的配合 物可以溶解于有机溶剂中,这样就将金属离子转移到有机相中,使有机物与无机 物处于同一相,从而大大加快反应速度。但是,冠醚的合成比较困难,毒性较大, 对皮肤和眼都有刺激性,应用受到某些限制