
配位化合物 配位化合物的基本概念 一、配位化合物及其组成 配位化合物的存在十分广泛。绝大部分无机化合物都是以配位化合物的形式存在的。 一个元素(或同它结合的配位体)常常由于形成了配合物而改变了它们的性质。将过量的氨 水加到硫酸铜溶液中,溶液逐渐变为深蓝色,用乙醇处理后,还可以得到深蓝色的品体,经 分析证明为:[Cu(NHs).JSO4.:溶液中,几乎没有Cu2,而只有SO,2和[Cu(NH产。 (一)配位化合物的定义 1798年法国化学家塔赫特(Tassaert)观察到钴盐在氯化氨和氨水溶液中转变得到化合 物CoC1,6NH。该化合物既不是水合物也不是复盐,认为它是由两个简单化合物CoC1,和 6NH,形成的一种复杂的新型的化合物。但迷惑不解的是既然简单化合物中的原子都已满足 了各自的化合价,是什么因素促使它们之间形成新的一类化合物?塔赫特无法解释这种化 合物的本质,又觉得这种化合物比较复杂,故将其称之为“复杂化合物”。 1893年瑞士化学家维尔纳(Werner A)对这类“复杂化合物”的本质提出了见解。他认 为:在CoC6NH中,6个NH先与Co结合形成[CoNH6,再与3个CT进行结合成 [Co(NH;6JCl。 实验证明,在硫酸铜溶液中滴加氨水时,开始有浅蓝色沉淀生成,继续滴加氨水,沉淀 逐渐消失,最终生成深蓝色溶液。向该溶液中加入乙醇,析出深蓝色的结品。将该品体溶入 水中,加入少量NaOH溶液,既无浅蓝色的CuOH)2沉淀生成,也无明显的氨生成,但加 入BC2溶液却立即生成白色的BaSO,沉淀。以上事实说明,该溶液中有大量的S0,2存在, 而游离的Cu和NH的浓度较低,我们推测该溶液由[CuNH)4与SO,两种离子组成。 对晶体进行X射线分析,也证实了晶体中这两种离子的存在。反应方程式为: CuSO+4NH:.H2OICu(NH:)SO +4HO 离子反应方程式为: Cu2+4NH≠[Cu(NHs)4]2 分析CuNH)4的结构可知,每个NH3分子中的N原子均提供一对弧电子对,进入 C2外层的空轨道,形成4个配位键,故称配位化合物。像[CuNH这样由一个金属阳 离子(或原子)和一定数目的中性分子或阴离子按一定的空间结构以配位键结合而形成的复 杂离子称为配位离子(Coordinatorion,)简称配离子,如[CuNH、[Ag(NH)矿等。 配离子和其他反电荷离子所组成的化合物称为配位化合物,简称配合物。如氯化二氨合 银[AgNH]CI、六氰合铁()酸钾KsFe(CN)M。配合物也可以由金属离子与一定数目
配位化合物 配位化合物的基本概念 一、配位化合物及其组成 配位化合物的存在十分广泛。绝大部分无机化合物都是以配位化合物的形式存在的。 一个元素(或同它结合的配位体)常常由于形成了配合物而改变了它们的性质。将过量的氨 水加到硫酸铜溶液中,溶液逐渐变为深蓝色,用乙醇处理后,还可以得到深蓝色的晶体,经 分析证明为:[Cu(NH3)4]SO4。溶液中,几乎没有 Cu2+,而只有 SO4 2-和[Cu(NH3)4] 2+。 (一)配位化合物的定义 1798 年法国化学家塔赫特(Tassaert)观察到钴盐在氯化氨和氨水溶液中转变得到化合 物 CoCl3·6NH3。该化合物既不是水合物也不是复盐,认为它是由两个简单化合物 CoCl3 和 6NH3 形成的一种复杂的新型的化合物。但迷惑不解的是既然简单化合物中的原子都已满足 了各自的化合价, 是什么因素促使它们之间形成新的一类化合物? 塔赫特无法解释这种化 合物的本质,又觉得这种化合物比较复杂,故将其称之为“复杂化合物” 。 1893 年瑞士化学家维尔纳(Werner A)对这类“复杂化合物”的本质提出了见解。他认 为:在 CoCl3·6NH3中,6 个 NH3先与 Co3+结合形成[Co(NH3)6] 3+,再与 3 个 Cl-进行结合成 [Co(NH3)6]Cl3。 实验证明,在硫酸铜溶液中滴加氨水时,开始有浅蓝色沉淀生成,继续滴加氨水,沉淀 逐渐消失,最终生成深蓝色溶液。向该溶液中加入乙醇,析出深蓝色的结晶。将该晶体溶入 水中,加入少量 NaOH 溶液,既无浅蓝色的 Cu(OH)2 沉淀生成,也无明显的氨生成,但加 入 BaCl2 溶液却立即生成白色的 BaSO4 沉淀。以上事实说明,该溶液中有大量的 SO4 2-存在, 而游离的 Cu2+和 NH3 的浓度较低,我们推测该溶液由[Cu(NH3)4] 2+与 SO4 2-两种离子组成。 对晶体进行 X 射线分析,也证实了晶体中这两种离子的存在。反应方程式为: CuSO4 + 4NH3·H2O [Cu(NH3)4]SO4+4H2O 离子反应方程式为: Cu2+ + 4NH3 [Cu(NH3)4] 2+ 分析[Cu(NH3)4] 2+的结构可知,每个 NH3 分子中的 N 原子均提供一对弧电子对,进入 Cu2+外层的空轨道,形成 4 个配位键,故称配位化合物。像[Cu(NH3)4] 2+这样由一个金属阳 离子(或原子)和一定数目的中性分子或阴离子按一定的空间结构以配位键结合而形成的复 杂离子称为配位离子(Coordinator ion),简称配离子,如[Cu(NH3)4] 2+、[Ag (NH3)2] +等。 配离子和其他反电荷离子所组成的化合物称为配位化合物,简称配合物。如氯化二氨合 银[Ag (NH3)2]Cl、六氰合铁(III)酸钾 K3[ Fe (CN )6]。配合物也可以由金属离子与一定数目

的中性分子或阴离子以配位键结合而成,如二氯二氨合铂(I)P((NHhC小、三氯二氨 合钴(Ⅲ)[Co((NH,hCl]。还可以是由金属原子和中性分子直接组成,如五羰基合铁[Fe (COsl。 综合以上几种类型,我们把由一个金属阳离子(或原子)与一定数目的中性分子或阴离 子按一定的空间结构以配位键结合而成的复杂离子(或分子)叫做配位单元。含有配位单元 的化合物统称配合物。 配位化合物与复盐的区别:KHgL和KA1(SOh12H0两化合物分子式相似,但前者 是配合物,后者是复盐。原因在于在K,Hg虬分子中,中心离子Hg2先与周围4个r结合形 成gL广配离子后,再以离子键与2个K结合成KHg小,因此它是配合物,在溶液中解 离时主要得到配离子HgL和简单离子K;而在KA(S0212H,0中,K、A和SO 分别以离子键结合,没有配位键,在溶液中解离时主要得到K、A和SO,等简单离子, 因此它是复盐而不是配合物。 (二)配位化合物的组成 配位化合物通常由内界和外界两部分组成。配合物中配位体和中心原子(或离子)通过 配位键结合,作为配合物的特征部分(在配合物化学式中写在方括号内),称为配合物的内 界。内界可以是配阳离子、也可以是配阴离子、还可以是中性分子。与配离子带有异种电荷 的方括号外的那部分称为外界。外界是简单离子。如CuNH)4SO,中内界是CuNH)4, 外界是S0,2。 [Cu(NH,)'SO. 内界 外界 配合物 但是也有如P1NHCl小,这种只有内界,没有外界的电中性分子称为配位分子。 配合物的内界和外界之间是以离子健相结合,所以在水溶液中配合物的内界和外界是可以完 全解离的。例如: [Cu(NH3)4]SO=[Cu(NH3)4]+SO 1.中心离子(原子) 中心离子是配合物的核心部分,又称配合物的形成体。常见的形成体主要有:①金属
的中性分子或阴离子以配位键结合而成,如二氯二氨合铂(II)[Pt ((NH3 )2 Cl2]、三氯二氨 合钴(III)[ Co ((NH3 )2 Cl3]。还可以是由金属原子和中性分子直接组成,如五羰基合铁[ Fe (CO)5]。 综合以上几种类型,我们把由一个金属阳离子(或原子)与一定数目的中性分子或阴离 子按一定的空间结构以配位键结合而成的复杂离子(或分子)叫做配位单元。含有配位单元 的化合物统称配合物。 配位化合物与复盐的区别:K2HgI4 和 KAl(SO4)2·12H2O 两化合物分子式相似,但前者 是配合物,后者是复盐。原因在于在 K2HgI4 分子中,中心离子 Hg2+先与周围 4 个 I -结合形 成[HgI4] 2-配离子后,再以离子键与 2 个 K +结合成 K2[HgI4],因此它是配合物,在溶液中解 离时主要得到配离子 [HgI4] 2-和简单离子 K +;而在 KAl(SO4)2·12H2O 中,K +、Al3+和 SO4 2- 分别以离子键结合,没有配位键,在溶液中解离时主要得到 K +、Al3+和 SO4 2-等简单离子, 因此它是复盐而不是配合物。 (二)配位化合物的组成 配位化合物通常由内界和外界两部分组成。配合物中配位体和中心原子(或离子)通过 配位键结合,作为配合物的特征部分(在配合物化学式中写在方括号内),称为配合物的内 界。内界可以是配阳离子、也可以是配阴离子、还可以是中性分子。与配离子带有异种电荷 的方括号外的那部分称为外界。外界是简单离子。如[Cu(NH3)4]SO4 中内界是[Cu(NH3)4] 2+, 外界是 SO4 2。 但是也有如[Pt(NH3)2Cl4],这种只有内界,没有外界的电中性分子称为配位分子。 配合物的内界和外界之间是以离子键相结合,所以在水溶液中配合物的内界和外界是可以完 全解离的。例如: [Cu(NH3)4]SO4 [Cu(NH3)4] 2+ + SO4 2 1.中心离子(原子) 中心离子是配合物的核心部分,又称配合物的形成体。常见的形成体主要有:金属

离子(主要包括过渡金属离子),如CuNH4]SO,中的Cu2':②中性原子,如Ni(CO4,FeCO5 中的Ni,Fe:③少数高氧化态的非金属元素,如BFJ、PF打、SiF中的B(Ⅲ)、P(V)、 Si(V)等。 2配位体、配位原子和配位数 (1)配位体在配合物中与中心离子结合的阴离子或中性分子,称为配位体,简称配 体。通常配体能提供:①孤对电子,如[CuNH)4中的NH:②能够提供I键电子的配体, 如有机分子CH4,乙二胺等。 (2)配位原子配体中直接同中心离子结合成键的原子称为配位原子。常见的配位原 子有N,C,O,S,F,C,Br,I等,如NH分子中的N原子:如果在一个配体中有两个 原子都有孤对电子,则其中电负性较小的为配位原子,如:C=N:中的C是配位原子。 分类:按含有配位原子数目的不同可以分为单齿配体或多齿配体。 单齿配体:只含有一个配位原子的配体,如X、NH、CO、CN等 多齿配体:含有两个或两个以上配位原子的配体。如CzO,2(草酸根)、HN-CH-CHNH (乙二胺,缩写为e),它们都含两个配位原子,为二齿配位体:乙二胺四乙酸(缩写为 EDTA),含六个配位原子,为六齿配位体, (3)配位数配位单元中,配位数是直接与中心离子(或原子)成键的配位原子个数。 例如,[CNH)户中,6个N原子与C形成配位键,配位数是6:含单齿配体的配合物, 其配位数与配体数相同。含多齿配体的配合物,配位数与配体数不同。 二、配位化合物的分类 配位化合物在自然界中广泛存在,种类繁多,主要可分为以下两大类: (一)简单配合物 由单齿配体与中心原子直接配位形成的配合物称为简单配合物。其配位体大多数是简单 的无机分子或离子,这类配合物分子中没有环状结构,但通常配位体数目较多。根据配位体 种类的多少,又可将配合物分为单纯配位体配合物和混合配位体配合物,例如, [Cu(NHj)]SO4、[Co(NHs)sH2O]CL:等。 (二)螯合物 多齿配位体中的多个配位原子同时和中心离子键合时,可形成具有环状结构的配合物, 这类具有环状结构的配合物称为整合物。多齿配体称为螯合剂,它与中心离子的健合也称为 整合。理论和实践都证明五原子环和六原子环最稳定。整合物与简单配合物的不同之处是具 有特殊的稳定性。例如,【Cu(enh是具有两个五元环的整合物,结构式为:
离子(主要包括过渡金属离子),如[Cu(NH3)4]SO4中的 Cu2+ ;中性原子,如 Ni(CO)4,Fe(CO)5 中的 Ni,Fe;少数高氧化态的非金属元素,如[BF4] -、[PF4] -、[SiF4] -中的 B(Ⅲ)、P(Ⅴ)、 Si(Ⅳ)等。 2.配位体、配位原子和配位数 (1)配位体 在配合物中与中心离子结合的阴离子或中性分子,称为配位体,简称配 体。通常配体能提供:孤对电子,如[Cu(NH3)4] 2+中的 NH3;能够提供π键电子的配体, 如有机分子 C2H4,乙二胺等。 (2)配位原子 配体中直接同中心离子结合成键的原子称为配位原子。常见的配位原 子有 N,C,O,S,F,Cl,Br,I 等,如 NH3 分子中的 N 原子;如果在一个配体中有两个 原子都有孤对电子,则其中电负性较小的为配位原子,如:C=N:中的 C 是配位原子。 分类:按含有配位原子数目的不同可以分为单齿配体或多齿配体。 单齿配体:只含有一个配位原子的配体,如 X -、NH3、CO、CN-等; 多齿配体:含有两个或两个以上配位原子的配体。如 C2O4 2(草酸根)、 - H2N-CH2-CH2-NH2 (乙二胺,缩写为 en),它们都含两个配位原子,为二齿配位体;乙二胺四乙酸(缩写为 EDTA),含六个配位原子,为六齿配位体。 (3)配位数 配位单元中,配位数是直接与中心离子(或原子)成键的配位原子个数。 例如,[Cr(NH3)6] 3+中,6 个 N 原子与 Cr3+形成配位键,配位数是 6;含单齿配体的配合物, 其配位数与配体数相同。含多齿配体的配合物,配位数与配体数不同。 二、配位化合物的分类 配位化合物在自然界中广泛存在,种类繁多,主要可分为以下两大类: (一)简单配合物 由单齿配体与中心原子直接配位形成的配合物称为简单配合物。其配位体大多数是简单 的无机分子或离子,这类配合物分子中没有环状结构,但通常配位体数目较多。根据配位体 种类的多少,又可将配合物分为单纯配位体配合物和混合配位体配合物,例如 , [Cu(NH3)4]SO4、[Co(NH3)5H2O]Cl3 ;等。 (二)螯合物 多齿配位体中的多个配位原子同时和中心离子键合时,可形成具有环状结构的配合物, 这类具有环状结构的配合物称为螯合物。多齿配体称为螯合剂,它与中心离子的键合也称为 螯合。理论和实践都证明五原子环和六原子环最稳定。鳌合物与简单配合物的不同之处是具 有特殊的稳定性。例如,[Cu(en)2] 2+是具有两个五元环的螯合物,结构式为:

NH2 NH2 CH2 CH NH2 整合物与普通配合物的不同之处是配位体不同,形成整合的条件是: 1.整合物的形成体必须有空轨道,能接受配位原子提供的孤对电子对。 2.整合剂必须含有2个或2个以上能给出孤对电子的配位原子,以便与形成体配合成环 状结构。 3.每两个配位原子之间最好间隔2个或3个其它原子,以便形成稳定的五元环或六元环。 这种由于整合物的生成使配合物的稳定性显著增加的作用称为整合效应。这种特殊的稳 定性是由于合物具有环状结构而产生的,整合物中的鳌合环数目越多,形成的配位键越多, 整合物越难离解,稳定性越好。常见的整合剂除乙二胺外,还有乙二胺四乙酸、氨基乙酸等。 三、配位化合物的命名 配合物的命名与一般无机化合物的命名原则相同:即阴离子名称在前,阳离子名称在 后。 1.配离子的命名 配离子的命名方法一般按照如下顺序: 配位体数(中文数字表示)一配位体名称一“合”一形成体的名称一形成体的氧化数(罗 马数字表示)。 例如:Cu(NHs)J 四氨合铜(IⅡ)配离子 [Co(NH)H2O] 五氨·一水合钻()配离子 Fc(CN6子 六氰合铁(I1I)配离子 [Cu(en) 二(乙二胺)合铜(II)配离子 配离子命名规则: (1)配体的数目用中文数字一、二、三等表示。 (2)若存在多种配体时,复杂配体的名称写圆括号中,不同配体名称间用·分开。 (3)配体的次序是,先有机配体,后无机配体:先阴离子配体,后中性分子配体:同 类配体按配位原子的元素符号的英文字母顺序排列。 (4)中心原子的氧化数常用罗马数字写在该原子后的括号中。 2.含配离子配位化合物的命名 在命名带正电荷的配离子的盐或氢氧化物时,把配离子当作简单金属离子
螯合物与普通配合物的不同之处是配位体不同,形成螯合的条件是: 1.螯合物的形成体必须有空轨道,能接受配位原子提供的孤对电子对。 2.螯合剂必须含有 2 个或 2 个以上能给出孤对电子的配位原子,以便与形成体配合成环 状结构。 3.每两个配位原子之间最好间隔2个或3个其它原子,以便形成稳定的五元环或六元环。 这种由于鳌合物的生成使配合物的稳定性显著增加的作用称为螯合效应。这种特殊的稳 定性是由于鳌合物具有环状结构而产生的,鳌合物中的鳌合环数目越多,形成的配位键越多, 鳌合物越难离解,稳定性越好。常见的鳌合剂除乙二胺外,还有乙二胺四乙酸、氨基乙酸等。 三、配位化合物的命名 配合物的命名与一般无机化合物的命名原则相同:即阴离子名称在前,阳离子名称在 后。 1.配离子的命名 配离子的命名方法一般按照如下顺序: 配位体数(中文数字表示)→配位体名称→“合”→形成体的名称→形成体的氧化数(罗 马数字表示)。 例如: [Cu(NH3)4] 2+ 四氨合铜(II)配离子 [Co(NH3)5H2O]3+ 五氨·一水合钴(Ⅲ)配离子 [Fe(CN)6] 3- 六氰合铁(III)配离子 [Cu(en)2] 2+ 二(乙二胺)合铜(II)配离子 配离子命名规则: (1)配体的数目用中文数字一、二、三等表示。 (2)若存在多种配体时,复杂配体的名称写圆括号中,不同配体名称间用·分开。 (3)配体的次序是,先有机配体,后无机配体;先阴离子配体,后中性分子配体;同 类配体按配位原子的元素符号的英文字母顺序排列。 (4)中心原子的氧化数常用罗马数字写在该原子后的括号中。 2.含配离子配位化合物的命名 在命名带正电荷的配离子的盐或氢氧化物时,把配离子当作简单金属离子。 Cu 2+ H2C H2C CH2 CH2 NH2 NH2 NH2 NH2

[Co(NH3)]Cls 三氯化六氨合钴(Ⅲ) [AgNH2]OH氢氧化二氨合银(I) 在命名带负电荷的配离子的盐或质子酸时,把配离子当作含氧酸根。 K.[Fe(CN)6] 六氟合铁(Ⅱ)酸钾 H2[PtCl6] 六氯合铂(W)酸 [Co(NH).H,O]C3三氯化五氨·一水合钻() 对于由正、负配离子组成的盐,可根据前两个原则命名。 [Cu(NH)][PtCl] 四氯合铂(Ⅱ)酸四氨合铜(Ⅱ) 3.没有外界的配合物命名 没有外界的配合物的命名与配离子的命名规则相似,但中心原子的氧化数可不必标 明,后面也不要写配阳离子或配阴离子。 例如:Ni(COA]四羰基合镍 PtCL4NHh]四氯·二氨合铂 配位平衡 一、配位平衡常数 1.不稳定常数 配离子在水溶液中发生解离,其解离反应达到平衡时,解离方程的平衡常数称为配离了 的不稳定常数(K)或解离常数(K)。 CuNH)42±Cu+4NH KFCu2 NHsJ'/[Cu(NHz2门 配离子的不稳定常数越大,表明达平衡时配离子解离趋势越大,在水溶液中越不稳定。 2稳定常数 在一定温度下,中心离子与配体形成配离子,当正、逆反应速率相等时,体系达到平衡 状态,这种平衡称为配位平衡。配位平衡的平衡常数称为配位平衡常数,也称稳定常数,用 符号K(或Ks)表示。如: Cu2+4NH;=Cu(NH3) K=[Cu(NHs)"J/[Cu"][NH]
[Co(NH3)6]Cl3 三氯化六氨合钴(Ⅲ) [Ag(NH3)2]OH 氢氧化二氨合银(Ι) 在命名带负电荷的配离子的盐或质子酸时,把配离子当作含氧酸根。 K4[Fe(CN)6] 六氰合铁(Ⅱ)酸钾 H2[PtCl6] 六氯合铂(Ⅳ)酸 [Co(NH3)5H2O]Cl3 三氯化五氨·一水合钴(Ⅲ) 对于由正、负配离子组成的盐,可根据前两个原则命名。 [Cu(NH3)4][PtCl4] 四氯合铂(Ⅱ)酸四氨合铜(Ⅱ) 3.没有外界的配合物命名 没有外界的配合物的命名与配离子的命名规则相似,但中心原子的氧化数可不必标 明,后面也不要写配阳离子或配阴离子。 例如: [Ni(CO)4] 四羰基合镍 [PtCl4(NH3)2] 四氯·二氨合铂 配位平衡 一、配位平衡常数 1.不稳定常数 配离子在水溶液中发生解离,其解离反应达到平衡时,解离方程的平衡常数称为配离子 的不稳定常数(K 不稳)或解离常数(Kd)。 Cu(NH3)4 2+ Cu2++4NH3 Kd=[Cu2+]·[NH3] 4 /[Cu(NH3)4 2+] 配离子的不稳定常数越大,表明达平衡时配离子解离趋势越大,在水溶液中越不稳定。 2.稳定常数 在一定温度下,中心离子与配体形成配离子,当正、逆反应速率相等时,体系达到平衡 状态,这种平衡称为配位平衡。配位平衡的平衡常数称为配位平衡常数,也称稳定常数,用 符号 K 稳(或 Ks)表示。如: Cu2++4NH3 Cu(NH3)4 2+ Ks=[Cu(NH3)4 2+]/[Cu2+]·[NH3] 4 Ks=1/Kd
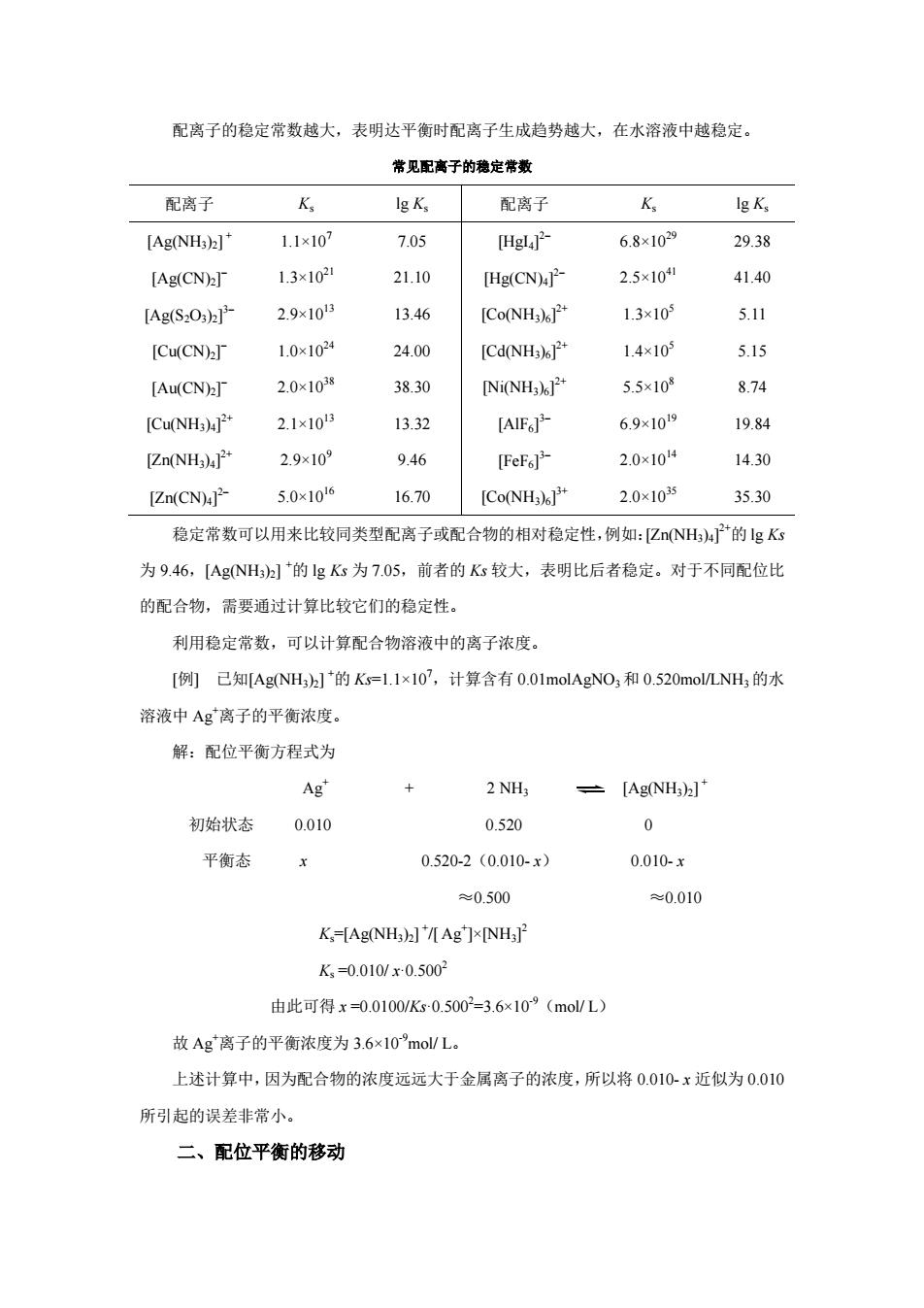
配离子的稳定常数越大,表明达平衡时配离子生成趋势越大,在水溶液中越稳定。 常见配离子的稳定常数 配离子 K Ig K, 配离子 K [Ag(NHs)2] 1.1x10 7.05 [Hgl 6.8×1029 29.38 [Ag(CN) 1.3×102 21.10 [Hg(CN) 2.5×10 41.40 [AgS,Osh产 2.9×10 13.46 [Co(NH) 1.3×10 511 [Cu(CN)] 1.0x1024 24.00 [Cd(NH) 14×103 5.15 [Au(CN)2T 2.0×1028 3830 [Ni(NH)P 5.5×10 8.74 [Cu(NH )4 2.1×1015 13.32 [AIF] 6.9×109 19.84 [Zn(NH)P* 2.9x10 9.46 [FeF] 2.0x104 14.30 [Zn(CN)- 5.0x1016 16.70 Co(NH3 2.0×1035 35.30 稳定常数可以用来比较同类型配离子或配合物的相对稳定性,例如:亿NH的gKs 为9.46,[Ag(NHah]的gK为7.05,前者的K较大,表明比后者稳定。对于不同配位比 的配合物,需要通过计算比较它们的稳定性。 利用稳定常数,可以计算配合物溶液中的离子浓度。 [例己知[Ag(NH)]2*的K=1.1x107,计算含有0.01 molAgNO3和0.520 mol/LNH,的水 溶液中Ag离子的平衡浓度, 解:配位平衡方程式为 Ag' 2 NH3 =[Ag(NH3)]* 初始状态 0010 0520 0 平衡态 0.520-2(0.010-x 0.010-x ≈0.500 ≈0.010 K,-Ag(NH)]'[Ag]×NH K,=0.010/x0.5002 由此可得x=0.0100/K-0.5002=3.6×10(mol/L) 故Ag离子的平衡浓度为3.6×10”molL。 上述计算中,因为配合物的浓度远远大于金属离子的浓度,所以将0.010.x近似为0.010 所引起的误差非常小。 二、配位平衡的移动
配离子的稳定常数越大,表明达平衡时配离子生成趋势越大,在水溶液中越稳定。 常见配离子的稳定常数 配离子 Ks lg Ks 配离子 Ks lg Ks [Ag(NH3)2] + 1.1×107 7.05 [HgI4] 2 6.8×1029 29.38 [Ag(CN)2] 1.3×1021 21.10 [Hg(CN)4] 2 2.5×1041 41.40 [Ag(S2O3)2] 3 2.9×1013 13.46 [Co(NH3)6] 2+ 1.3×105 5.11 [Cu(CN)2] 1.0×1024 24.00 [Cd(NH3)6] 2+ 1.4×105 5.15 [Au(CN)2] 2.0×1038 38.30 [Ni(NH3)6] 2+ 5.5×108 8.74 [Cu(NH3)4] 2+ 2.1×1013 13.32 [AlF6] 3 6.9×1019 19.84 [Zn(NH3)4] 2+ 2.9×109 9.46 [FeF6] 3 2.0×1014 14.30 [Zn(CN)4] 2 5.0×1016 16.70 [Co(NH3)6] 3+ 2.0×1035 35.30 稳定常数可以用来比较同类型配离子或配合物的相对稳定性,例如:[Zn(NH3)4] 2+的 lg Ks 为 9.46,[Ag(NH3)2] +的 lg Ks 为 7.05,前者的 Ks 较大,表明比后者稳定。对于不同配位比 的配合物,需要通过计算比较它们的稳定性。 利用稳定常数,可以计算配合物溶液中的离子浓度。 [例] 已知[Ag(NH3)2] +的 Ks=1.1×107,计算含有 0.01molAgNO3和 0.520mol/LNH3 的水 溶液中 Ag+离子的平衡浓度。 解:配位平衡方程式为 Ag+ + 2 NH3 [Ag(NH3)2] + 初始状态 0.010 0.520 0 平衡态 x 0.520-2(0.010- x) 0.010- x ≈0.500 ≈0.010 Ks=[Ag(NH3)2] + /[ Ag+ ]×[NH3] 2 Ks =0.010/ x·0.5002 由此可得 x =0.0100/Ks·0.5002 =3.6×10-9(mol/ L) 故 Ag+离子的平衡浓度为 3.6×10-9mol/ L。 上述计算中,因为配合物的浓度远远大于金属离子的浓度,所以将 0.010- x 近似为 0.010 所引起的误差非常小。 二、配位平衡的移动

配位平衡是一种有条件的动态平衡,如果改变平衡体系的条件,平衡就会发生移动,例 如溶液的pH、沉淀试剂、配体的浓度、氧化还原反应等都会对配位平衡产生影响。 1溶液pH值的影响 由于很多的配体本身是弱碱,当溶液的酸碱度发生改变时会导致平衡移动。当溶液p山 值降低,配体会与H结合,使得配位平衡向配离子解离方向移动,这种因溶液的酸度增大 而导致配离子解离的现象称为酸效应。由于配高子的中心原子多数为过渡金属离子,在水溶 液中易发生水解。当溶液PH值升高时,则中心原子水解,导致配位平衡向配离子方向移动, 这种现象称为水解效应。 2.沉淀试剂的影响 当溶液中同时存在配体和沉淀剂时,金属离子既能与配体发生配位反应,也会与沉淀剂 发生沉淀反应,究竞以哪种反应为主,则取决于两方面因素。一是配离子的稳定性(K), 二是难溶物的溶度积(K)。如果配离子的稳定性越高,难溶物的溶度积越大,则平衡向配 位方向移动,生成配离子:反之,配离子的稳定性越低,难溶物的溶度积越小,则平衡向生 成沉淀的方向进行。 例如:当向含有氯化银沉淀的溶液中加入浓氨水时,沉淀即溶解, AgCI (s)Cr+Ag 2NH [Ag(NH)2J 在上述溶液中加入溴化钠溶液时,又有淡黄色的沉淀生成。 [Ag(NH3)]=2NH+Ag Br ≠AgBr 前者因加入配位剂NH,而使沉淀平衡转化为配位平衡,后者因加入较强的沉淀剂而使 配位平衡转化沉淀平衡。决定上述反应方向的是K和K,相对大小及配位剂、沉淀剂的浓 度。配合物的K值越大,越易形成相应配合物,沉淀越易溶解;反之,沉淀物的Kp越小 则配合物越易解离转变成相应的沉淀 3氧化还原反应的影响 在配合物溶液中加入某些氧化、还原剂,可与配合物中的中心离子或配位体反应,导致 配位平衡移动
配位平衡是一种有条件的动态平衡,如果改变平衡体系的条件,平衡就会发生移动,例 如溶液的 pH、沉淀试剂、配体的浓度、氧化还原反应等都会对配位平衡产生影响。 1.溶液 pH 值的影响 由于很多的配体本身是弱碱,当溶液的酸碱度发生改变时会导致平衡移动。当溶液 pH 值降低,配体会与 H +结合,使得配位平衡向配离子解离方向移动,这种因溶液的酸度增大 而导致配离子解离的现象称为酸效应。由于配离子的中心原子多数为过渡金属离子,在水溶 液中易发生水解。当溶液 PH 值升高时,则中心原子水解,导致配位平衡向配离子方向移动, 这种现象称为水解效应。 2.沉淀试剂的影响 当溶液中同时存在配体和沉淀剂时,金属离子既能与配体发生配位反应,也会与沉淀剂 发生沉淀反应,究竟以哪种反应为主,则取决于两方面因素。一是配离子的稳定性(K 稳), 二是难溶物的溶度积(Ksp)。如果配离子的稳定性越高,难溶物的溶度积越大,则平衡向配 位方向移动,生成配离子;反之,配离子的稳定性越低,难溶物的溶度积越小,则平衡向生 成沉淀的方向进行。 例如:当向含有氯化银沉淀的溶液中加入浓氨水时,沉淀即溶解。 在上述溶液中加入溴化钠溶液时,又有淡黄色的沉淀生成。 前者因加入配位剂 NH3 而使沉淀平衡转化为配位平衡,后者因加入较强的沉淀剂而使 配位平衡转化沉淀平衡。决定上述反应方向的是 K 稳和 Ksp相对大小及配位剂、沉淀剂的浓 度。配合物的 K 稳值越大,越易形成相应配合物,沉淀越易溶解;反之,沉淀物的 Ksp 越小, 则配合物越易解离转变成相应的沉淀。 3.氧化还原反应的影响 在配合物溶液中加入某些氧化、还原剂,可与配合物中的中心离子或配位体反应,导致 配位平衡移动。 AgCl(s) Cl + Ag+ + 2NH3 [Ag(NH3)2] + [Ag(NH3)2] + 2NH3 + Ag+ + Br AgBr↓

例如:向Fe(NSC)溶液中加入SnCl2溶液,则血红色褪去。 2[Fe(NSC)]*+Sn2-2Fe2*+Sn*+2SCN 这是氧化还原平衡对配位平衡的影响。反之,配位平衡也可影响到氧化还原平衡。 4.配位平衡的相互转化 当溶液中存在多种能与金属离子配位的配位离子时,会发生配位平衡间的相互转化,通 常平衡会向生成更稳定的配离子方向移动。对于类型相同的配离子,二者稳定常数相差越大, 则转化越完全。 第三节配位化合物在医药学中的应用 一、配位化合物对人体生命活动的重要意义 生物体中几乎所有的金属都是以配合物的形式存在的,现在已经证实对人体有特殊生理 功能的微量元素Mn,Fe,Mo,Zn,Mg,Cu,Sn,Se等都均以配合物的形式存在于人体中, 并且具有特殊的生理功能。例如F心,Cu是许多酶和蛋白质的关键成分。 高等动物(例如牛、羊、猪等)的肉色之所以鲜红,这是因为肉中含有血红素。血红素 是下©“的配合物,是存在于高等动物血液和肌肉中的红色色素,是影响肉制品颜色的主要色 素,人们往往首先通过观察肉色来判断肉质的好坏。在活的动物机体中,它是呼吸过程中氧 气和二氧化碳的载体血红蛋白的辅基。 二、配位化合物在医药学上的应用 临床上使用的药物中,有很多是对金属离子有强鳌合作用的,这些药物常常会通过与体 内的金属离子结合而发挥生物效应。例如芦丁铜络合物对癌细胞的杀伤作用强于芦丁,黄芩 苷铝的抗炎的作用强于黄芩苷。水杨酸和乙酰水杨酸作为治疗关节炎的药物,最大的副作用 是刺激骨部引起溃疡,而他们的铜的配合物不但抗炎作用更优,而且不引起胃溃疡的副作用。 1969年发现的临床上第一种用于抗癌的药物顺铂cis-P(NHhC,在40多年后的今天仍然在 临床上广泛适用,而且目前有超过28种铂类抗癌药物用于临床。 当人们吸入超剂量的金属元素,就会导致患病,可以利用配合物的原理使得过量的金属 离子螯合物排除体外,例如汞中毒的病人,给予适量的乙二胺四乙酸(EDTA)整合剂能够 使汞离子形成螯合物而排出体外,从而得到治疗。例如解毒剂是2,3二巯基丙醇,该类化 合物可以用来治疗路易斯试剂引起的砷中毒,路易斯试剂具有很强的疏基亲和力,可以与硫 醇合成五元环,将其结合的机体内功能统基重新释放出来,从而起到解毒作用。二巯基丁二 酸能通过血脑屏障将甲基汞离子从脑中除去:D青霉胺、金精三羧酸在机体内可分别结合 钙离子、钡离子,形成水溶液配合物而排除体外。2,3二巯基丙醇可将汞、金、镉、铅
例如:向[Fe(NSC)]2+溶液中加入 SnCl2 溶液,则血红色褪去。 2[Fe(NSC)]2+ +Sn2+ 2Fe2+ + Sn4+ + 2SCN- 这是氧化还原平衡对配位平衡的影响。反之,配位平衡也可影响到氧化还原平衡。 4.配位平衡的相互转化 当溶液中存在多种能与金属离子配位的配位离子时,会发生配位平衡间的相互转化,通 常平衡会向生成更稳定的配离子方向移动。对于类型相同的配离子,二者稳定常数相差越大, 则转化越完全。 第三节 配位化合物在医药学中的应用 一、配位化合物对人体生命活动的重要意义 生物体中几乎所有的金属都是以配合物的形式存在的,现在已经证实对人体有特殊生理 功能的微量元素 Mn,Fe,Mo,Zn,Mg,Cu,Sn,Se 等都均以配合物的形式存在于人体中, 并且具有特殊的生理功能。例如 Fe,Cu 是许多酶和蛋白质的关键成分。 高等动物(例如牛、羊、猪等)的肉色之所以鲜红,这是因为肉中含有血红素。血红素 是 Fe2+的配合物,是存在于高等动物血液和肌肉中的红色色素,是影响肉制品颜色的主要色 素,人们往往首先通过观察肉色来判断肉质的好坏。在活的动物机体中,它是呼吸过程中氧 气和二氧化碳的载体血红蛋白的辅基。 二、配位化合物在医药学上的应用 临床上使用的药物中,有很多是对金属离子有强螯合作用的,这些药物常常会通过与体 内的金属离子结合而发挥生物效应。例如芦丁铜络合物对癌细胞的杀伤作用强于芦丁,黄芩 苷铝的抗炎的作用强于黄芩苷。水杨酸和乙酰水杨酸作为治疗关节炎的药物,最大的副作用 是刺激胃部引起溃疡,而他们的铜的配合物不但抗炎作用更优,而且不引起胃溃疡的副作用。 1969 年发现的临床上第一种用于抗癌的药物顺铂 cis-Pt(NH3)2Cl2,在 40 多年后的今天仍然在 临床上广泛适用,而且目前有超过 28 种铂类抗癌药物用于临床。 当人们吸入超剂量的金属元素,就会导致患病,可以利用配合物的原理使得过量的金属 离子螯合物排除体外,例如汞中毒的病人,给予适量的乙二胺四乙酸(EDTA)螯合剂能够 使汞离子形成螯合物而排出体外,从而得到治疗。例如解毒剂是 2,3-二巯基丙醇,该类化 合物可以用来治疗路易斯试剂引起的砷中毒,路易斯试剂具有很强的巯基亲和力,可以与硫 醇合成五元环,将其结合的机体内功能巯基重新释放出来,从而起到解毒作用。二巯基丁二 酸能通过血脑屏障将甲基汞离子从脑中除去;D-青霉胺、金精三羧酸在机体内可分别结合 钙离子、钡离子,形成水溶液配合物而排除体外。2,3-二巯基丙醇可将汞、金、镉、铅

砷等离子从机体内排出。EDTA在机体内可排除钙、铅、铜、铝离子。 从前面的介绍可以看出,配合物在药物类中的应用众多,同时在诊断类药物中配位化合 物也起到了不可替代的作用。例如在核磁共振成像造影技术中所使用的造影剂钆的配合物和 锝的放射性同位素mTc的化合物等都是金属配合物。同时在临床检验中,利用配合物反应 生成具有某种特殊颜色的配离子,根据不同颜色的深浅可进行定性和定量分析。例如检验人 体是否为有机汞农药中毒,可取检验尿液经酸化后,加入二苯氨基脲醇清液,若出现紫色或 蓝紫色配合物,即可证明有汞离子存在
砷等离子从机体内排出。EDTA 在机体内可排除钙、铅、铜、铝离子。 从前面的介绍可以看出,配合物在药物类中的应用众多,同时在诊断类药物中配位化合 物也起到了不可替代的作用。例如在核磁共振成像造影技术中所使用的造影剂钆的配合物和 锝的放射性同位素 99mTc 的化合物等都是金属配合物。同时在临床检验中,利用配合物反应 生成具有某种特殊颜色的配离子,根据不同颜色的深浅可进行定性和定量分析。例如检验人 体是否为有机汞农药中毒,可取检验尿液经酸化后,加入二苯氨基脲醇清液,若出现紫色或 蓝紫色配合物,即可证明有汞离子存在