
羧酸 烃分子中的氢原子被羧基(一COOH)取代而形成的化合物称为羧酸,其通式 为RCOOH(甲酸为HCOOH),羧基是羧酸的官能团。 羧酸分子中烃基上的氢原子被其他原子或基团取代而形成的化合物称为取 代羧酸。常见的取代羧酸有卤代酸、羟基酸、羰基酸和氨基酸等。本章主要讨论 羟基酸和羰基酸。 羧酸和取代羧酸广泛存在于中草药或其他动植物中。它们与医药关系十分密 切,在有机合成、生物代谢及药物中起着十分重要的作用。 一、羧酸的结构 羧酸的官能团是羧基(一COOH),它是由羰基和羟基相连而成的。现代物理 方法测定证明,甲酸分子中碳氧双键的键长为123pm,比普通羰基的碳氧双键 键长120pm要长,而羧基中的碳氧单键键长为136pm,比醇中相应的碳氧单 键键长143pm又短得多,这说明羧基中羰基与羟基间存在着相互作用。 杂化轨道理论认为,羧酸分子中羧基的碳原子是s即杂化,形成的3个s即 杂化轨道分别与1个碳原子和2个氧原子形成3个。键,成键的4个原子处于 同一平面,未参加杂化的p轨道与羰基氧原子的p轨道形成π键(即羧基中C=O 的π键),该π键又与羟基氧原子上含未共用电子对的p轨道平行并相互重叠, 形成Pπ共轭体系,Pπ共轭的存在,使碳氧间的健长发生了平均化,如下图所 示。 0 R一C 0 -H 0 9-H 图羧酸的结构示意图 当羧基离解成负离子时,由于电子的离域,氧上的负电荷不是集中在1个氧 原子上,而是平均分散在2个氧原子上。因此两个碳氧键的键长相等,都为127 pm,没有单键和双键的区别。 二、羧酸的分类和命名 (一)羧酸的分类
羧酸 烃分子中的氢原子被羧基(-COOH)取代而形成的化合物称为羧酸,其通式 为 RCOOH(甲酸为 HCOOH),羧基是羧酸的官能团。 羧酸分子中烃基上的氢原子被其他原子或基团取代而形成的化合物称为取 代羧酸。常见的取代羧酸有卤代酸、羟基酸、羰基酸和氨基酸等。本章主要讨论 羟基酸和羰基酸。 羧酸和取代羧酸广泛存在于中草药或其他动植物中。它们与医药关系十分密 切,在有机合成、生物代谢及药物中起着十分重要的作用。 一、羧酸的结构 羧酸的官能团是羧基(-COOH),它是由羰基和羟基相连而成的。现代物理 方法测定证明,甲酸分子中碳氧双键的键长为 123 pm,比普通羰基的碳氧双键 键长 120 pm 要长,而羧基中的碳氧单键键长为 136 pm,比醇中相应的碳氧单 键键长 143 pm 又短得多,这说明羧基中羰基与羟基间存在着相互作用。 杂化轨道理论认为,羧酸分子中羧基的碳原子是 sp 2 杂化,形成的 3 个 sp 2 杂化轨道分别与 1 个碳原子和 2 个氧原子形成 3 个 σ 键,成键的 4 个原子处于 同一平面,未参加杂化的 p 轨道与羰基氧原子的 p 轨道形成 π 键(即羧基中 C=O 的 π 键),该 π 键又与羟基氧原子上含未共用电子对的 p 轨道平行并相互重叠, 形成 p-π 共轭体系,p-π 共轭的存在,使碳氧间的键长发生了平均化,如下图所 示。 R C O O H R C O O H 图 羧酸的结构示意图 当羧基离解成负离子时,由于电子的离域,氧上的负电荷不是集中在 1 个氧 原子上,而是平均分散在 2 个氧原子上。因此两个碳氧键的键长相等,都为 127 pm,没有单键和双键的区别。 二、羧酸的分类和命名 (一) 羧酸的分类
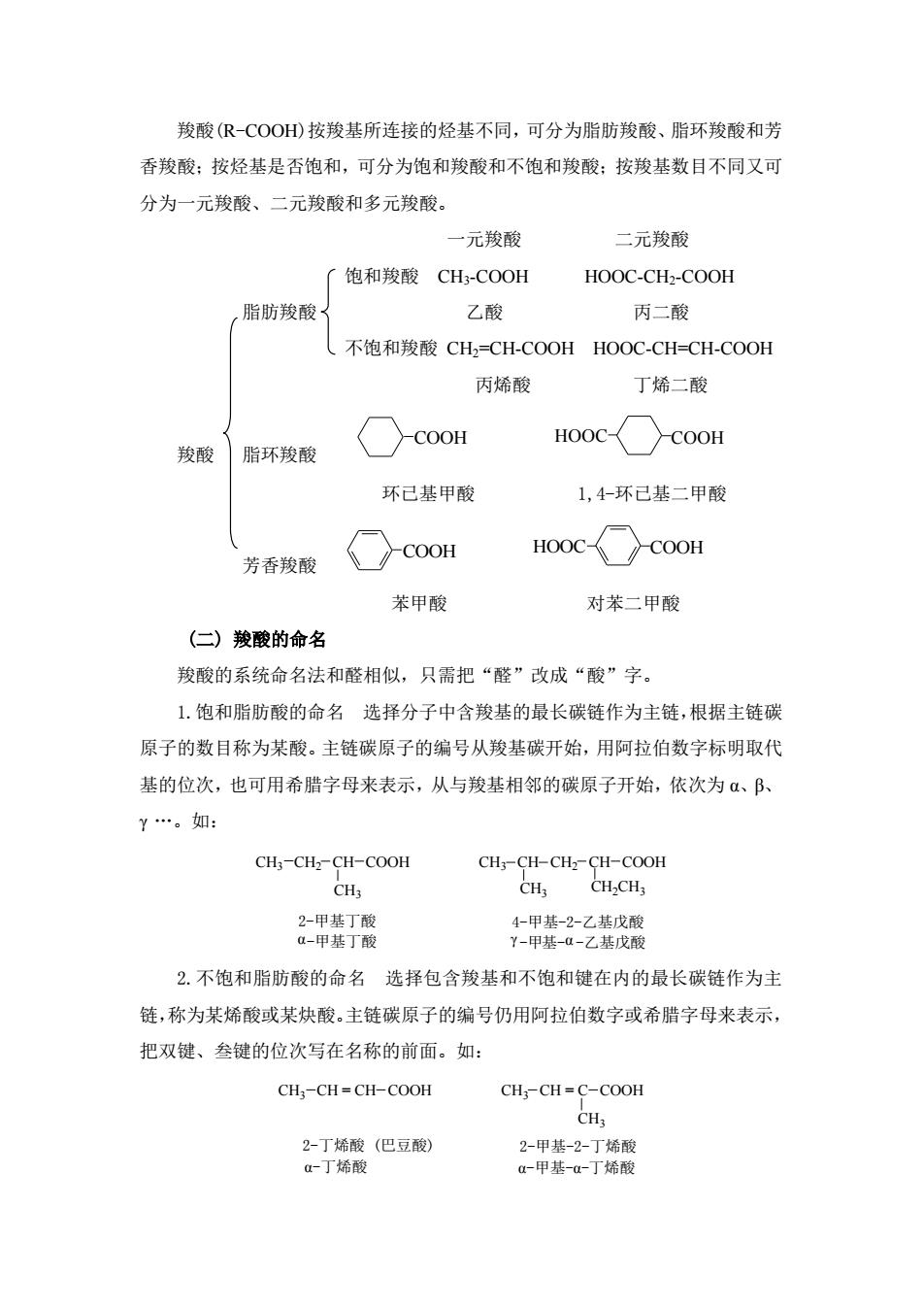
羧酸(R-COOH)按羧基所连接的烃基不同,可分为脂肪羧酸、脂环羧酸和芳 香羧酸:按烃基是否饱和,可分为饱和羧酸和不饱和羧酸:按羧基数目不同又可 分为一元羧酸、二元羧酸和多元羧酸。 一元羧酸 二元羧酸 「饱和羧酸CH3-COOH HOOC-CH-COOH ,脂肪羧酸 乙酸 丙二酸 不饱和羧酸CH2-CH-COOH HOOC-CH=-CH-COOH 丙烯酸 丁烯二酸 HO0C〈COoH 羧酸脂环羧酸 COOH 环已基甲酸 1,4-环已基二甲酸 芳香羧酸 ○cooH HOOC COOH 苯甲酸 对苯二甲酸 (仁)羧酸的命名 羧酸的系统命名法和醛相似,只需把“醛”改成“酸”字。 1.饱和脂肪酸的命名选择分子中含羧基的最长碳链作为主链,根据主链碳 原子的数目称为某酸。主链碳原子的编号从羧基碳开始,用阿拉伯数字标明取代 基的位次,也可用希腊字母来表示,从与羧基相邻的碳原子开始,依次为α、B、 Y.。如: CH;-CHz-CH-COOH CHs-CH-CH2-CH-COOH CH CH;CH2CH3 2-甲基丁酸 4-甲基-2-乙基戊酸 u-甲基丁酸 Y-甲基-a-乙基戊酸 2.不饱和脂肪酸的命名选择包含羧基和不饱和键在内的最长碳链作为主 链,称为某烯酸或某炔酸。主链碳原子的编号仍用阿拉伯数字或希腊字母来表示 把双键、叁键的位次写在名称的前面。如: CH;-CH=CH-COOH CH3-CH=C-COOH CH 2-丁烯酸(巴豆酸) 2-甲基-2-丁烯酸 a-丁烯酸 a-甲基-a-丁烯酸
羧酸(R-COOH)按羧基所连接的烃基不同,可分为脂肪羧酸、脂环羧酸和芳 香羧酸;按烃基是否饱和,可分为饱和羧酸和不饱和羧酸;按羧基数目不同又可 分为一元羧酸、二元羧酸和多元羧酸。 一元羧酸 二元羧酸 饱和羧酸 CH3-COOH HOOC-CH2-COOH 脂肪羧酸 乙酸 丙二酸 不饱和羧酸 CH2=CH-COOH HOOC-CH=CH-COOH 丙烯酸 丁烯二酸 羧酸 脂环羧酸 COOH HOOC COOH 环已基甲酸 1,4-环已基二甲酸 芳香羧酸 COOH HOOC COOH 苯甲酸 对苯二甲酸 (二) 羧酸的命名 羧酸的系统命名法和醛相似,只需把“醛”改成“酸”字。 1.饱和脂肪酸的命名 选择分子中含羧基的最长碳链作为主链,根据主链碳 原子的数目称为某酸。主链碳原子的编号从羧基碳开始,用阿拉伯数字标明取代 基的位次,也可用希腊字母来表示,从与羧基相邻的碳原子开始,依次为 α、β、 γ „。如: 2-甲基丁酸 4-甲基-2-乙基戊酸 α-甲基丁酸 γ -甲基-α -乙基戊酸 CH3 CH2 CH COOH CH3 CH CH2 CH COOH CH3 CH3 CH2CH3 2.不饱和脂肪酸的命名 选择包含羧基和不饱和键在内的最长碳链作为主 链,称为某烯酸或某炔酸。主链碳原子的编号仍用阿拉伯数字或希腊字母来表示, 把双键、叁键的位次写在名称的前面。如: 2-丁烯酸 (巴豆酸) 2-甲基-2-丁烯酸 α-丁烯酸 α-甲基-α-丁烯酸 CH3 CH = CH COOH CH3 CH = C COOH CH3

3.二元脂肪羧酸的命名选择分子中含两个羧基在内的最长碳链作为主链, 称为某二酸。如: COOH HOOC-COOH HOOC-CH2-CH2-COOH CH3-CH2-CH COOH 乙二酸 丁二酸 乙基丙二酸 4.芳香羧酸和脂环羧酸的命名把脂肪羧酸作为母体,将芳香烃基、脂环烃 基视为取代基。如: COOH COOH CH-CH-COOH ◇ 苯甲酸 间甲基苯甲酸 3-苯基丙烯酸 ◇8o0om CH2-COOH 邻苯二甲酸 环成基乙酸 另外,羧酸还常根据其天然来源或性质用俗名,如蚁酸HCOOH、醋酸 CHc00H、草酸H00C-c0OH、安息香酸c0oH 等。 三、羧酸的物理性质 饱和一元羧酸中,甲酸、乙酸、丙酸是具有刺激性气味的液体:C4~C的羧 酸是有恶臭气味的液体:C1。以上的羧酸是无味的蜡状固体。脂肪族二元羧酸和 芳香羧酸都是结晶固体。 羧酸能与水分子形成氢键,低级脂肪酸易溶于水,但随分子量增高,在水中 溶解度降低。高级脂肪酸不溶于水,但能溶于乙醇、乙醚、苯等有机溶剂。 饱和一元羧酸和二元羧酸的熔点,随分子中碳原子数目的增加呈锯齿状的变 化,即含偶数碳原子的羧酸,比相邻的两个含奇数碳原子的羧酸熔点高,这种现 象被认为与分子的对称性有关。如乙酸的熔点为16.6℃,而相邻的甲酸熔点为 8.4℃,丙酸熔点为-22℃;再如丁二酸的熔点为185℃,而相邻的丙二酸熔点为 135℃,戊二酸熔点为97.5℃。 四、羧酸的化学性质 羧酸的化学性质主要表现在官能团羧基上。羧基在形式上由羰基和羟基组成
3.二元脂肪羧酸的命名 选择分子中含两个羧基在内的最长碳链作为主链, 称为某二酸。如: 乙二酸 丁二酸 乙基丙二酸 HOOC COOH HOOC CH2 CH2 COOH CH3 CH2 CH COOH COOH 4.芳香羧酸和脂环羧酸的命名 把脂肪羧酸作为母体,将芳香烃基、脂环烃 基视为取代基。如: 苯甲酸 间甲基苯甲酸 3 -苯基丙烯酸 CH=CH COOH CH3 COOH COOH 邻苯二甲酸 环戊基乙酸 COOH COOH CH2 COOH 另外,羧酸还常根据其天然来源或性质用俗名,如蚁酸 HCOOH、醋酸 CH3COOH、草酸 HOOC-COOH、安息香酸 COOH 等。 三、羧酸的物理性质 饱和一元羧酸中,甲酸、乙酸、丙酸是具有刺激性气味的液体;C4~C9 的羧 酸是有恶臭气味的液体;C10 以上的羧酸是无味的蜡状固体。脂肪族二元羧酸和 芳香羧酸都是结晶固体。 羧酸能与水分子形成氢键,低级脂肪酸易溶于水,但随分子量增高,在水中 溶解度降低。高级脂肪酸不溶于水,但能溶于乙醇、乙醚、苯等有机溶剂。 饱和一元羧酸和二元羧酸的熔点,随分子中碳原子数目的增加呈锯齿状的变 化,即含偶数碳原子的羧酸,比相邻的两个含奇数碳原子的羧酸熔点高,这种现 象被认为与分子的对称性有关。如乙酸的熔点为 16.6℃,而相邻的甲酸熔点为 8.4℃,丙酸熔点为-22℃;再如丁二酸的熔点为 185℃,而相邻的丙二酸熔点为 135℃,戊二酸熔点为 97.5℃。 四、羧酸的化学性质 羧酸的化学性质主要表现在官能团羧基上。羧基在形式上由羰基和羟基组成

但由于它们通过pπ共轭构成了一个整体,使羧酸在性质上有别于羰基化合物和 醇类,而具有特殊性质。 (一)酸性 由于羧基中的Pπ共轭体系,使羟基氧原子上的电子云密度降低,导致氢氧 键极性增强,易于解离出质子,表现酸性。一般的羧酸都属弱酸,它们在水中只 是部分电离: R8-0m,一R-8-0+r 0 羧酸的酸性强弱可以用电离常数K或其负对数pK。表示。K愈大或pKa愈 小,酸性愈强。羧酸的pK,一般都在3一5。饱和一元羧酸中,甲酸的酸性比同系 列中其他羧酸的酸性强,这是由于烷基的给电子诱导效应,降低了氢氧键的极性 使氢较难解离,因此酸性减弱。如甲酸的pK为3.77,乙酸的pK为4.76。 芳香酸比甲酸的酸性弱,但比其他的饱和一元羧酸酸性强(如苯甲酸的pK 为4.17),这是由于苯环的大π键与羧基可以形成ππ共轭体系,羧基的吸电子 共轭效应,使环上的电子云向羧基偏移,减弱了氢氧键的极性,氢的解离能力降 低,所以酸性比甲酸弱。 综上所述,一元羧酸的酸性强弱顺序如下: 甲酸>苯甲酸>其他饱和一元羧酸 一元羧酸的酸性比盐酸、硫酸等无机强酸的酸性弱,但比碳酸和酚类的酸性 强,所以羧酸可与NaOH、NaCO,、NaHCO反应。 R -COOH+NaOH R-COONa H2O R-C0OH+Na,C0,→R-C00a+C0,↑+H,0 R-CooH+NaHCO3→R-COONa+CO2↑+H,0 羧酸与其他有关化合物的酸性强弱顺序如下: Hs0、HG>Rc0OH>Hc0,>○oH>H0>RoH (仁)羧基上羟基的取代反应 羧酸分子中羧基上的羟基被卤素、酰氧基、烷氧基和氨基取代,生成相应的 酰卤、酸酐、酯和酰胺等羧酸衍生物。羧酸分子中去掉羟基剩余的部分仅。-)
但由于它们通过 p-π 共轭构成了一个整体,使羧酸在性质上有别于羰基化合物和 醇类,而具有特殊性质。 (一) 酸性 由于羧基中的 p-π 共轭体系,使羟基氧原子上的电子云密度降低,导致氢氧 键极性增强,易于解离出质子,表现酸性。一般的羧酸都属弱酸,它们在水中只 是部分电离: R C OH R C O + H O O = = 羧酸的酸性强弱可以用电离常数 Ka 或其负对数 pKa 表示。Ka 愈大或 pKa 愈 小,酸性愈强。羧酸的 pKa 一般都在 3~5。饱和一元羧酸中,甲酸的酸性比同系 列中其他羧酸的酸性强,这是由于烷基的给电子诱导效应,降低了氢氧键的极性, 使氢较难解离,因此酸性减弱。如甲酸的 pKa为 3.77,乙酸的 pKa为 4.76。 芳香酸比甲酸的酸性弱,但比其他的饱和一元羧酸酸性强(如苯甲酸的 pKa 为 4.17),这是由于苯环的大 π 键与羧基可以形成 π-π 共轭体系,羧基的吸电子 共轭效应,使环上的电子云向羧基偏移,减弱了氢氧键的极性,氢的解离能力降 低,所以酸性比甲酸弱。 综上所述,一元羧酸的酸性强弱顺序如下: 甲酸 > 苯甲酸 > 其他饱和一元羧酸 一元羧酸的酸性比盐酸、硫酸等无机强酸的酸性弱,但比碳酸和酚类的酸性 强,所以羧酸可与 NaOH、Na2CO3、NaHCO3反应。 R COOH + NaOH R COONa + H2O R R COOH + Na2CO3 R COONa + CO2 R COOH + NaHCO3 COONa + CO2 + H2O + H2O 羧酸与其他有关化合物的酸性强弱顺序如下: H2SO4、HCl > RCOOH > H2CO3 > > > OH H2O ROH (二) 羧基上羟基的取代反应 羧酸分子中羧基上的羟基被卤素、酰氧基、烷氧基和氨基取代,生成相应的 酰卤、酸酐、酯和酰胺等羧酸衍生物。羧酸分子中去掉羟基剩余的部分( = R C O )

称为酰基 1.酰卤的生成羧基中的羟基被卤素取代后的产物称为酰卤.酰氯是常见的 酰卤,它可由羧酸与三氯化磷、五氯化磷或亚硫酰氯反应生成。 R-C-OH+PCL→R-飞CI+H,PO3 三氯化磷 酰氯亚磷酸 五氯化磷 酰氯三氯氧磷 0 0 R-C-oH+SOC2→R-C-C+sO,↑+HCt 亚硫酰氯 酰氯 (氯化亚跟) 制备酰氯常用的方法是亚硫酰氯与羧酸反应,因该反应生成的副产物都是气 体,在反应中随时逸出,可得到较纯净的酰氯。酰氯很活泼,它是一类具有高度 反应活性的化合物,广泛用于药物和有机合成中。 2.酸酐的生成羧酸在脱水剂(如PzO)作用下或在加热情况下,两个羧基 间失去一分子水,生成酸酐。 0 00 R-8om:w0c-R - 酸酐 具有4个或5个碳原子的二元酸(如乙二酸、戊二酸、邻苯二甲酸等)加热, 分子内脱水,形成较稳定的具有五元环或六元环的环状酸酐(环酐)。如: 0 0 4-t-o30o, CH2-C、 CH2- 0+,0 CH2-C-OH 0 丁二酸 丁二酸酐 0 >0+H20 邻苯二甲酸 邻苯二甲酸酐 3.酯的生成在少量酸(如浓疏酸)的催化作用下,羧酸可与醇反应生成酯, 该反应被称为酯化反应。有机酸和醇的酯化反应速度极慢,必须在酸的催化及加
称为酰基。 1.酰卤的生成 羧基中的羟基被卤素取代后的产物称为酰卤。酰氯是常见的 酰卤,它可由羧酸与三氯化磷、五氯化磷或亚硫酰氯反应生成。 三氯化磷 酰氯 亚磷酸 五氯化磷 酰氯 三氯氧磷 亚硫酰氯 (氯化亚砜) 酰氯 R C OH + PCl3 R C Cl + H3PO3 = = O O = = O O R C OH + PCl5 R C Cl + POCl3 + HCl = = O O R C OH + SOCl2 R C Cl + SO2 + HCl 制备酰氯常用的方法是亚硫酰氯与羧酸反应,因该反应生成的副产物都是气 体,在反应中随时逸出,可得到较纯净的酰氯。酰氯很活泼,它是一类具有高度 反应活性的化合物,广泛用于药物和有机合成中。 2.酸酐的生成 羧酸在脱水剂(如 P2O5)作用下或在加热情况下,两个羧基 间失去一分子水,生成酸酐。 酸酐 R C OH + HO C R R C O C R + H2O = = P2O5 = = O O O O 具有 4 个或 5 个碳原子的二元酸(如乙二酸、戊二酸、邻苯二甲酸等)加热, 分子内脱水,形成较稳定的具有五元环或六元环的环状酸酐(环酐)。如: 丁二酸 丁二酸酐 CH2 C OH = = = = CH2 C OH O O CH2 C CH2 C O O O 300℃ + H2O 邻苯二甲酸 邻苯二甲酸酐 = = = = C C O O O O C C OH OH O + H2O 230℃ 3.酯的生成 在少量酸(如浓硫酸)的催化作用下,羧酸可与醇反应生成酯, 该反应被称为酯化反应。有机酸和醇的酯化反应速度极慢,必须在酸的催化及加

热下进行。 R&0-R+0 羧酸醇 酯 酯化反应在酸性条件下是可逆反应,生成的酯在同样条件下可与水作用生成 羧酸和醇,称为酯的水解反应。所以要提高酯的产率,可以增加反应物的浓度或 及时蒸出生成的酯和水,使平衡向生成酯的方向移动。 羧酸与醇的酯化反应,在大多数情况下(羧酸与伯醇和仲醇成酯),是羧酸的 羟基与醇羟基上的氢形成水。如用含有同位素180的乙醇与乙酸进行反应,发现 80转移到生成酯的分子中,而不是在水的分子中。说明酯化反应是羧酸发生酰 氧键断裂,羧基的羟基被烃氧基取代。 0 0 CH-CFoH +-CH.CH CH C-O-CH.CH H.o 4.酰胺的生成羧酸与氨反应,先生成羧酸的铵盐,将铵盐进一步加热,分 子内失水生成酰胺 0 0 R-&-OH+NH,→R-ONH,△R-&-NH,+HO 我酸铵 酰胺 (三)H原子的卤代反应 受羧基吸电子效应的影响,羧酸分子中α-H原子具有一定的活性,但因羧 基中的羟基与羰基形成p一π共轭体系,使羧基的致活能力比羰基小,所以羧酸的 α-H的卤代反应需要在红磷或三卤化磷的催化作用下才能进行。 Br CACI.COOMCIKcOOMcOM (四)还原反应 羧酸分子中,羧基上的羰基由于受羟基的影响,失去了羰基的典型性质,所 以羧酸在一般情况下与多数还原剂不反应,但能被强还原剂—氢化铝锂 (亿AH4)还原成伯醇。用氢化铝锂还原羧酸时,不但产率高,而且分子中的C=C 不饱和键不受影响,只还原羧基,生成不饱和醇
热下进行。 羧酸 醇 酯 = O R C OH + R' OH R C O R' + H2O = 浓 H O 2SO4 酯化反应在酸性条件下是可逆反应,生成的酯在同样条件下可与水作用生成 羧酸和醇,称为酯的水解反应。所以要提高酯的产率,可以增加反应物的浓度或 及时蒸出生成的酯和水,使平衡向生成酯的方向移动。 羧酸与醇的酯化反应,在大多数情况下(羧酸与伯醇和仲醇成酯),是羧酸的 羟基与醇羟基上的氢形成水。如用含有同位素 18O 的乙醇与乙酸进行反应,发现 18O 转移到生成酯的分子中,而不是在水的分子中。说明酯化反应是羧酸发生酰 氧键断裂,羧基的羟基被烃氧基取代。 CH3 C OH + H 18O CH2CH3 CH3 C 18O CH2CH3 + H2O = = O O H 4.酰胺的生成 羧酸与氨反应,先生成羧酸的铵盐,将铵盐进一步加热,分 子内失水生成酰胺。 羧酸铵 酰胺 R C OH + NH3 R C ONH4 R C NH2 + H2O O O O = = = (三) α-H 原子的卤代反应 受羧基吸电子效应的影响,羧酸分子中 α-H 原子具有一定的活性,但因羧 基中的羟基与羰基形成 p-π 共轭体系,使羧基的致活能力比羰基小,所以羧酸的 α-H 的卤代反应需要在红磷或三卤化磷的催化作用下才能进行。 CH3CH2COOH CH3CHCOOH CH3CCOOH Br2 Br2 ,P P Br Br Br (四) 还原反应 羧酸分子中,羧基上的羰基由于受羟基的影响,失去了羰基的典型性质,所 以羧酸在一般情况下与多数还原剂不反应,但能被强还原剂——氢化铝锂 (LiAlH4)还原成伯醇。用氢化铝锂还原羧酸时,不但产率高,而且分子中的 C=C 不饱和键不受影响,只还原羧基,生成不饱和醇

RCH.CH-CHCOOH A RCHCH-CHCH.OH H+ (五)脱羧反应 羧酸的碱金属盐与碱石灰(NaOH-CaO)共热,脱去二氧化碳生成烃,这种羧 酸失去羧基放出二氧化碳的反应,称为脱羧反应。 RCOONaNaOH R-H+Na:CO3 CH,COONa+NaOH拾,CHf+Na,CO3 此反应常用于实验室制取甲烷。二元羧酸比饱和一元羧酸更易脱羧。如: HO0C-C0H△→HCOH+C,t 人体新陈代谢过程中的脱羧反应是在脱羧酶的催化下进行的,它是一类非常 重要的生物化学反应。 五、重要的羧酸 (一)甲酸 甲酸(HCOO川)俗名蚁酸,最初是从蚂蚁体内发现的。甲酸存在于许多昆虫 的分泌物及某些植物(如荨麻、松叶)中。 甲酸是具有刺激性气味的无色液体,沸点100.5℃,易溶于水,有很强的腐 蚀性。蜂蜇或荨麻刺伤皮肤引起肿痛,就是甲酸造成的。 甲酸的分子结构特殊,它的羧基与氢原子直接相连,分子中既有羧基的结构, 又有醛基的结构,如图93所示。 醛基 一羧基 图9-3甲酸的结构示意图 因此,甲酸的酸性比其他饱和一元羧酸强。甲酸除了具有羧酸的性质外,还 具有醛的还原性,能与托伦试剂发生银镜反应,能与斐林试剂反应产生砖红色沉 淀,还能使酸性高锰酸钾溶液褪色。利用这些反应可以区别甲酸与其他羧酸。 甲酸常用作还原剂。因有杀菌力,也可用作消毒防腐剂。 (二)乙酸
RCH2CH=CHCOOH RCH2CH=CHCH2OH LiAlH4 H (五) 脱羧反应 羧酸的碱金属盐与碱石灰(NaOH-CaO)共热,脱去二氧化碳生成烃,这种羧 酸失去羧基放出二氧化碳的反应,称为脱羧反应。 R COONa + NaOH R H + Na2CO3 强热 CaO CH3COONa + Na OH CH4 + Na2CO3 强热 CaO 此反应常用于实验室制取甲烷。二元羧酸比饱和一元羧酸更易脱羧。如: HOOC-COOH HCOOH + CO2 人体新陈代谢过程中的脱羧反应是在脱羧酶的催化下进行的,它是一类非常 重要的生物化学反应。 五、重要的羧酸 (一)甲酸 甲酸(HCOOH)俗名蚁酸,最初是从蚂蚁体内发现的。甲酸存在于许多昆虫 的分泌物及某些植物(如荨麻、松叶)中。 甲酸是具有刺激性气味的无色液体,沸点 100.5℃,易溶于水,有很强的腐 蚀性。蜂蜇或荨麻刺伤皮肤引起肿痛,就是甲酸造成的。 甲酸的分子结构特殊,它的羧基与氢原子直接相连,分子中既有羧基的结构, 又有醛基的结构,如图 9-3 所示。 H C OH O = 醛基 羧基 图 9-3 甲酸的结构示意图 因此,甲酸的酸性比其他饱和一元羧酸强。甲酸除了具有羧酸的性质外,还 具有醛的还原性,能与托伦试剂发生银镜反应,能与斐林试剂反应产生砖红色沉 淀,还能使酸性高锰酸钾溶液褪色。利用这些反应可以区别甲酸与其他羧酸。 甲酸常用作还原剂。因有杀菌力,也可用作消毒防腐剂。 (二)乙酸

乙酸(CH,COOH)又称醋酸,是食醋的主要成分,食醋中乙酸的浓度为60~80 gL。我国自古就有关于谷物发酵制醋的记载。因为许多微生物可将不同的有机 物发酵转化为乙酸,所以乙酸在自然界中分布很广。例如酸牛奶中、酸葡萄酒中 都含有乙酸。此外,乙醇氧化以及乙炔经水合为乙醛后,再经氧化也可得到乙酸。 乙酸是无色有刺激性气味的液体,易溶于水,熔点16.6℃,沸点118℃。室 温低于16.6℃时,乙酸能凝结成冰状的固体,所以常把无水乙酸称为冰醋酸。 乙酸是染料、香料、制药等工业的原料。乙酸的稀溶液在医药上可作为消毒防腐 剂,还有消肿治癣、预防感后等作用。 (三)苯甲酸 苯甲酸(CH,C0OH俗称安息香酸,存在于安息香树胶中而得名。苯甲酸是白 色晶体,熔点121.7℃,难溶于冷水,易溶于热水、乙醚、乙醇和氯仿中,受热 易升华。苯甲酸及其钠盐具有抑菌防腐作用,且毒性小,可用作食品和药物的防 腐剂。 (四)乙二酸 乙二酸(HOOC-COOH俗名草酸,多以盐的形式存在于许多草本植物中。草 酸是无色结晶,常含两分子结晶水,加热到100℃就失去结晶水成为无水草酸。 草酸有毒,易溶于水和乙醇,但不溶于乙醚。 草酸是饱和脂肪二元羧酸中酸性最强的一个。它除了具有一般羧酸的性质外 还具有还原性,易被氧化。例如草酸能与高锰酸钾定量反应,在分析化学中,常 用草酸来标定高锰酸钾溶液的浓度。 5H00C-C00H+2KMnO4+3H2S04K2S04+2MnS04+10C021+8H20 由于草酸的钙盐溶解度很小,所以可用草酸作钙离子的定性和定量测定。 草酸能把高价铁盐还原成易溶于水的低价铁盐,因而可用草酸来洗涤铁锈或 蓝墨水的污渍。此外,工业上常用草酸作漂白剂,用以漂白麦草、硬脂酸等。 (五)丁二酸 丁二酸(HOOC-CH,CH,-COOH)俗名琥珀酸,最早是由蒸馏琥珀制得。琥珀是 含约8%琥珀酸的透明红褐色松脂化石。琥珀酸在医药上用作抗痉挛、祛痰、利 尿剂。 取代羧酸
乙酸(CH3COOH)又称醋酸,是食醋的主要成分,食醋中乙酸的浓度为 60~80 g·L -1。我国自古就有关于谷物发酵制醋的记载。因为许多微生物可将不同的有机 物发酵转化为乙酸,所以乙酸在自然界中分布很广。例如酸牛奶中、酸葡萄酒中 都含有乙酸。此外,乙醇氧化以及乙炔经水合为乙醛后,再经氧化也可得到乙酸。 乙酸是无色有刺激性气味的液体,易溶于水,熔点 16.6℃,沸点 118℃。室 温低于 16.6℃时,乙酸能凝结成冰状的固体,所以常把无水乙酸称为冰醋酸。 乙酸是染料、香料、制药等工业的原料。乙酸的稀溶液在医药上可作为消毒防腐 剂,还有消肿治癣、预防感冒等作用。 (三)苯甲酸 苯甲酸(C6H5COOH)俗称安息香酸,存在于安息香树胶中而得名。苯甲酸是白 色晶体,熔点 121.7℃,难溶于冷水,易溶于热水、乙醚、乙醇和氯仿中,受热 易升华。苯甲酸及其钠盐具有抑菌防腐作用,且毒性小,可用作食品和药物的防 腐剂。 (四)乙二酸 乙二酸(HOOC-COOH)俗名草酸,多以盐的形式存在于许多草本植物中。草 酸是无色结晶,常含两分子结晶水,加热到 100℃就失去结晶水成为无水草酸。 草酸有毒,易溶于水和乙醇,但不溶于乙醚。 草酸是饱和脂肪二元羧酸中酸性最强的一个。它除了具有一般羧酸的性质外, 还具有还原性,易被氧化。例如草酸能与高锰酸钾定量反应,在分析化学中,常 用草酸来标定高锰酸钾溶液的浓度。 5HOOC COOH + 2KMnO4 + 3H2SO4 K2SO4 + 2MnSO4 + 10CO2 + 8H2O 由于草酸的钙盐溶解度很小,所以可用草酸作钙离子的定性和定量测定。 草酸能把高价铁盐还原成易溶于水的低价铁盐,因而可用草酸来洗涤铁锈或 蓝墨水的污渍。此外,工业上常用草酸作漂白剂,用以漂白麦草、硬脂酸等。 (五)丁二酸 丁二酸(HOOC-CH2CH2-COOH)俗名琥珀酸,最早是由蒸馏琥珀制得。琥珀是 含约 8﹪琥珀酸的透明红褐色松脂化石。琥珀酸在医药上用作抗痉挛、袪痰、利 尿剂。 取代羧酸

一、羟基酸 (一)羟基酸的分类和命名 羟基酸是分子中既含有羟基又含有羧基的化合物。羟基酸广泛存在于动植物 体内,是生物体生命活动中的物质,也是合成药物的原料,还可作为食品的调味 剂。羟基酸包括醇酸和酚酸两类。羟基连在脂肪烃基上的称为醇酸:羟基直接连 在芳环上的称为酚酸。根据羟基与羧基的相对位置不同,醇酸又可分为α羟基酸 B-羟基酸和Y-羟基酸等。 醇酸的命名是以羧酸为母体,羟基作为取代基,用阿拉伯数字或希腊字母α、 B、Y等标明羟基的位次。酚酸是以芳香酸为母体,标明羟基在芳环上的位次。 自然界存在的羟基酸多采用俗名。如: CHCHCOOH HO-CHCOOH OH CH-COOH 1-羟基丙酸 羟基丁二酸 (2-羟基丙酸) 苹果酸 乳酸 (仁)羟基酸的性质 醇酸一般为晶体或黏稠的液体,易溶于水,溶解度比相应的醇或羧酸大,大 多数醇酸具有旋光性。酚酸为晶体,多以盐、酯或糖苷的形式存在于植物中,微 溶于水,溶解性随羟基数目的增多而增大。羟基酸的熔点比相应的羧酸高。 羟基酸兼有羟基和羧基,具有醇、酚和羧酸的通性。由于两个官能团的相互 影响,又具有一些特殊的性质。而且这些特殊性质因羟基和羧基的相对位置不同 又表现出明显的差异。 1.酸性由于羟基有吸电子诱导效应,一般醇酸的酸性比相应的羧酸强。因 为诱导效应随传递距离的增长而迅速减弱,所以羟基离羧基越近,酸性越强。 2.氧化反应醇酸分子中的羟基受羧基影响,比醇分子中的羟基更容易被氧 化。稀硝酸就可以氧化醇酸,生成醛酸或酮酸:托伦试剂能将α-醇酸氧化成α 酮酸。生物体内醇酸的氧化是在酶催化下进行的。 3.分解反应-醇酸与稀硫酸共热时,分解生成甲酸和少一个碳的醛或酮 因为α-醇酸中羟基和羧基都是吸电子基,使α碳与羧基之间的电子云密度降低, “定条件下键容易断裂
一、羟 基 酸 (一)羟基酸的分类和命名 羟基酸是分子中既含有羟基又含有羧基的化合物。羟基酸广泛存在于动植物 体内,是生物体生命活动中的物质,也是合成药物的原料,还可作为食品的调味 剂。羟基酸包括醇酸和酚酸两类。羟基连在脂肪烃基上的称为醇酸;羟基直接连 在芳环上的称为酚酸。根据羟基与羧基的相对位置不同,醇酸又可分为α-羟基酸、 β-羟基酸和γ-羟基酸等。 醇酸的命名是以羧酸为母体,羟基作为取代基,用阿拉伯数字或希腊字母α、 β、γ 等标明羟基的位次。酚酸是以芳香酸为母体,标明羟基在芳环上的位次。 自然界存在的羟基酸多采用俗名。如: -羟基丙酸 羟基丁二酸 乳酸 (2-羟基丙酸) 苹果酸 α CH3CHCOOH OH CHCOOH CH2COOH HO (二)羟基酸的性质 醇酸一般为晶体或黏稠的液体,易溶于水,溶解度比相应的醇或羧酸大,大 多数醇酸具有旋光性。酚酸为晶体,多以盐、酯或糖苷的形式存在于植物中,微 溶于水,溶解性随羟基数目的增多而增大。羟基酸的熔点比相应的羧酸高。 羟基酸兼有羟基和羧基,具有醇、酚和羧酸的通性。由于两个官能团的相互 影响,又具有一些特殊的性质。而且这些特殊性质因羟基和羧基的相对位置不同 又表现出明显的差异。 1.酸性 由于羟基有吸电子诱导效应,一般醇酸的酸性比相应的羧酸强。因 为诱导效应随传递距离的增长而迅速减弱,所以羟基离羧基越近,酸性越强。 2.氧化反应 醇酸分子中的羟基受羧基影响,比醇分子中的羟基更容易被氧 化。稀硝酸就可以氧化醇酸,生成醛酸或酮酸;托伦试剂能将α-醇酸氧化成α- 酮酸。生物体内醇酸的氧化是在酶催化下进行的。 3.分解反应 α-醇酸与稀硫酸共热时,分解生成甲酸和少一个碳的醛或酮。 因为α-醇酸中羟基和羧基都是吸电子基,使α-碳与羧基之间的电子云密度降低, 一定条件下键容易断裂

(三)重要的羟基酸及其衍生物 OH 1.乳酸CH,CHC00化学名称为a-羟基丙酸。因存在于酸牛奶中而得名。 乳酸一般为无色黏稠液体。临床上乳酸钙用作补钙剂,预防和治疗缺钙症:乳酸 钠用作酸中毒的解毒剂。乳酸具有消毒防腐作用。乳酸在医药、食品及饮料等工 业中也广泛应用。 CHCOOH 2.苹果酸H0-CC00H化学名称为羟基丁二酸。因最初来自苹果而得名。 HO-CHCOOH 3.酒石酸H0-C4COOH化学名称为2,3-二羟基丁二酸。存在于萄萄酿酒 时析出的结晶一一酒石(酒石酸氢钾)中。 COOH 4.柠檬酸柠檬酸又名枸橼酸,HOOCCH,CcH,CooH化学名称为3-羧基-3-羟 OH 基戊二酸。因最初来自柠檬而得名。 5.水杨酸水杨酸又名柳酸, 工0沿”化学名称为邻羟基苯甲酸。存在 于柳树和水杨树皮中。水杨酸为无色针状晶体,熔点159℃,在79℃时升华,易 溶于热水、乙醇、乙醚和氯仿。水杨酸易被氧化、遇三氯化铁显紫红色,酸性比 苯甲酸强、加热易脱羧,具有酚和羧酸的一般性质。 乙酰水杨酸的商品名为阿司匹林(aspirin)。可用水杨酸与乙酸酐在少量浓硫 酸存在下反应制得。 a+ao0.a+amaw 乙酰水杨酸 乙酰水杨酸为白色针状晶体,微溶于水。乙酰水杨酸具有解热、镇痛、消炎、 抗风湿及抗血小板聚集作用,是常用的解热镇痛药。为了减小阿司匹林对胃的刺 激性,目前常使用肠溶性阿司匹林。 二、羰基酸 1.丙酮酸丙酮酸(CH,COCOOH)是最简单的a-酮酸,为无色液体,有刺激 性气味,沸点165℃(分解),易溶于水。丙酮酸是动植物体内糖、脂肪、蛋白质
(三)重要的羟基酸及其衍生物 1. 乳酸 CH3CHCOOH OH 化学名称为α-羟基丙酸。因存在于酸牛奶中而得名。 乳酸一般为无色黏稠液体。临床上乳酸钙用作补钙剂,预防和治疗缺钙症;乳酸 钠用作酸中毒的解毒剂。乳酸具有消毒防腐作用。乳酸在医药、食品及饮料等工 业中也广泛应用。 2. 苹果酸 HO CHCOOH CH2COOH 化学名称为羟基丁二酸。因最初来自苹果而得名。 3. 酒石酸 HO CHCOOH HO CHCOOH 化学名称为2,3-二羟基丁二酸。存在于葡萄酿酒 时析出的结晶——酒石(酒石酸氢钾)中。 4.柠檬酸 柠檬酸又名枸橼酸, CCH2COOH COOH OH HOOCCH2 化学名称为3-羧基-3-羟 基戊二酸。因最初来自柠檬而得名。 5.水杨酸 水杨酸又名柳酸, COOH OH 化学名称为邻羟基苯甲酸。存在 于柳树和水杨树皮中。水杨酸为无色针状晶体,熔点159℃,在79℃时升华,易 溶于热水、乙醇、乙醚和氯仿。水杨酸易被氧化、遇三氯化铁显紫红色,酸性比 苯甲酸强、加热易脱羧,具有酚和羧酸的一般性质。 乙酰水杨酸的商品名为阿司匹林(aspirin)。可用水杨酸与乙酸酐在少量浓硫 酸存在下反应制得。 乙酰水杨酸 COOH OH + (CH3CO)2O + CH3COOH 浓硫酸 COOH OCCH3 O 乙酰水杨酸为白色针状晶体,微溶于水。乙酰水杨酸具有解热、镇痛、消炎、 抗风湿及抗血小板聚集作用,是常用的解热镇痛药。为了减小阿司匹林对胃的刺 激性,目前常使用肠溶性阿司匹林。 二、羰 基 酸 1.丙酮酸 丙酮酸(CH3COCOOH)是最简单的α-酮酸,为无色液体,有刺激 性气味,沸点165℃(分解),易溶于水。丙酮酸是动植物体内糖、脂肪、蛋白质