
第二节蛋白质的分离纯化 一、蛋白质分离提纯的一般原则 高纯度、高活性、高回收率
第二节 蛋白质的分离纯化 一、蛋白质分离提纯的一般原则 高纯度、高活性、高回收率

二、蛋白质的分离方法 (一)根据分子大小不同的分离方法 l.透析(dialysis)和超滤(ultrafiltration) 半透膜(玻璃纸,火棉纸) 透析常用于蛋白质溶液的除盐 超滤常用于蛋白质溶液的除盐、浓缩
二、蛋白质的分离方法 1.透析(dialysis)和超滤(ultrafiltration) 半透膜 (玻璃纸,火棉纸) 透析常用于蛋白质溶液的除盐 超滤常用于蛋白质溶液的除盐、浓缩 (一)根据分子大小不同的分离方法

2.密度梯度离心 (density gradient ultracentrifugation) 常见有蔗糖密度梯度(连续、不连续) 质量和密度大的蛋白质分子沉降快
2. 密度梯度离心 (density gradient ultracentrifugation) 常见有蔗糖密度梯度(连续、不连续) 质量和密度大的蛋白质分子沉降快
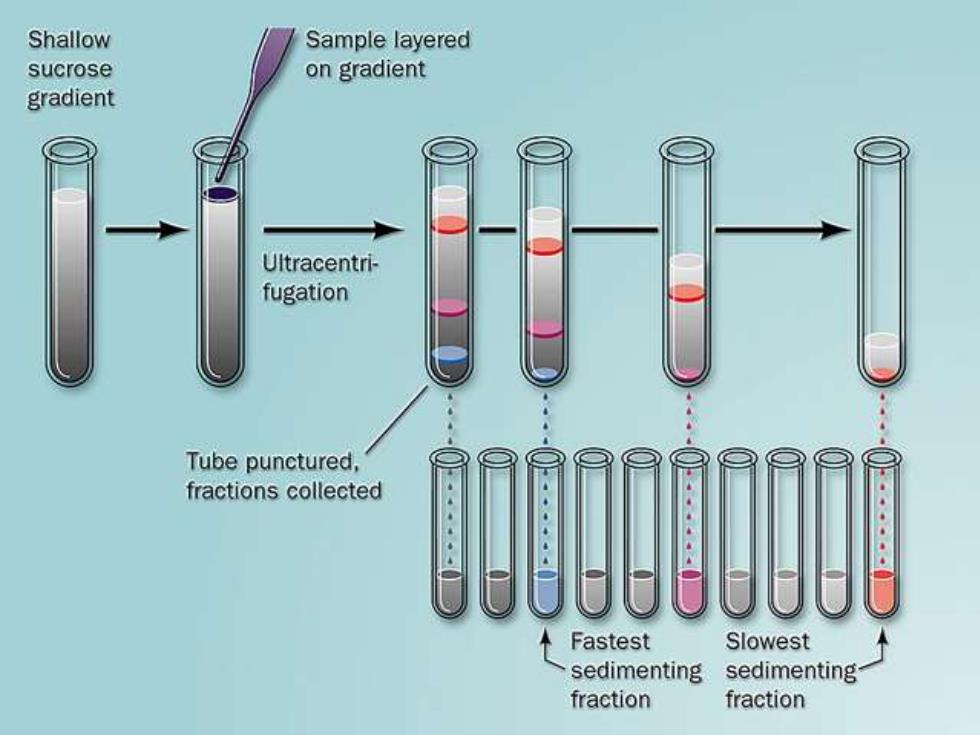
Shallow Sample layered sucrose on gradient gradient Ultracentri- fugation Tube punctured, fractions collected Fastest Slowest sedimenting sedimenting fraction fraction

3.凝胶过滤(gel filtration chromatography) 分子筛层析,分子排阻层析 Sephadex G-50分离范围:1500-30000 交联葡聚糖 (Sephadex) 聚丙烯酰胺凝胶(Bio-GelP) 琼脂糖凝胶 (Sepharose,Bio-GelA)
3.凝胶过滤(gel filtration chromatography) 分子筛层析,分子排阻层析 Sephadex G-50 分离范围:1 500-30 000 交联葡聚糖 (Sephadex) 聚丙烯酰胺凝胶 (Bio-Gel P) 琼脂糖凝胶 (Sepharose,Bio-Gel A)
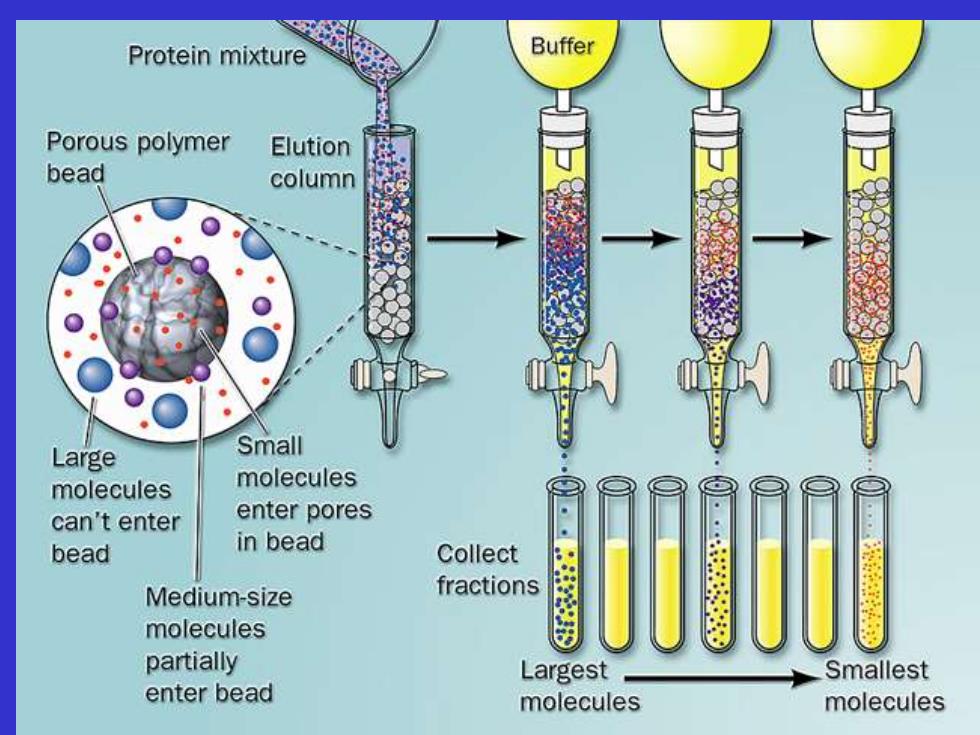
Protein mixture Buffer Porous polymer Elution bead column Large Small molecules molecules can't enter enter pores bead in bead Collect Medium-size fractions molecules partially Largest Smallest enter bead molecules molecules

凝胶过滤原理 根据蛋白质分子大小用凝胶作为介质分 离蛋白质的一种柱层析方法。 比凝胶网孔大的分子被排阻在凝胶颗粒 外,而最先流出柱外;比网孔小的分子 能不同程度的自由出入凝胶颗粒的内外, 洗脱路径长,因而得到分离
凝胶过滤原理 根据蛋白质分子大小用凝胶作为介质分 离蛋白质的一种柱层析方法。 比凝胶网孔大的分子被排阻在凝胶颗粒 外,而最先流出柱外;比网孔小的分子 能不同程度的自由出入凝胶颗粒的内外, 洗脱路径长,因而得到分离

(二)利用溶解度差别的分离方法 1.等电点沉淀 2.蛋白质的盐溶与盐析 3.有机溶剂分离法 4.温度对蛋白质溶解度的影响
(二)利用溶解度差别的分离方法 1. 等电点沉淀 2. 蛋白质的盐溶与盐析 3. 有机溶剂分离法 4. 温度对蛋白质溶解度的影响

(三)根据电荷不同的分离方法 l电泳(electrophoresis 在一定的电场和介质中,蛋白质迁移速度 与蛋白质分子量、所带申荷及分子形状有 关。 迁移率三某一蛋白条带移动距离/前沿到达距离
(三)根据电荷不同的分离方法 1 电泳(electrophoresis) 在一定的电场和介质中,蛋白质迁移速度 与蛋白质分子量、所带电荷及分子形状有 关。 迁移率=某一蛋白条带移动距离/前沿到达距离

a.聚丙烯酰胺凝胶电泳(PAGE) 丙烯酰胺和交联试剂(甲叉双丙烯酰胺)在过 硫酸铵催化下聚合而成。 可以控制孔径大小
a. 聚丙烯酰胺凝胶电泳(PAGE) 丙烯酰胺 和 交联试剂(甲叉双丙烯酰胺)在过 硫酸铵催化下聚合而成。 可以控制孔径大小