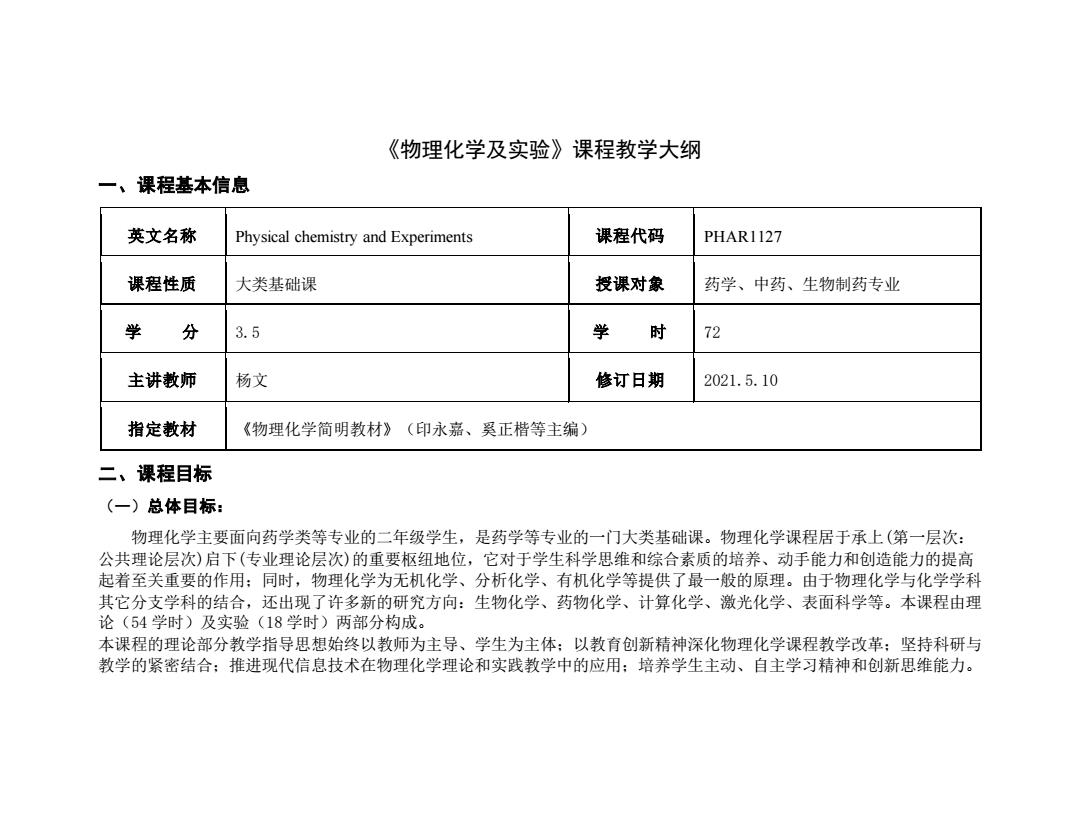
《物理化学及实验》课程教学大纲 一、课程基本信息 英文名称 Physical chemistry and Experiments 课程代码 PHARI127 课程性质 大类基础课 授课对象 药学、中药、生物制药专业 学 分 3.5 学 时 72 主讲教师 杨文 修订日期 2021.5.10 指定教材 《物理化学简明教材》(印永嘉、奚正楷等主编) 二、课程目标 (一)总体目标: 物理化学主要面向药学类等专业的二年级学生,是药学等专业的一门大类基础课。物理化学课程居于承上(第一层次: 公共理论层次)启下(专业理论层次)的重要枢纽地位,它对于学生科学思维和综合素质的培养、动手能力和创造能力的提高 起着至关重要的作用:同时,物理化学为无机化学、分析化学、有机化学等提供了最一般的原理。由于物理化学与化学学科 其它分支学科的结合,还出现了许多新的研究方向:生物化学、药物化学、计算化学、激光化学、表面科学等。本课程由理 论(54学时)及实验(18学时)两部分构成。 本课程的理论部分教学指导思想始终以教师为主导、学生为主体:以教育创新精神深化物理化学课程教学改革:坚持科研与 教学的紧密结合:推进现代信息技术在物理化学理论和实践教学中的应用:培养学生主动、自主学习精神和创新思维能力
《物理化学及实验》课程教学大纲 一、课程基本信息 英文名称 Physical chemistry and Experiments 课程代码 PHAR1127 课程性质 大类基础课 授课对象 药学、中药、生物制药专业 学 分 3.5 学 时 72 主讲教师 杨文 修订日期 2021.5.10 指定教材 《物理化学简明教材》(印永嘉、奚正楷等主编) 二、课程目标 (一)总体目标: 物理化学主要面向药学类等专业的二年级学生,是药学等专业的一门大类基础课。物理化学课程居于承上(第一层次: 公共理论层次)启下(专业理论层次)的重要枢纽地位,它对于学生科学思维和综合素质的培养、动手能力和创造能力的提高 起着至关重要的作用;同时,物理化学为无机化学、分析化学、有机化学等提供了最一般的原理。由于物理化学与化学学科 其它分支学科的结合,还出现了许多新的研究方向:生物化学、药物化学、计算化学、激光化学、表面科学等。本课程由理 论(54 学时)及实验(18 学时)两部分构成。 本课程的理论部分教学指导思想始终以教师为主导、学生为主体;以教育创新精神深化物理化学课程教学改革;坚持科研与 教学的紧密结合;推进现代信息技术在物理化学理论和实践教学中的应用;培养学生主动、自主学习精神和创新思维能力
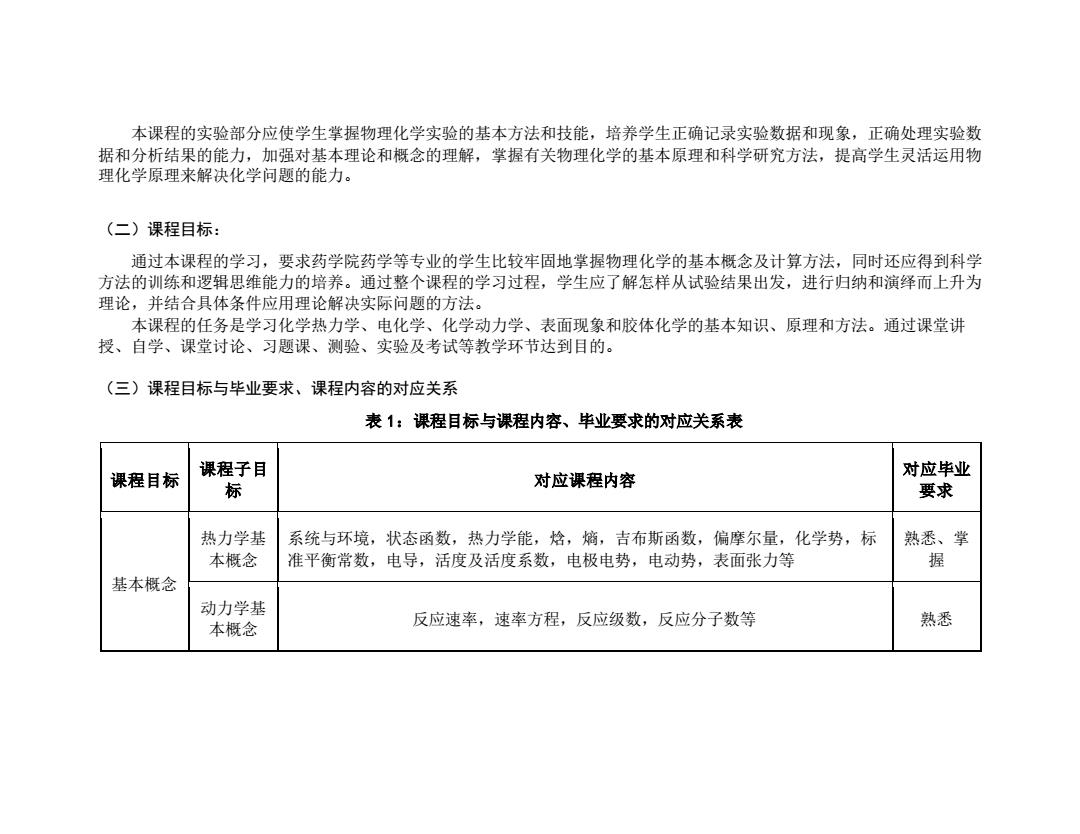
本课程的实验部分应使学生掌握物理化学实验的基本方法和技能,培养学生正确记录实验数据和现象,正确处理实验数 据和分析结果的能力,加强对基本理论和概念的理解,掌握有关物理化学的基本原理和科学研究方法,提高学生灵活运用物 理化学原理来解决化学问题的能力。 (二)课程目标: 通过本课程的学习,要求药学院药学等专业的学生比较牢固地掌握物理化学的基本概念及计算方法,同时还应得到科学 方法的训练和逻辑思维能力的培养。通过整个课程的学习过程,学生应了解怎样从试验结果出发,进行归纳和演绎而上升为 理论,并结合具体条件应用理论解决实际问题的方法。 本课程的任务是学习化学热力学、电化学、化学动力学、表面现象和胶体化学的基本知识、原理和方法。通过课堂讲 授、自学、课堂讨论、习题课、测验、实验及考试等教学环节达到目的。 (三)课程目标与毕业要求、课程内容的对应关系 表1:课程目标与课程内容、毕业要求的对应关系表 课程目标 课程子目 对应毕业 标 对应课程内容 要求 热力学基 系统与环境,状态函数,热力学能,焓,熵,吉布斯函数,偏摩尔量,化学势,标 熟悉、掌 本概念 准平衡常数,电导,活度及活度系数,电极电势,电动势,表面张力等 握 基本概念 动力学基 本概念 反应速率,速率方程,反应级数,反应分子数等 熟悉
本课程的实验部分应使学生掌握物理化学实验的基本方法和技能,培养学生正确记录实验数据和现象,正确处理实验数 据和分析结果的能力,加强对基本理论和概念的理解,掌握有关物理化学的基本原理和科学研究方法,提高学生灵活运用物 理化学原理来解决化学问题的能力。 (二)课程目标: 通过本课程的学习,要求药学院药学等专业的学生比较牢固地掌握物理化学的基本概念及计算方法,同时还应得到科学 方法的训练和逻辑思维能力的培养。通过整个课程的学习过程,学生应了解怎样从试验结果出发,进行归纳和演绎而上升为 理论,并结合具体条件应用理论解决实际问题的方法。 本课程的任务是学习化学热力学、电化学、化学动力学、表面现象和胶体化学的基本知识、原理和方法。通过课堂讲 授、自学、课堂讨论、习题课、测验、实验及考试等教学环节达到目的。 (三)课程目标与毕业要求、课程内容的对应关系 表 1:课程目标与课程内容、毕业要求的对应关系表 课程目标 课程子目 标 对应课程内容 对应毕业 要求 基本概念 热力学基 本概念 系统与环境,状态函数,热力学能,焓,熵,吉布斯函数,偏摩尔量,化学势,标 准平衡常数,电导,活度及活度系数,电极电势,电动势,表面张力等 熟悉、掌 握 动力学基 本概念 反应速率,速率方程,反应级数,反应分子数等 熟悉
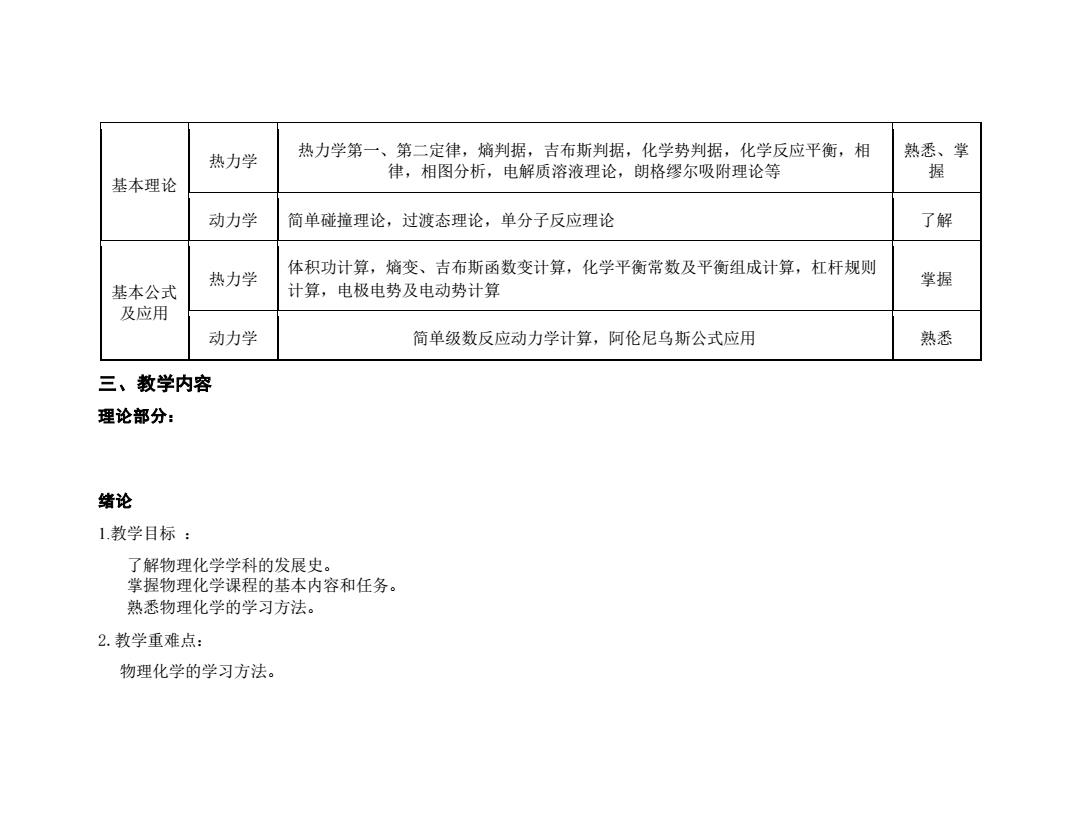
热力学 热力学第一、第二定律,熵判据,吉布斯判据,化学势判据,化学反应平衡,相 熟悉、掌 律,相图分析,电解质溶液理论,朗格缪尔吸附理论等 握 基本理论 动力学 简单碰撞理论,过渡态理论,单分子反应理论 了解 热力学 体积功计算,熵变、吉布斯函数变计算,化学平衡常数及平衡组成计算,杠杆规则 掌握 基本公式 计算,电极电势及电动势计算 及应用 动力学 简单级数反应动力学计算,阿伦尼乌斯公式应用 熟悉 三、教学内容 理论部分: 绪论 1教学目标: 了解物理化学学科的发展史。 掌握物理化学课程的基本内容和任务。 熟悉物理化学的学习方法。 2.教学重难点: 物理化学的学习方法
基本理论 热力学 热力学第一、第二定律,熵判据,吉布斯判据,化学势判据,化学反应平衡,相 律,相图分析,电解质溶液理论,朗格缪尔吸附理论等 熟悉、掌 握 动力学 简单碰撞理论,过渡态理论,单分子反应理论 了解 基本公式 及应用 热力学 体积功计算,熵变、吉布斯函数变计算,化学平衡常数及平衡组成计算,杠杆规则 计算,电极电势及电动势计算 掌握 动力学 简单级数反应动力学计算,阿伦尼乌斯公式应用 熟悉 三、教学内容 理论部分: 绪论 1.教学目标 : 了解物理化学学科的发展史。 掌握物理化学课程的基本内容和任务。 熟悉物理化学的学习方法。 2.教学重难点: 物理化学的学习方法

3.教学内容: 物理化学的发展史:物理化学的基本内容和任务:物理化学的学习方法:数学知识复习。4.教学方法:课堂讲授 5.教学评价:书面作业 第一章热力学第一定律 1.教学目标: 掌握热力学基本概念:系统,环境,状态函数,过程,途径,功,热,热力学能,焓,热容,反应进度。 掌握热力学第一定律及应用。 熟悉各种过程体积功、热、热力学能、焓变的计算。 熟悉由标准摩尔生成焓计算标准摩尔反应焓。 熟悉基尔霍夫方程及其应用。 了解节流膨胀。 2.教学重难点: 热力学中的几个基本概念:热力学第一定律及应用。 3.教学内容: 热力学的目的和内容:热力学的方法和局限性:体系与环境:体系的性质:热力学平衡态和状态函数:状态方程:热和功。 热力学第一定律及数学表达式。功与过程:准静态过程:可逆过程。焓的定义及物理意义。热容的定义:等压热容和等容热 容。理想气体的内能和焓:理想气体的Cp与CV之差:绝热过程的功和过程方程式:理想气体的卡诺循环。焦尔一汤姆逊 效应:实际气体的△U和△H。化学反应的热效应:反应进度:热化学方程式。盖斯定律。化合物的生成焓:燃烧焓。基尔 霍夫定律。 4.教学方法:课堂讲授 5.教学评价:书面作业 第二章热力学第二定律 1.教学目标:
3.教学内容: 物理化学的发展史;物理化学的基本内容和任务;物理化学的学习方法;数学知识复习。4.教学方法 :课堂讲授 5.教学评价:书面作业 第一章 热力学第一定律 1.教学目标 : 掌握热力学基本概念:系统,环境,状态函数,过程,途径,功,热,热力学能,焓,热容,反应进度。 掌握热力学第一定律及应用。 熟悉各种过程体积功、热、热力学能、焓变的计算。 熟悉由标准摩尔生成焓计算标准摩尔反应焓。 熟悉基尔霍夫方程及其应用。 了解节流膨胀。 2.教学重难点: 热力学中的几个基本概念;热力学第一定律及应用。 3.教学内容: 热力学的目的和内容;热力学的方法和局限性;体系与环境;体系的性质;热力学平衡态和状态函数;状态方程;热和功。 热力学第一定律及数学表达式。功与过程;准静态过程;可逆过程。焓的定义及物理意义。热容的定义;等压热容和等容热 容。理想气体的内能和焓;理想气体的 Cp 与 Cv 之差;绝热过程的功和过程方程式;理想气体的卡诺循环。焦尔—汤姆逊 效应;实际气体的 ΔU 和 ΔH。化学反应的热效应;反应进度;热化学方程式。盖斯定律。化合物的生成焓;燃烧焓。基尔 霍夫定律。 4.教学方法 :课堂讲授 5.教学评价:书面作业 第二章 热力学第二定律 1.教学目标 :

掌握热力学第二定律的表述。 掌握熵增原理及其应用」 掌握熵的概念及熵变的计算。 掌握亥姆霍兹函数和吉布斯函数及其应用。 掌握△G的计算。 熟悉标准摩尔反应熵的计算。 熟悉热力学基本方程。 了解热力学第三定律,规定熵和标准熵。 2.教学重难点: 熵增原理及其应用:△G的计算:热力学基本方程。 3.教学内容: 自发变化。热力学第二定律的经典表述。卡诺定理及其推论。可逆过程的热温商-熵函数,不可逆过程的热温商。克劳修 斯不等式:热力学第二定律的数学表达式:熵增原理。熵变的计算及其应用。热力学第二定律的本质:熵的物理意义及规定 熵的计算。亥姆霍兹函数:吉布斯函数。变化的方向及平衡条件。各种过程的△G计算。热力学函数的重要关系式:△G随 温度的变化一吉布斯-亥姆霍兹方程式。 4.教学方法:课堂讲授 5.教学评价:书面作业 第三章化学势 1.教学目标: 掌握偏摩尔量、化学势概念:化学势判据
掌握热力学第二定律的表述。 掌握熵增原理及其应用。 掌握熵的概念及熵变的计算。 掌握亥姆霍兹函数和吉布斯函数及其应用。 掌握ΔG 的计算。 熟悉标准摩尔反应熵的计算。 熟悉热力学基本方程。 了解热力学第三定律,规定熵和标准熵。 2.教学重难点: 熵增原理及其应用;ΔG 的计算;热力学基本方程。 3.教学内容: 自发变化。热力学第二定律的经典表述。卡诺定理及其推论。可逆过程的热温商-熵函数,不可逆过程的热温商。克劳修 斯不等式;热力学第二定律的数学表达式;熵增原理。熵变的计算及其应用。热力学第二定律的本质;熵的物理意义及规定 熵的计算。亥姆霍兹函数;吉布斯函数。变化的方向及平衡条件。各种过程的ΔG 计算。热力学函数的重要关系式;ΔG 随 温度的变化─吉布斯-亥姆霍兹方程式。 4.教学方法 :课堂讲授 5.教学评价:书面作业 第三章 化学势 1.教学目标 : 掌握偏摩尔量、化学势概念;化学势判据

熟悉多组分多相系统的热力学基本公式。 掌握理想气体、理想液态混合物、理想稀溶液各组分化学势的表示方法。 熟悉拉乌尔定律和亨利定律及稀溶液的依数性。 了解活度及活度系数的概念。 2.教学重难点: 偏摩尔量、化学势概念:化学势判据:理想液态混合物、理想稀溶液各组分化学势的表示方法。 3.教学内容: 多组分体系的概念。偏摩尔量的定义:偏摩尔量的集合公式、偏摩尔量的求法*:化学势的定义,拉乌尔定律,亨利定 律。理想液态混合物中物质的化学势:理想稀溶液种物质的化学势:非理想多组分系统中物质的化学势:不挥发性溶质理想 稀溶液的依数性。 4.教学方法:讲授 5.教学评价:书面作业 第四章化学平衡 1.教学目标: 掌握化学反应的等温方程。 掌握理想气体化学反应的标准平衡常数。 掌握平衡组成的计算。 掌握温度对标准平衡常数的影响,范特霍夫方程。 熟悉摩尔反应吉布斯函数与反应进度的关系,平衡条件 熟悉其他因素对理想气体化学平衡的影响
熟悉多组分多相系统的热力学基本公式。 掌握理想气体、理想液态混合物、理想稀溶液各组分化学势的表示方法。 熟悉拉乌尔定律和亨利定律及稀溶液的依数性。 了解活度及活度系数的概念。 2.教学重难点: 偏摩尔量、化学势概念;化学势判据;理想液态混合物、理想稀溶液各组分化学势的表示方法。 3.教学内容: 多组分体系的概念。偏摩尔量的定义;偏摩尔量的集合公式、偏摩尔量的求法*;化学势的定义,拉乌尔定律,亨利定 律。理想液态混合物中物质的化学势;理想稀溶液种物质的化学势;非理想多组分系统中物质的化学势;不挥发性溶质理想 稀溶液的依数性。 4.教学方法 :讲授 5.教学评价:书面作业 第四章 化学平衡 1.教学目标 : 掌握化学反应的等温方程。 掌握理想气体化学反应的标准平衡常数。 掌握平衡组成的计算。 掌握温度对标准平衡常数的影响,范特霍夫方程。 熟悉摩尔反应吉布斯函数与反应进度的关系,平衡条件 熟悉其他因素对理想气体化学平衡的影响

2.教学重难点: 标准平衡常数的概念及平衡常数的各种表示法:物质的标准生成吉布斯自由能△GmΨ与反应过程△Gm的意义:平衡组成 的计算。 3.教学内容: 化学反应的方向和限度、化学反应等温方程,标准平衡常数K”。平衡常数的各种表示法。复相平衡常数表达式:固体分 解压力。平衡常数的实验测定:平衡转化率的计算。标准状态下反应的生成吉布斯函数变化值:标准摩尔生成吉布斯函数。 从吉布斯函数计算平衡常数。温度对化学平衡的影响:压力对化学平衡的影响:惰性气体对化学平衡的影响。 4.教学方法:讲授 5.教学评价:书面作业 第五章多相平衡 1.教学目标: 掌握相律,自由度数,组分数的概念。 掌握克拉佩龙方程和克劳修斯-克拉佩龙方程。 熟悉杠杆规则及其应用。 熟悉单组分系统、二组分系统相图。 了解三组分相图。 2.教学重难点: 相律及其应用:杠杆规则及其应用:二组分系统p-x及T-x相图分析。 3.教学内容: 相、自由度的概念。多相体系平衡的一般条件。组分数的概念:相律的推导。克劳修斯-克拉佩龙方程式,水的相图。完全 互溶双液系(p
2.教学重难点: 标准平衡常数的概念及平衡常数的各种表示法;物质的标准生成吉布斯自由能 ΔrGm 与反应过程 ΔrGm的意义;平衡组成 的计算。 3.教学内容: 化学反应的方向和限度、化学反应等温方程,标准平衡常数 K。平衡常数的各种表示法。复相平衡常数表达式;固体分 解压力。平衡常数的实验测定;平衡转化率的计算。标准状态下反应的生成吉布斯函数变化值;标准摩尔生成吉布斯函数。 从吉布斯函数计算平衡常数。温度对化学平衡的影响;压力对化学平衡的影响;惰性气体对化学平衡的影响。 4.教学方法 :讲授 5.教学评价:书面作业 第五章 多相平衡 1.教学目标 : 掌握相律,自由度数,组分数的概念。 掌握克拉佩龙方程和克劳修斯-克拉佩龙方程。 熟悉杠杆规则及其应用。 熟悉单组分系统、二组分系统相图。 了解三组分相图。 2.教学重难点: 相律及其应用;杠杆规则及其应用;二组分系统 p-x 及 T-x 相图分析。 3.教学内容: 相、自由度的概念。多相体系平衡的一般条件。组分数的概念;相律的推导。克劳修斯-克拉佩龙方程式,水的相图。完全 互溶双液系(p

x图、T X图、杠杆规则、蒸馏与精馏原理)、部分互溶双液系、完全不互溶双液系及水蒸气蒸馏原理。简单低共熔混合物的固一液 体系(热分析法、溶解度法绘制相图):形成稳定化合物和形成不稳定化合物的固一液体系,固态完全互溶、部分互溶的 固一液体系的相图分析。三组分体系的组成表示法,部分互溶的三液系、二固体和一液体的水盐体系相图。 4.教学方法:讲授 5.教学评价:书面作业 第七章电化学 1.教学目标: 掌握电导、电导率、摩尔电导率、极限摩尔电导率、离子的摩尔电导率、离子强度、电解质溶液的标准态、离子活度、平 均活度和平均活度系数的概念。 掌握电导及其应用。 掌握强电解质的活度、活度系数及离子强度概念。 掌握有关电动势的计算、电动势测定的应用:可逆电池热力学及其应用。 熟悉电化学中惯用符号。 熟悉电解质溶液的基本概念和理论。 了解电解作用中的一些规律及不可逆情况下电极上所发生过程的特征。 2.教学重难点: 电化学基本概念:强电解质的活度及活度系数:由化学反应设计可逆电池。 3.教学内容: 电化学基本概念,法拉第定律。离子的迁移现象,离子迁移率和迁移数。电导、电导率与摩尔电导率:电导的测量:浓 度、温度对电导率和摩尔电导率的影响,离子独立运动定律和离子摩尔电导率,电导的测定的一些应用。强电解质的活度及 活度系数,离子强度,强电解质溶液的离子互吸理论,德拜一休格尔极限公式。可逆电池与不可逆电池,电极反应与电池 反应,由化学反应设计可逆电池。可逆电池图式表示法、可逆电池的类型、可逆电池反应热力学量计算。对消法测电动势、 韦斯顿标准电池。电极与电解质溶液界面间电势差的形成、接触电势、液接电势、电动势的产生。标准氢电极和标准电极电
x 图、T x 图、杠杆规则、蒸馏与精馏原理)、部分互溶双液系、完全不互溶双液系及水蒸气蒸馏原理。简单低共熔混合物的固-液 体系(热分析法、溶解度法绘制相图); 形成稳定化合物和形成不稳定化合物的固-液体系,固态完全互溶、部分互溶的 固-液体系的相图分析。三组分体系的组成表示法,部分互溶的三液系、二固体和一液体的水盐体系相图。 4.教学方法 :讲授 5.教学评价:书面作业 第七章 电化学 1.教学目标 : 掌握电导、电导率、摩尔电导率、极限摩尔电导率、离子的摩尔电导率、离子强度、电解质溶液的标准态、离子活度、平 均活度和平均活度系数的概念。 掌握电导及其应用。 掌握强电解质的活度、活度系数及离子强度概念。 掌握有关电动势的计算、电动势测定的应用;可逆电池热力学及其应用。 熟悉电化学中惯用符号。 熟悉电解质溶液的基本概念和理论。 了解电解作用中的一些规律及不可逆情况下电极上所发生过程的特征。 2.教学重难点: 电化学基本概念;强电解质的活度及活度系数;由化学反应设计可逆电池。 3.教学内容: 电化学基本概念,法拉第定律。离子的迁移现象,离子迁移率和迁移数。电导、电导率与摩尔电导率;电导的测量;浓 度、温度对电导率和摩尔电导率的影响,离子独立运动定律和离子摩尔电导率,电导的测定的一些应用。强电解质的活度及 活度系数,离子强度, 强电解质溶液的离子互吸理论,德拜-休格尔极限公式。可逆电池与不可逆电池,电极反应与电池 反应,由化学反应设计可逆电池。可逆电池图式表示法、可逆电池的类型、可逆电池反应热力学量计算。对消法测电动势、 韦斯顿标准电池。电极与电解质溶液界面间电势差的形成、接触电势、液接电势、电动势的产生。标准氢电极和标准电极电

势,可逆电极种类,各种电池电动势的计算。浓差电池,液体接界电势的计算。电极电势及电池电动势的应用。电解和分解 电压的意义。极化现象与过电势:浓差极化、活化极化产生的原因。电解时的电极反应,金属的析出电势。 4.教学方法:讲授 5.教学评价:书面作业 第八章表面现象与分散系统 1.教学目标: 掌握表面自由能、表面张力的概念。 掌握溶液表面张力与溶质、浓度的关系,表面吸附现象与吉布斯吸附公式。 熟悉胶体粒子带电原因、胶团结构、双电层结构和电动电动势的概念。 了解表面活性剂的一些基本性质。 了解溶胶的制备及其性质: 2.教学重难点: 纯液体的表面现象:溶液的表面吸附:溶胶的聚沉。 3.教学内容: 表面吉布斯函数、表面张力、表面张力与温度的关系。弯曲表面下的附加压力、拉普拉斯公式、蒸气压与曲率关系与溶解 度与颗粒大小关系的开尔文方程。液体的铺展,溶液的表面吸附:吉布斯等温吸附方程式。接触角与润湿作用。表面活性剂 的分类:表面活性剂的一些重要作用(乳化、加溶、起泡作用)。吸附等温线:兰格缪尔吸附等温式:物理吸附与化学吸 附。分散系统的分类,胶体的基本特性。布朗运动与扩散、沉降与沉降平衡。丁达尔效应。电泳和电渗现象:胶粒带电原 因:胶团结构。胶体的稳定性:影响聚沉作用的一些因素:电解质聚沉能力的规律。 4.教学方法:讲授 5.教学评价:书面作业
势,可逆电极种类,各种电池电动势的计算。浓差电池,液体接界电势的计算。电极电势及电池电动势的应用。电解和分解 电压的意义。极化现象与过电势;浓差极化、活化极化产生的原因。电解时的电极反应,金属的析出电势。 4.教学方法 :讲授 5.教学评价:书面作业 第八章 表面现象与分散系统 1.教学目标 : 掌握表面自由能、表面张力的概念。 掌握溶液表面张力与溶质、浓度的关系,表面吸附现象与吉布斯吸附公式。 熟悉胶体粒子带电原因、胶团结构、双电层结构和电动电动势的概念。 了解表面活性剂的一些基本性质。 了解溶胶的制备及其性质; 2.教学重难点: 纯液体的表面现象;溶液的表面吸附;溶胶的聚沉。 3.教学内容: 表面吉布斯函数、表面张力、表面张力与温度的关系。弯曲表面下的附加压力、拉普拉斯公式、蒸气压与曲率关系与溶解 度与颗粒大小关系的开尔文方程。液体的铺展,溶液的表面吸附;吉布斯等温吸附方程式。接触角与润湿作用。表面活性剂 的分类;表面活性剂的一些重要作用(乳化、加溶、起泡作用)。吸附等温线;兰格缪尔吸附等温式;物理吸附与化学吸 附。分散系统的分类,胶体的基本特性。布朗运动与扩散、沉降与沉降平衡。丁达尔效应。电泳和电渗现象;胶粒带电原 因;胶团结构。胶体的稳定性;影响聚沉作用的一些因素;电解质聚沉能力的规律。 4.教学方法 :讲授 5.教学评价:书面作业

第九章化学动力学基础 1.教学目标: 掌握反应速率表示方法。 掌握速率方程、动力学方程、简单级数反应的动力学规律。 掌握浓度、温度对反应速率的影响。 了解简单碰撞理论和过渡态理论等反应速率理论和近代微观动力学的一些知识。 2.教学重难点: 零级、一级、二级反应速率方程及其特点:阿累尼乌斯经验公式及其应用。 3.教学内容: 化学动力学的任务和目的。化学反应速率的定义,化学反应速率的表示法。基元反应、反应分子数:反应级数和速率常 数。零级、一级、二级反应速率方程及其特点:反应级数的测定一积分法、微分法、孤立法和过量浓度法、半衰期法。阿累 尼乌斯经验公式及其应用。活化能,活化能与温度的关系,活化能的求算。双分子反应的简单碰撞理论,基元反应的过渡态 理论。 4.教学方法:讲授 5.教学评价:书面作业 第十章复合反应动力学 1.教学目标: 掌握典型复合反应的动力学特征。 掌握复合反应近似处理方法。 了解光化学反应、催化作用
第九章 化学动力学基础 1.教学目标 : 掌握反应速率表示方法。 掌握速率方程、动力学方程、简单级数反应的动力学规律。 掌握浓度、温度对反应速率的影响。 了解简单碰撞理论和过渡态理论等反应速率理论和近代微观动力学的一些知识。 2.教学重难点: 零级、一级、二级反应速率方程及其特点;阿累尼乌斯经验公式及其应用。 3.教学内容: 化学动力学的任务和目的。化学反应速率的定义,化学反应速率的表示法。基元反应、反应分子数;反应级数和速率常 数。零级、一级、二级反应速率方程及其特点;反应级数的测定-积分法、微分法、孤立法和过量浓度法、半衰期法。阿累 尼乌斯经验公式及其应用。活化能,活化能与温度的关系,活化能的求算。双分子反应的简单碰撞理论,基元反应的过渡态 理论。 4.教学方法 :讲授 5.教学评价:书面作业 第十章 复合反应动力学 1.教学目标 : 掌握典型复合反应的动力学特征。 掌握复合反应近似处理方法。 了解光化学反应、催化作用