
第8章电位分析法 第1节 概述 第2节 参比电极 第3节 指示电极 第4节 电位分析法 第5节 电位滴定法
第8章 电位分析法 第1节 概述 第2节 参比电极 第3节 指示电极 第4节 电位分析法 第5节 电位滴定法

第1节 概述 1.电化学分析法 2.电化学分析法的特点 3.电位分析法
1.电化学分析法 2.电化学分析法的特点 3.电位分析法 第1节 概述

第1节 概述 电位分析法是电化学分析法的一个重要组成部分。 1。电化学分析法 利用物质的组成及含量与电化学电池的电学参 量,如电位、电量、电流等有一定关系而建立的 一类分析方法。 根据所测电池的电学量不同主要分为: (1)电位分析法:直接电位法,电位滴定法 (2)电解和库仑分析法 (3)伏安分析法(极谱分析法) (4)电导分析法
电位分析法是电化学分析法的一个重要组成部分。 1.电化学分析法 利用物质的组成及含量与电化学电池的电学参 量,如电位、电量、电流等有一定关系而建立的 一类分析方法。 根据所测电池的电学量不同主要分为: (1)电位分析法:直接电位法,电位滴定法 (2)电解和库仑分析法 (3)伏安分析法(极谱分析法) (4)电导分析法 第1节 概述

2。电化学分析法的特点 (1)准确度高,重现性和稳定性好 (2)灵敏度高,10-4~10-8mo1/L 10-10~10-12mo1/L(极谱,伏安) (3)选择性好(排除干扰) (4)应用广泛(常量、微量和痕量分析) (5)仪器设备简单,易于实现 电位分析实验室 自动化
2.电化学分析法的特点 (1)准确度高,重现性和稳定性好 (2)灵敏度高,10-4~10-8mol/L 10-10 ~10-12 mol/L(极谱,伏安) (3)选择性好(排除干扰) (4)应用广泛(常量、微量和痕量分析) (5)仪器设备简单,易于实现 自动化

3.电位分析法 通过测定含有待测溶液的化学电池(原电池)的电动势, 进而求得溶液中待测组分含量的方法。即利用电极电位与原 电池电解质溶液中某种组分浓度的对应关系而实现定量测量 的电化学分析法。 通常做法:在待测电解质溶液中插入两支性质不同的电极 (指示电极和参比电极),用导线相连组成原电池而测定。 指示电极:电极电位随待测离子活 电位分析实验室 度不同而变化的电极。 参比电极:电极电位值恒定的电极(与被测物无关) 比如,M|M+参比电极
3. 电位分析法 通过测定含有待测溶液的化学电池(原电池)的电动势, 进而求得溶液中待测组分含量的方法。即利用电极电位与原 电池电解质溶液中某种组分浓度的对应关系而实现定量测量 的电化学分析法。 通常做法:在待测电解质溶液中插入两支性质不同的电极 (指示电极和参比电极),用导线相连组成原电池而测定。 指示电极:电极电位随待测离子活 度不同而变化的电极。 参比电极:电极电位值恒定的电极(与被测物无关)。 比如,M ∣M+ ‖参比电极

电位分析的依据是能斯特关系。 若电极的氧化还原体系为: Ox ne-=Red RT In nF aRed 比如:对于金属电极:M|M+(还原态为金属,活度定为1) 则 nF 建立的测量化学电池(原电池):MIM+参比电极 那么 E=中,一中+血(液接电位) =参比一指示 =s比-8NM一nF
电位分析的依据是能斯特关系。 若电极的氧化还原体系为: Ox + n e- = Red Re d O Ox Ox/Red ln a a nF RT = + = n+ + Mn+ O M /M ln a nF RT 比如:对于金属电极:M ∣M+ (还原态为金属,活度定为1) 建立的测量化学电池(原电池):M ∣M+‖参比电极 = − + − + = − = + − − + n M n O M / M ln a nF RT E L 参 比 参 比 指 示 (液接电位) 则 那么
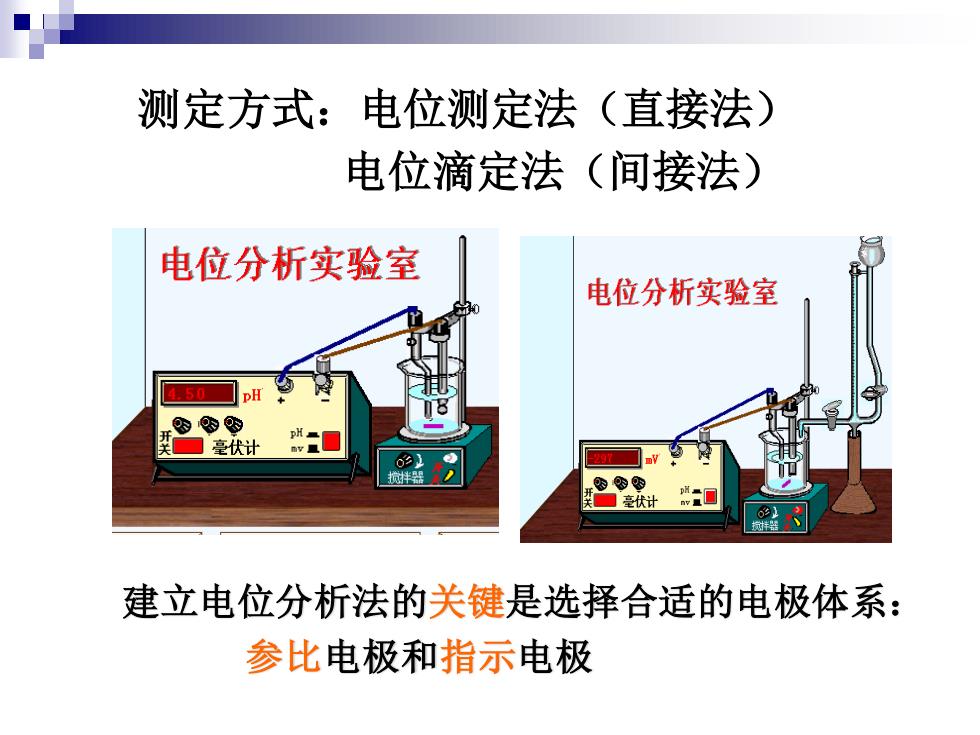
测定方式:电位测定法(直接法) 电位滴定法(间接法) 电位分析实验室 电位分析实验室 5☐pH 08 毫计 建立电位分析法的关键是选择合适的电极体系: 参比电极和指示电极
测定方式:电位测定法(直接法) 电位滴定法(间接法) 建立电位分析法的关键是选择合适的电极体系: 参比电极和指示电极

第2节 参比电极 1.标准氢电极 2.甘汞电极 3.银-氯化银电极
1.标准氢电极 2.甘汞电极 3.银-氯化银电极 第2节 参比电极

参比电极是测量电池电动势,计算电极电位的 基准,因此要求它的电极电位已知而且恒定。 性能要求:参比电极在测量过程中,即使有微 小电流通过,仍能保持不变;它与不同的测试溶液 间的液体接界电位差异很小,数值很低,可以忽略 不计;容易制作,使用寿命长。 重要的参比电极有标准氢电极、甘汞电极、银 -氯化银电极等。其中,标准氢电极是电极电位的 一级基准,甘汞电极、银-氯化银等金属及其难溶 盐的电极作为二级基准,是常用的参比电极
参比电极是测量电池电动势,计算电极电位的 基准,因此要求它的电极电位已知而且恒定。 性能要求:参比电极在测量过程中,即使有微 小电流通过,仍能保持不变;它与不同的测试溶液 间的液体接界电位差异很小,数值很低,可以忽略 不计;容易制作,使用寿命长。 重要的参比电极有标准氢电极、甘汞电极、银 -氯化银电极等。其中,标准氢电极是电极电位的 一级基准,甘汞电极、银-氯化银等金属及其难溶 盐的电极作为二级基准,是常用的参比电极

1.标准氢电极 (standard hydrogen electrode,简写SHE) 把镀有铂黑的铂片浸入a+=1的溶液中,并以p的纯净氢 气不断地冲击到铂片上,即构成了标准氢电极(见图)。 电极符号:H+(a=1)H2(p8),P* 电极反应为: 2Ht+2e→ 1953年,IUPAC规定标准氢电极的电 极电势在任何温度下恒为零,作为电极 标准氢电极 电势的一级基准(如同海拔高度以海平 面作基准一样)。 但直接用SHE作参比很不方便
1.标准氢电极 (standard hydrogen electrode ,简写SHE) 把镀有铂黑的铂片浸入aH+ =1的溶液中,并以pθ的纯净氢 气不断地冲击到铂片上,即构成了标准氢电极(见图)。 电极符号:H+( aH+=1 )|H2(pθ),Pt 电极反应为: 2H++2e→H2 1953年,IUPAC规定标准氢电极的电 极电势在任何温度下恒为零,作为电极 电势的一级基准(如同海拔高度以海平 面作基准一样)。 但直接用SHE作参比很不方便