
4.1水分子的结构和冰 水分子的极性和氢键 2 第4章奇妙的水分子和水资源一 上街工学服 水的结构和性质 水的性质 蒸发和凝聚平衡 ·水的蒸发热大: 40.67 kJ-mol-1(101.3kPa) ·液体的蒸气在整个 ·水的等压热容:。 气相混合物中的分 75.30Jmo1K-1 压等于该液体的平 水的沸点:100℃ 衡(饱和)蒸汽压。 密度反常:4℃为最大 良好的溶剂:极性,氢健 -Oxygen 举例 相对湿度 例4-1:已如莱一天空气的相时湿度为57%,温度为25℃,请问 此时空气中水的分压为多少? ·相对湿度一一一定温度下实际测得的空气 查D98表,水在25℃时的他和蒸汽为3.167kP,40C时的他和蒸汽 中水的分压与水的平衡(饱和)蒸汽压(卫: 为7.38Pa. 根据温度查表)的相对比值。 RH=(p/Pm)x100%-p/3.167)×100%=57% Px-1.805kPa 25C空气中水的分压为1.805kPa RH=(p/peg)×100% RH=(p/Pg)×100%-(p17.376)×100%-57% P米-4204kPa 40C空气中水的分压为4.204kPa 水=P水 想一短 n空P空 相对湿度为10%一空气中的水的分压等于水的平衡分压 桑拿为什么闷(缺氧?为什么天的雨天叫桑拿天? 1
1 第4章 奇妙的水分子和水资源 上海交通大学化学化工学院 大学化学教研室 水分子的极性和氢键 4.1水分子的结构和冰 第 4章奇妙的水分子和水资源 水的性质 • 水的蒸发热大: 40.67 kJ·mol-1(101.3kPa) • 水的等压热容: 75.30 J·mol-1·K-1 水的沸点: 水的结构和性质 第 4章奇妙的水分子和水资源 • 水的沸点:100℃ • 密度反常:4℃为最大 • 良好的溶剂:极性,氢键 蒸发和凝聚平衡 • 液体的蒸气在整个 气相混合物中的分 压等于该液体的平 第 衡(饱和)蒸汽压。 4章奇妙的水分子和水资源 衡(饱和)蒸汽压。 相对湿度 • 相对湿度——一定温度下实际测得的空气 中水的分压与水的平衡(饱和)蒸汽压(peq: 根据温度查表)的相对比值。 第 4章奇妙的水分子和水资源 ( / ) 100% RH p p eq 相对湿度为100%——空气中的水的分压等于水的平衡分压 举例 • 例4-1:已知某一天空气的相对湿度为57%,温度为25C,请问 此时空气中水的分压为多少? • 查p98表,水在25C时的饱和蒸汽为3.167kPa,40C时的饱和蒸汽 为7.38kPa. ( / ) 100% =( / 3.167) 100%=57% RH p p p eq 第 p 水=1 805kPa 25C空气中水的分压为 1 805kPa 4章奇妙的水分子和水资源 ( / ) 100% =( / 7.376) 100%=57% RH p p p eq 25C空气中水的分压为 1.805kPa •桑拿为什么闷(缺氧)? 为什么夏天的雨天叫桑拿天? 想一想 p水=4.204kPa p 水 1.805kPa 40C空气中水的分压为 4.204kPa n p n p 水 水 空 空
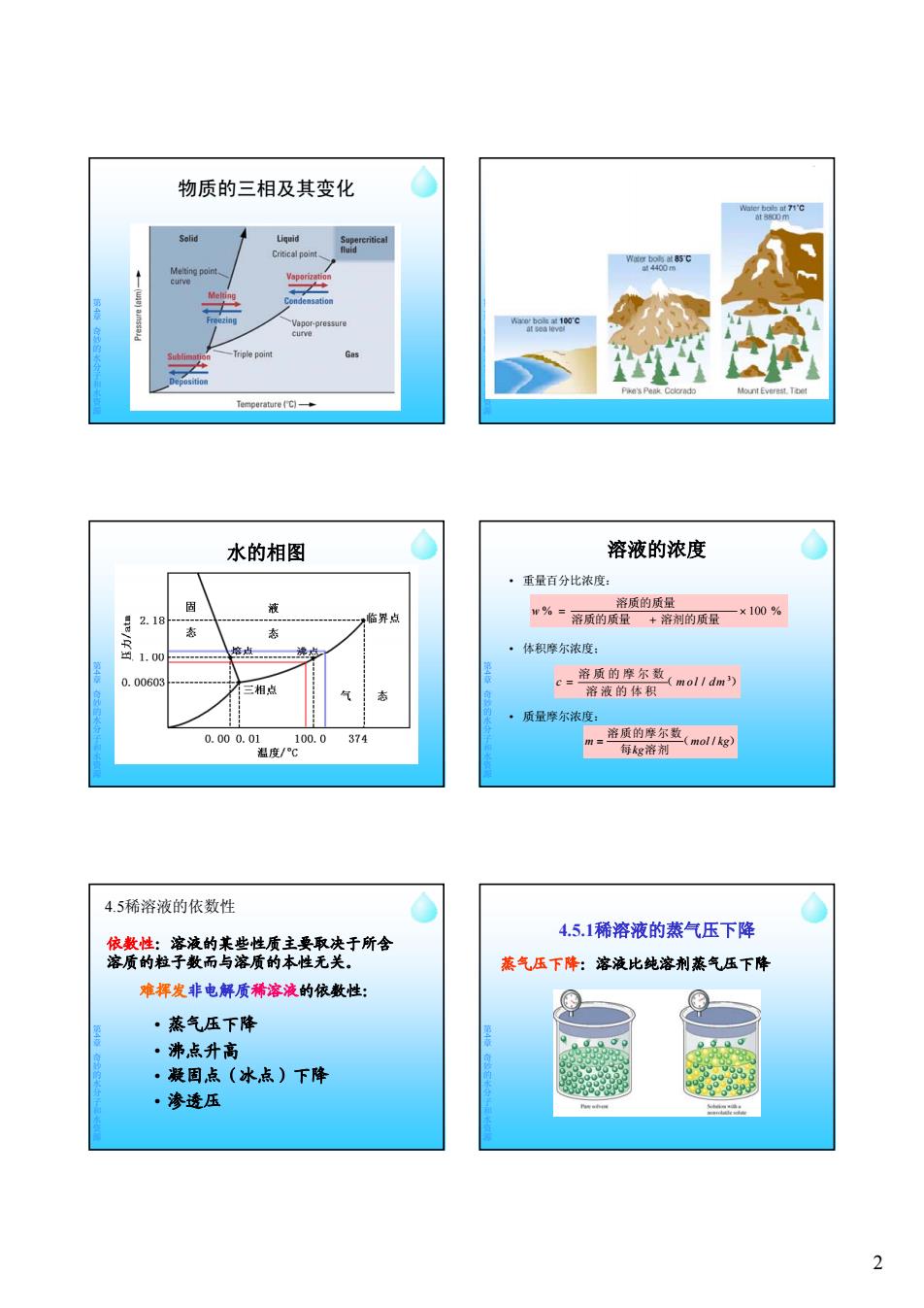
物质的三相及其变化 ater bals at7开'c Liquid Critical poin Cgreniea curve Condensation Vapor-pressure curve -Triple point Pike's Peak Cclcrad Mount Everest.To Temperature (C一+ 水的相图 溶液的浓度 ·重量百分比浓度: 固 液 溶质的质量 2.18 临界点 w%= -×100% 溶质的质量+溶剂的质量 态 态 1.00 培点 点 ·体积摩尔浓度: 0.00603 第章 c=溶质的摩尔数 mol/dm) 三相点 态 溶液的体积 ·质量摩尔浓度: 0.000.01 100.0 374 m三 溶质的摩尔数(m011kg) 温度/℃ 每g溶剂 4.5稀溶液的依数性 4.5.1稀溶液的蒸气压下降 依数性:溶液的某些性质主要取决于所含 溶质的粒子数而与溶质的本性无关。 蒸气压下降:溶液比纯溶剂蒸气压下降 难挥发非电解质稀溶液的依数性: ·蒸气压下降 ·沸,点升高 ·凝固点(冰点)下降 ·渗透压 2
2 物质的三相及其变化 第 4章奇妙的水分子和水资源 第 4章奇妙的水分子和水资源 水的相图 第 4章奇妙的水分子和水资源 溶液的浓度 • 重量百分比浓度: • 体积摩尔浓度; % 100 % 溶质的质量 溶剂的质量 溶质的质量 w 第 4章奇妙的水分子和水资源 • 质量摩尔浓度: 3 c mol dm / 溶质的摩尔数( ) 溶液的体积 m mol kg / kg 溶质的摩尔数( ) 每 溶剂 依数性:溶液的某些性质主要取决于所含 溶质的粒子数而与溶质的本性无关。 蒸气压下降 难挥发非电解质稀溶液的依数性: 4.5稀溶液的依数性 第 4章奇妙的水分子和水资源 • 蒸气压下降 • 沸点升高 • 凝固点(冰点)下降 • 渗透压 蒸气压下降:溶液比纯溶剂蒸气压下降 4.5.1稀溶液的蒸气压下降 第 4章奇妙的水分子和水资源
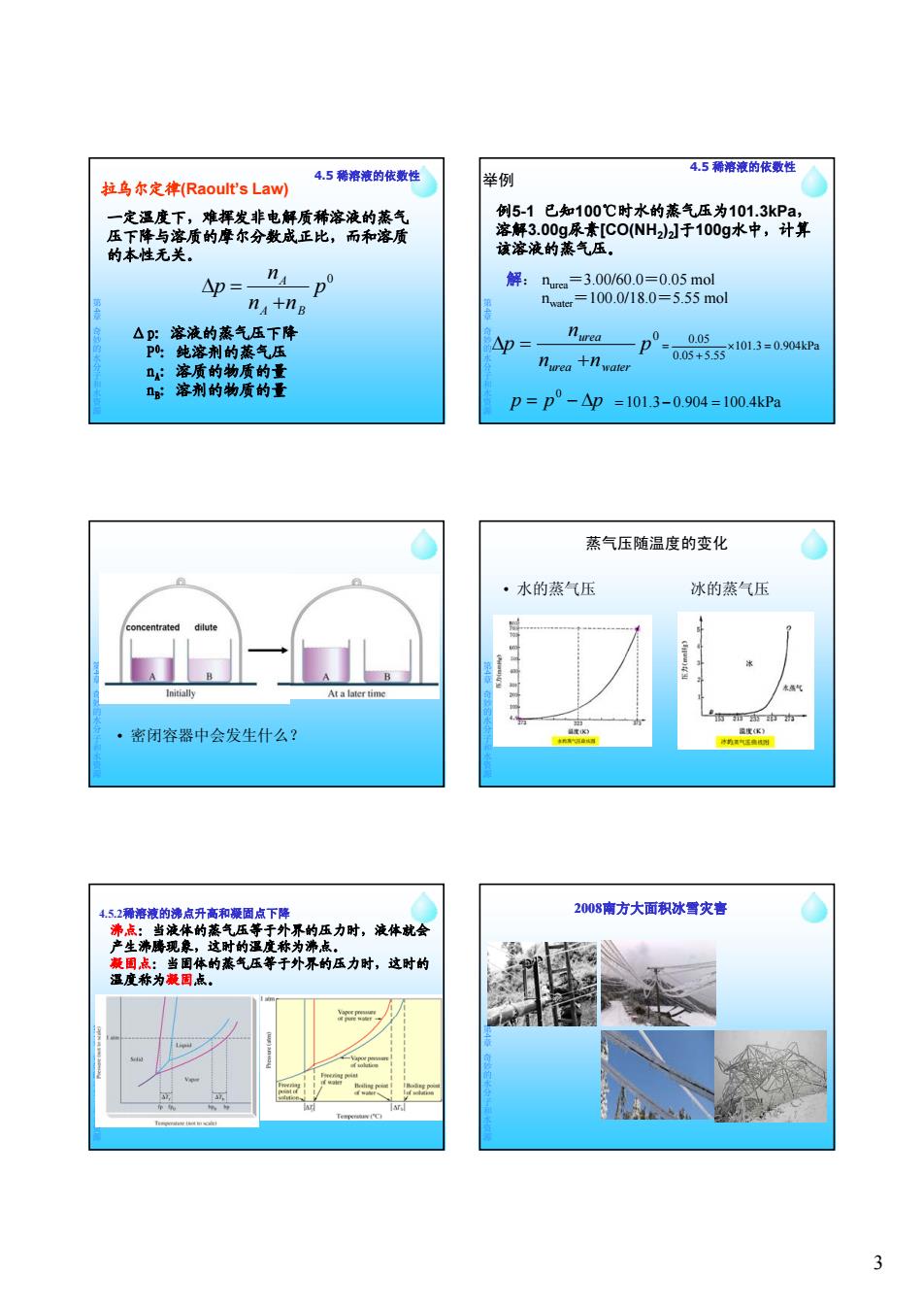
4.5稀溶液的依数性 4.5稀溶液的依数性 拉乌尔定律(Raoult'sLaw) 举例 一定温度下,难挥发非电解质稀溶液的蒸气 例5-1已知100℃时水的蒸气压为101.3kPa, 压下降与溶质的摩尔分数成正比,而和溶质 溶解3.00g尿素[C0(NH2)2于100g水中,计算 的本性无关。 该溶液的蒸气压。 △p=- nA p° 解:Durca=3.00/60.0=0.05mol na+nB nwatcr=100.0/18.0=5.55mol △p:溶液的蒸气压下降 P:纯溶剂的蒸气压 △p= nurea D= 0.05 ×101.3=0.904kPa n: 溶质的物质的量 nnea十1water 0.05+5.55 g:溶剂的物质的量 p=p°-△p =101.3-0.904=100.4kPa 蒸气压随温度的变化 ·水的蒸气压 冰的蒸气压 concentrated dilute Initially At a later time ·密闭容器中会发生什么? 温度K) 协的运身风则 4.52稀溶液的沸点升高和凝固点下降 2008南方大面积冰雪灾喜 沸点:当液体的蒸气压等于外界的压力时,液体就会 产生冰鹰现象,这时的温度称为沸点。 兼围点:当国体的蒸气压等于外界的压力时,这时的 温度称为凝固点。 3
3 4.5 稀溶液的依数性 一定温度下,难挥发非电解质稀溶液的蒸气 压下降与溶质的摩尔分数成正比,而和溶质 的本性无关。 拉乌尔定律(Raoult’s Law) 0 p n p A 第 4章奇妙的水分子和水资源 p n n p A B Δp: 溶液的蒸气压下降 P0: 纯溶剂的蒸气压 nA: 溶质的物质的量 nB: 溶剂的物质的量 4.5 稀溶液的依数性 例5-1 已知100℃时水的蒸气压为101.3kPa, 溶解3.00g尿素[CO(NH2)2]于100g水中,计算 该溶液的蒸气压。 解: nurea=3.00/60.0=0.05 mol 举例 第 4章奇妙的水分子和水资源 nwater=100.0/18.0=5.55 mol 0 p n n n p urea water urea p p p 0 101.3 0.904kPa 0.05 5.55 0.05 101.3 0.904 100.4kPa 第 4章奇妙的水分子和水资源 • 密闭容器中会发生什么? 蒸气压随温度的变化 • 水的蒸气压 冰的蒸气压 第 4章奇妙的水分子和水资源 沸点:当液体的蒸气压等于外界的压力时,液体就会 产生沸腾现象,这时的温度称为沸点。 凝固点:当固体的蒸气压等于外界的压力时,这时的 温度称为凝固点。 4.5.2稀溶液的沸点升高和凝固点下降 第 4章奇妙的水分子和水资源 2008南方大面积冰雪灾害 第 4章奇妙的水分子和水资源

稀溶液时: 4.5稀溶液的依数性 例 4.5稀溶液的依数性 1000g落剂中所含 △T沸=K沸m 溶质的物质的量 纯苯的凝固点为5.40℃,0.322g蒸溶于80g苯, 配制成的溶液的凝固点为5.24℃。已知苯的K黄 △T凝=K凝m 瓜溶液的质量摩尔浓度 值为5.12,求蒸的摩尔质量。 (:沸点上升常数 解: 藏:凝固点下降常数 △T藏 5.40-5.24 m= =0.0313mol-kg 一些溶剂的凝固,点下降常数和沸点上升常数 K麻 5.12 溶剂凝固点(℃)Ka(Kkgmol)沸点(C)K(K-kgmoh 乙酸 17 39 118.1 2.93 0.322/M m= =0.0313 苯 5.48 5.12 802 2.53 80/1000 -63.5 4.68 62.3 3.63 M=128.6gmo l.WL:1217 80 6.8 水 0 1.86 100.0 051 故萘的摩尔质量为128.6 4.5.4稀溶液的渗透压 范托夫(J.H.Vant.Hof刊方程:4.5稀溶液的依数性 半透膜:只允许 非电解质稀溶液渗透压的大小与溶液浓度的关系 水分子自由通过 而不允许溶质分 子或离子通过的 膜状物质 Π.V=n·RT或Π=c.RT 如:细胞膜、肠 衣、牛皮纸 Ⅱ:溶液的渗透压,kPa Y:溶液的体积,d血3 渗逢压:因溶液中的溶剂分子可以通过半透膜,而 :溶质的物质的量,mo1 溶质分于不能透过半透膜而产生的压力,以特号Π c:溶液的浓度,mol*dm-3 表示, 4.5稀溶液的依数性 4.5稀溶液的依数性 输液和渗透 溶液渗透压现象 >植物细胞汁的渗透压可达20×105Pa >人体血液平均的渗透压为7.7×105Pa >食物过咸、排汗过多,组织中的渗透压升高 >淡水中游泳时,眼球容易“红胀” >静脉注射或输液时采用“等渗液”:0.9% 的生理盐水;5.0%的葡萄糖溶液 4
4 稀溶液时: T K m T K m 凝 凝 沸 沸 m: 溶液的质量摩尔浓度 K沸: 沸点上升常数 K凝: 凝固点下降常数 1000g 溶剂中所含 溶质的物质的量 4.5 稀溶液的依数性 第 4章奇妙的水分子和水资源 一些溶剂的凝固点下降常数和沸点上升常数 溶剂 凝固点(℃) K凝(K·kg·mol-1) 沸点(℃) K沸(K·kg·mol-1) 乙酸 17 3.9 118.1 2.93 苯 5.48 5.12 80.2 2.53 氯仿 -63.5 4.68 62.3 3.63 萘 80 6.8 - - 水 0 1.86 100.0 0.51 纯苯的凝固点为5.40℃,0.322g萘溶于80g苯, 配制成的溶液的凝固点为5.24℃。已知苯的K凝 值为5.12,求萘的摩尔质量。 解: T凝 m 4.5 稀溶液的依数性 1 0 0313 5.40 5.24 mol kg 例 第 4章奇妙的水分子和水资源 Naphthalene Mol. Wt.: 128.17 K 凝 m 1 128.6 0.0313 80 /1000 0.322 / M g mol M m 故萘的摩尔质量为128.6 0.0313 5.12 mol kg 半透膜:只允许 水分子自由通过 而不允许溶质分 子或离子通过的 膜状物质 4.5.4稀溶液的渗透压 第 4章奇妙的水分子和水资源 渗透压:因溶液中的溶剂分子可以通过半透膜,而 溶质分子不能透过半透膜而产生的压力,以符号Π 表示。 膜状物质 如:细胞膜、肠 衣、牛皮纸 非电解质稀溶液渗透压的大小与溶液浓度的关系 范托夫(J.H.Vant. Hoff)方程: V n RT 或 c RT 4.5 稀溶液的依数性 第 4章奇妙的水分子和水资源 V nRT Π: 溶液的渗透压,kPa V: 溶液的体积,dm-3 n: 溶质的物质的量,mol c: 溶液的浓度,mol·dm-3 或 c RT 植物细胞汁的渗透压可达 20×105Pa 人体血液平均的渗透压为 7.7×105Pa 食物过咸、排汗过多,组织中的渗透压升高 4.5 稀溶液的依数性 溶液渗透压现象 第 4章奇妙的水分子和水资源 食物过咸、排汗过多,组织中的渗透压升高 淡水中游泳时,眼球容易“红胀” 静脉注射或输液时采用“等渗液”:0.9% 的生理盐水;5.0%的葡萄糖溶液 输液和渗透 4.5 稀溶液的依数性 第 4章奇妙的水分子和水资源

5.1.2稀溶液的依数性 例 1dm-3溶液中含5.0g马的血红素,在 太空水和反渗透 Side A Side E 298K时测得溶液的渗透压为1.80×102Pa, Pure water Saltwate 求马的血红素的摩尔质量。 Membrane 解:Π·V=n·RT= m RT M M=mRT_5.0×8.314×298 =6.9×10gmor1 ΠV 180×10-3×1 电解质溶液的渗透压 应用 ·依数性—粒子的数量 ·电解质溶液的修正 -沸点上升: ATb =Kb.m-i 凝固点下降 △Tf=Kfmi 一渗透压: π=ic~R.T i van't Hoff factor. Concentration Compound 0.100m 0.0100 m 0.00100m 1.00 100 1 1.9 197 K SO 232 270 2.8别 300 121 15J 182 200 几种常见物质的热容(J/gK) 溶液渗透压的应用 Ammonia,NH, 4.70 Liquid water,H.O 4.184 Ethylene glycol,C.H O 2.42 Ice,H2O 2.01 Water vapor,H2O 2.0 进授 Aluminum,Al 0.90 Iron,Fe 0.451 Silver,Ag 024 Gold,Au 13 5
5 太空水和反渗透 第 4章奇妙的水分子和水资源 1dm-3溶液中含5.0g马的血红素,在 298K时测得溶液的渗透压为1.80×102Pa, 求马的血红素的摩尔质量。 解: 例 m V n RT RT M 5.1.2 稀溶液的依数性 第 4章奇妙的水分子和水资源 M 4 1 3 5.0 8.314 298 6.9 10 180 10 1 mRT M g mol V 电解质溶液的渗透压 • 依数性——粒子的数量 • 电解质溶液的修正 – 沸点上升: – 凝固点下降: Tb Kb mi T K m i f f 第 4章奇妙的水分子和水资源 凝固点下降 – 渗透压: i = van’t Hoff factor. f f icRT 应用 第 4章奇妙的水分子和水资源 溶液渗透压的应用 第 4章奇妙的水分子和水资源 几种常见物质的热容(J/g·K) Ammonia, NH3 4.70 Liquid water , H2O 4.184 Ethylene glycol, C2H6O2 2.42 Ice , H2O 2.01 第 4章奇妙的水分子和水资源 Ice , H2O 2.01 Water vapor, H2O 2.0 Aluminum, Al 0.90 Iron, Fe 0.451 Silver, Ag 0.24 Gold, Au 0.13

t-f 1g冰,水,水蒸汽的体积随湿度的变化 b
6 第 4章奇妙的水分子和水资源 第 4章奇妙的水分子和水资源 1g冰,水,水蒸汽的体积随温度的变化