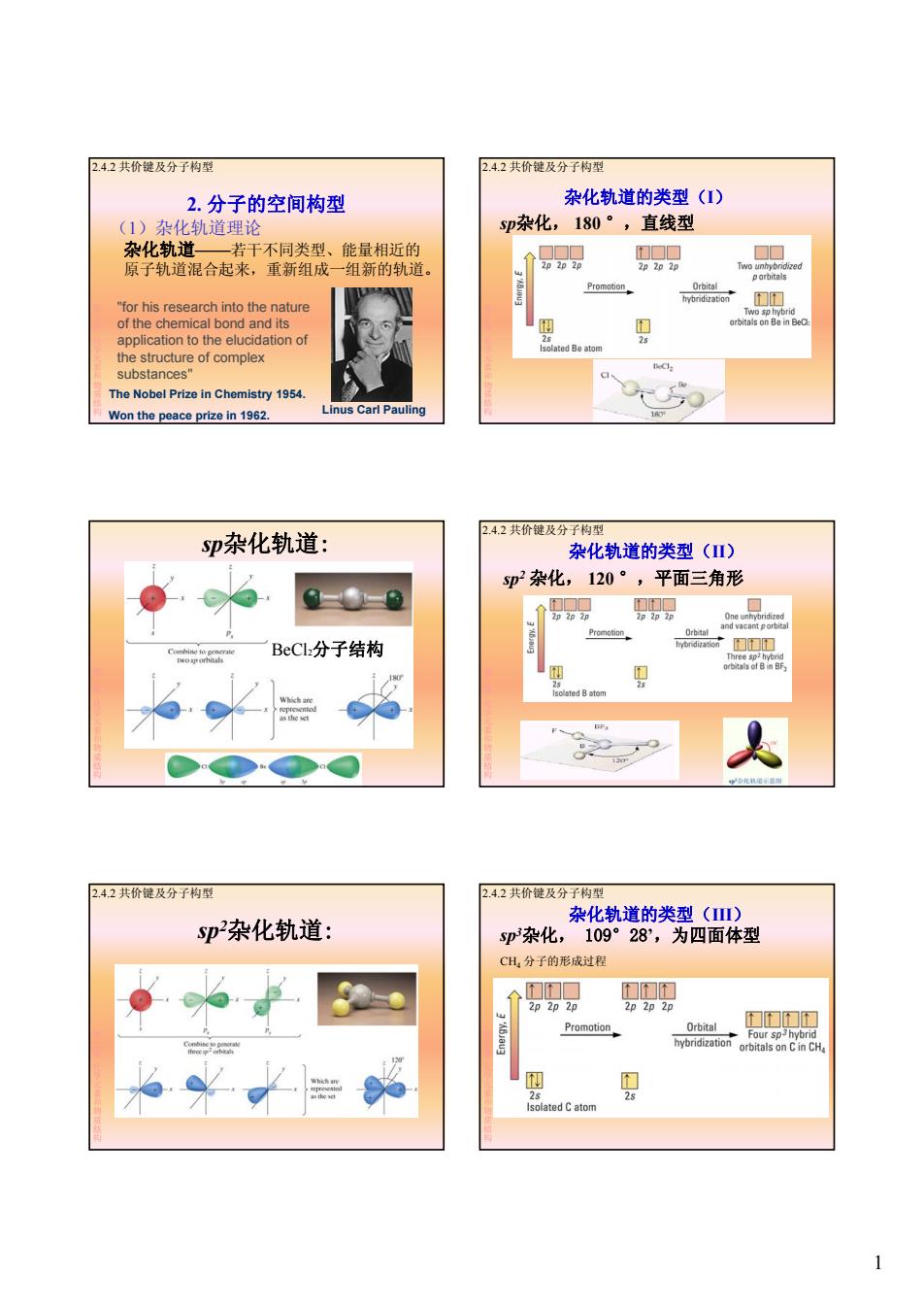
2.4.2共价键及分子构型 2.4.2共价键及分子构型 2.分子的空间构型 杂化轨道的类型(I) (1)杂化轨道理论 sp杂化,180°,直线型 杂化轨道一若干不同类型、 能量相近的 □□ 原子轨道混合起来,重新组成一组新的轨道。 2p2p 2p 2p 2p2p Two unhy Promotion Orbital "for his research into the nature 门 Two sp hybrid of the chemical bond and its orbitals on Be in BeC application to the elucidation of 25 Isolated Be atom the structure of complex substances" The Nobel Prize in Chemistry 1954. Won the peace prize in 1962. Linus Carl Pauling 180 2.4.2共价键及分子构型 Sp杂化轨道: 杂化轨道的类型(Ⅲ) Sp2杂化,120°,平面三角形 面图圆 2p2p2p 2p2p 2p Promotion and vacant pon由ta Orb tal BeCl分子结构 16m3 bridization下TT 县 itBi时, Isolated B atom nF. F 。化道用 2.4.2共价键及分子构型 2.4.2共价键及分子构型 杂化轨道的类型(Ⅲ) Sp杂化轨道: sp杂化,109°28',为四面体型 CH,分子的形成过程 和们口 们们和 2p 2p 2p 2p 2p 2p M们 61a0g Promotion Orbital hybridization Four sp3hybrid orbitals on C in CHa 四 2s 25 Isolated C atom
1 2. 分子的空间构型 (1)杂化轨道理论 杂化轨道——若干不同类型、能量相近的 原子轨道混合起来,重新组成一组新的轨道。 2.4.2 共价键及分子构型 第 2章化学元素和物质结构 "for his research into the nature of the chemical bond and its application to the elucidation of the structure of complex substances" Linus Carl Pauling The Nobel Prize in Chemistry 1954. Won the peace prize in 1962. 杂化轨道的类型(I) sp杂化, 180 °,直线型 2.4.2 共价键及分子构型 第 2章化学元素和物质结构 sp杂化轨道: BeCl2分子结构 第 2章化学元素和物质结构 BeCl2分子结构 sp2 杂化, 120 °,平面三角形 2.4.2 共价键及分子构型 杂化轨道的类型(II) 第 2章化学元素和物质结构 sp2杂化轨道: 2.4.2 共价键及分子构型 第 2章化学元素和物质结构 sp3杂化, 109°28’,为四面体型 CH4 分子的形成过程 2.4.2 共价键及分子构型 杂化轨道的类型(III) 第 2章化学元素和物质结构
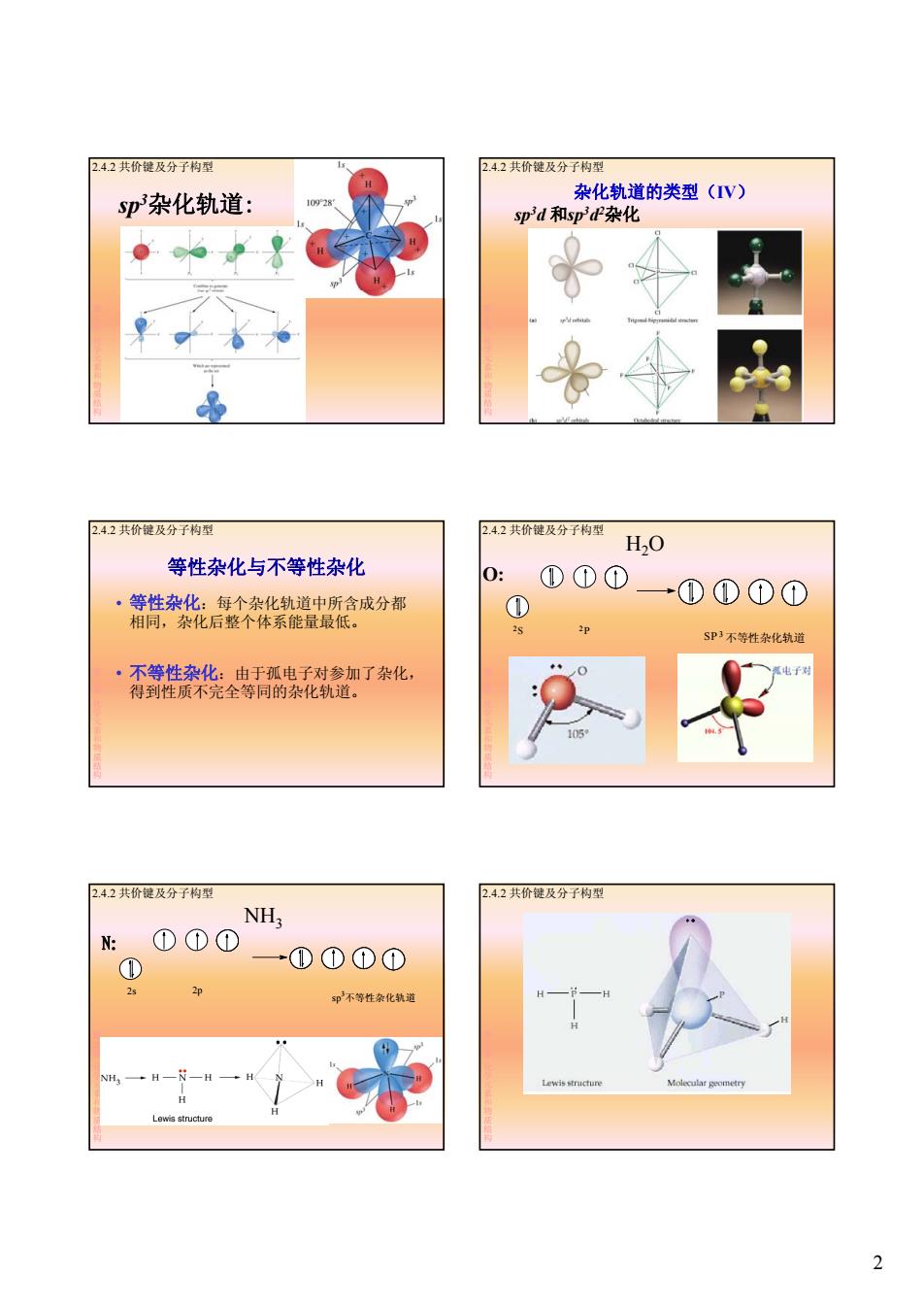
2.4.2共价键及分子构型 2.4.2共价键及分子构型 sp杂化轨道: 杂化轨道的类型(IV) sp3d和spP杂化 2.4.2共价键及分子构型 2.4.2共价键及分子构型 HO 等性杂化与不等性杂化 0: ①①① 。等性杂化:每个杂化轨道中所含成分都 ① ①①①① 相同,杂化后整个体系能量最低。 SP3不等性杂化轨道 ·不等性杂化:由于孤电子对参加了杂化, 弧电子对 得到性质不完全等同的杂化轨道。 105* 2.4.2共价键及分子构型 2.4.2共价键及分子构型 NHg : ①①① ① →①①①① 2 2p 印不等性杂化轨道 Lewis structure Lewis structure 2
2 sp3杂化轨道: 2.4.2 共价键及分子构型 第 2章化学元素和物质结构 sp3d 和sp3d2杂化 2.4.2 共价键及分子构型 杂化轨道的类型(IV) 第 2章化学元素和物质结构 等性杂化与不等性杂化 • 等性杂化:每个杂化轨道中所含成分都 相同,杂化后整个体系能量最低。 2.4.2 共价键及分子构型 第 2章化学元素和物质结构 • 不等性杂化:由于孤电子对参加了杂化, 得到性质不完全等同的杂化轨道。 H2O O: S P 2 2 SP 3 不等性杂化轨道 2.4.2 共价键及分子构型 第 2章化学元素和物质结构 NH3 N: 2s 2p sp3 不等性杂化轨道 2.4.2 共价键及分子构型 第 2章化学元素和物质结构 2.4.2 共价键及分子构型 第 2章化学元素和物质结构
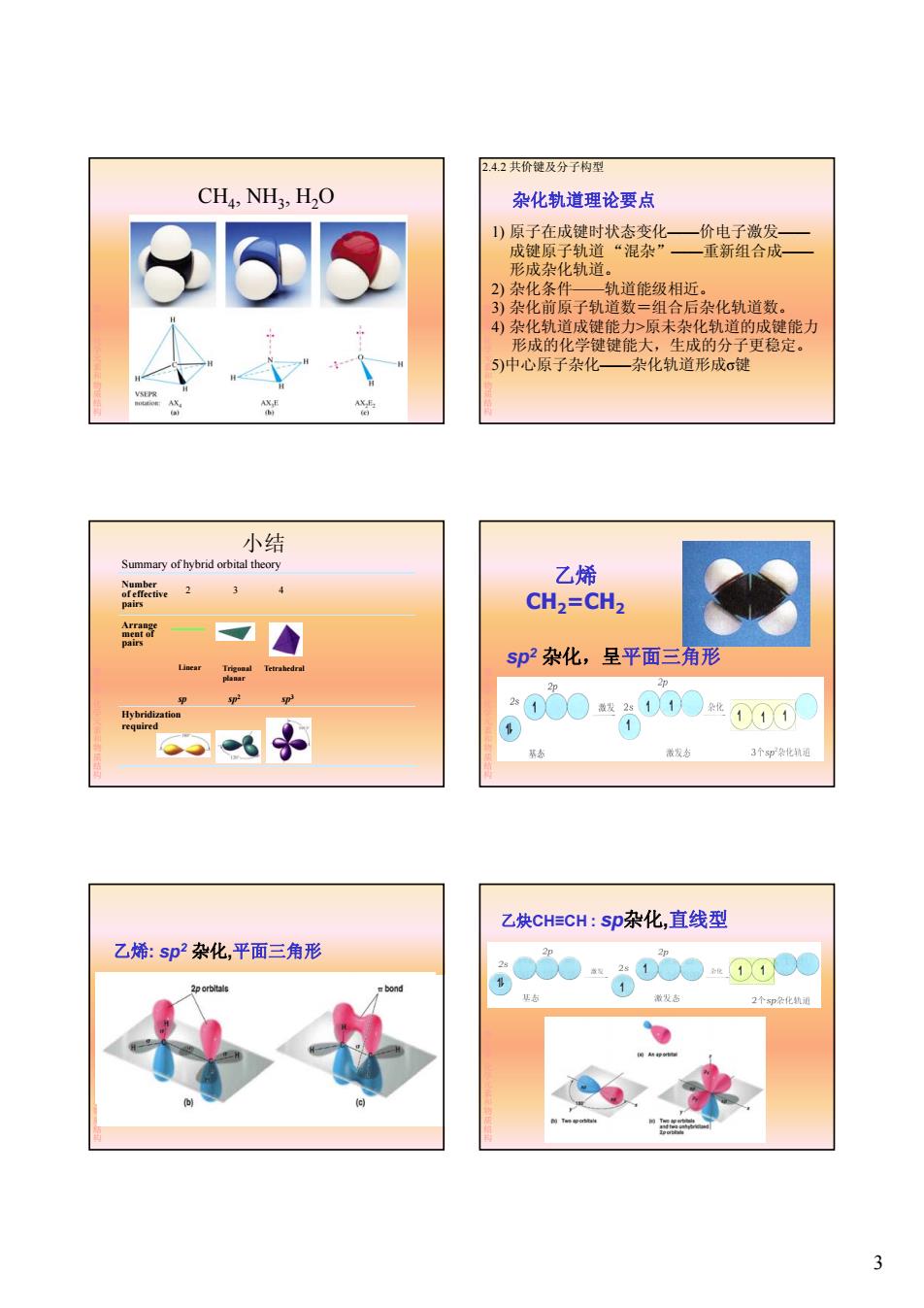
2.4.2共价键及分子构型 CHA NH?,H2O 杂化轨道理论要点 1)原子在成键时状态变化一价电子激发一 成键原子轨道“混杂”一重新组合成一 形成杂化轨道。 2)杂化条件一轨道能级相近。 3)杂化前原子轨道数=组合后杂化轨道数。 4)杂化轨道成键能力>原未杂化轨道的成键能力 形成的化学键键能大,生成的分子更稳定。 5)中心原子杂化一杂化轨道形成σ键 VSEPR 小结 Summary ofhybrid orbital theory Number 乙烯 of effective 2 4 pairs CH2=CH2 7 sp2杂化,呈平面三角形 sp Hybridization required 徽发态 3个5即袋化轨通 乙炔CHECH:Sp杂化,直线型 乙烯:sp2杂化,平面三角形 00o0●00●0 bond 1 激发态 2个郑条化轨通 3
3 CH4, NH3, H2O 第 2章化学元素和物质结构 杂化轨道理论要点 1) 原子在成键时状态变化——价电子激发—— 成键原子轨道 “混杂”——重新组合成—— 形成杂化轨道。 2) 杂化条件——轨道能级相近。 2.4.2 共价键及分子构型 第 2章化学元素和物质结构 2) 杂化条件 轨道能级相近。 3) 杂化前原子轨道数=组合后杂化轨道数。 4) 杂化轨道成键能力>原未杂化轨道的成键能力 形成的化学键键能大,生成的分子更稳定。 5)中心原子杂化——杂化轨道形成σ键 Number of effective pairs Arrange ment of pairs 2 3 4 Summary of hybrid orbital theory 小结 第 2章化学元素和物质结构 Hybridization required Linear sp Trigonal planar sp2 Tetrahedral sp3 乙烯 CH2=CH2 第 sp2 杂化 呈平面三角形 2章化学元素和物质结构 sp2 杂化,呈平面三角形 乙烯: sp2 杂化,平面三角形 第 2章化学元素和物质结构 乙炔CH≡CH : sp杂化,直线型 第 2章化学元素和物质结构
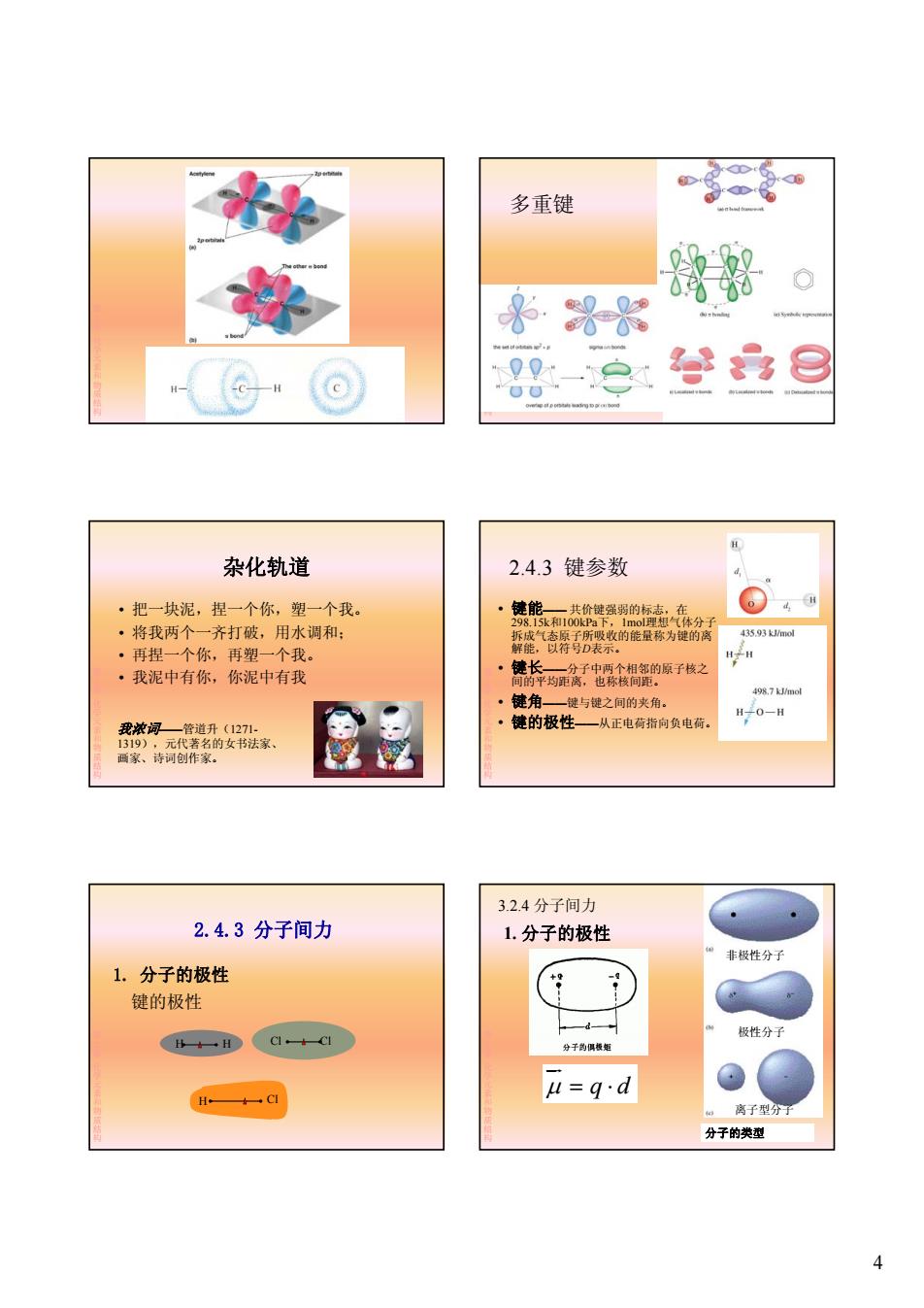
多重键 混帮 ·界 009 ee H 杂化轨道 2.4.3键参数 d ·把一块泥,捏一个你,塑一个我。 键能一共价键强弱的标志,在 4 298.15k和100kPa下,1mol理想气体分子 ·将我两个一齐打破,用水调和: 435.93 kJ/mol ·再捏一个你,再塑一个我。 能查聚的能量称为的 。 键长一分子中两个相邻的原子核之 时H ·我泥中有你,你泥中有我 间的平均距离,也称核间距。 498.7J/mol 键角一键与键之间的夹角。 。 键的极性一从正电荷指向负电荷。 H.O-H 我浓词一管道升(1271. 1319),元代著名的女书法家、 画家、诗词创作家。 3.2.4分子间力 2.4.3分子间力 1.分子的极性 非极性分子 1.分子的极性 键的极性 d 极性分子 B+一H C1·+C1 分子的俱板矩 上H 女C l=q·d 离子型分 分子的类型 4
4 第 2章化学元素和物质结构 多重键 第 2章化学元素和物质结构 杂化轨道 • 把一块泥,捏一个你,塑一个我。 • 将我两个一齐打破,用水调和; 第 • 再捏一个你 再塑一个我 2章化学元素和物质结构 • 再捏一个你,再塑一个我。 • 我泥中有你,你泥中有我 我浓词——管道升(1271- 1319),元代著名的女书法家、 画家、诗词创作家。 2.4.3 键参数 • 键能—— 共价键强弱的标志,在 298.15k和100kPa下,1mol理想气体分子 拆成气态原子所吸收的能量称为键的离 解能,以符号D表示。 第 2章化学元素和物质结构 • 键长——分子中两个相邻的原子核之 间的平均距离,也称核间距。 • 键角——键与键之间的夹角。 • 键的极性——从正电荷指向负电荷。 2.4.3 分子间力 1. 分子的极性 键的极性 第 2章化学元素和物质结构 H Cl H H Cl Cl 3.2.4 分子间力 1. 分子的极性 非极性分子 第 2章化学元素和物质结构 q d 分子的类型 极性分子 离子型分子
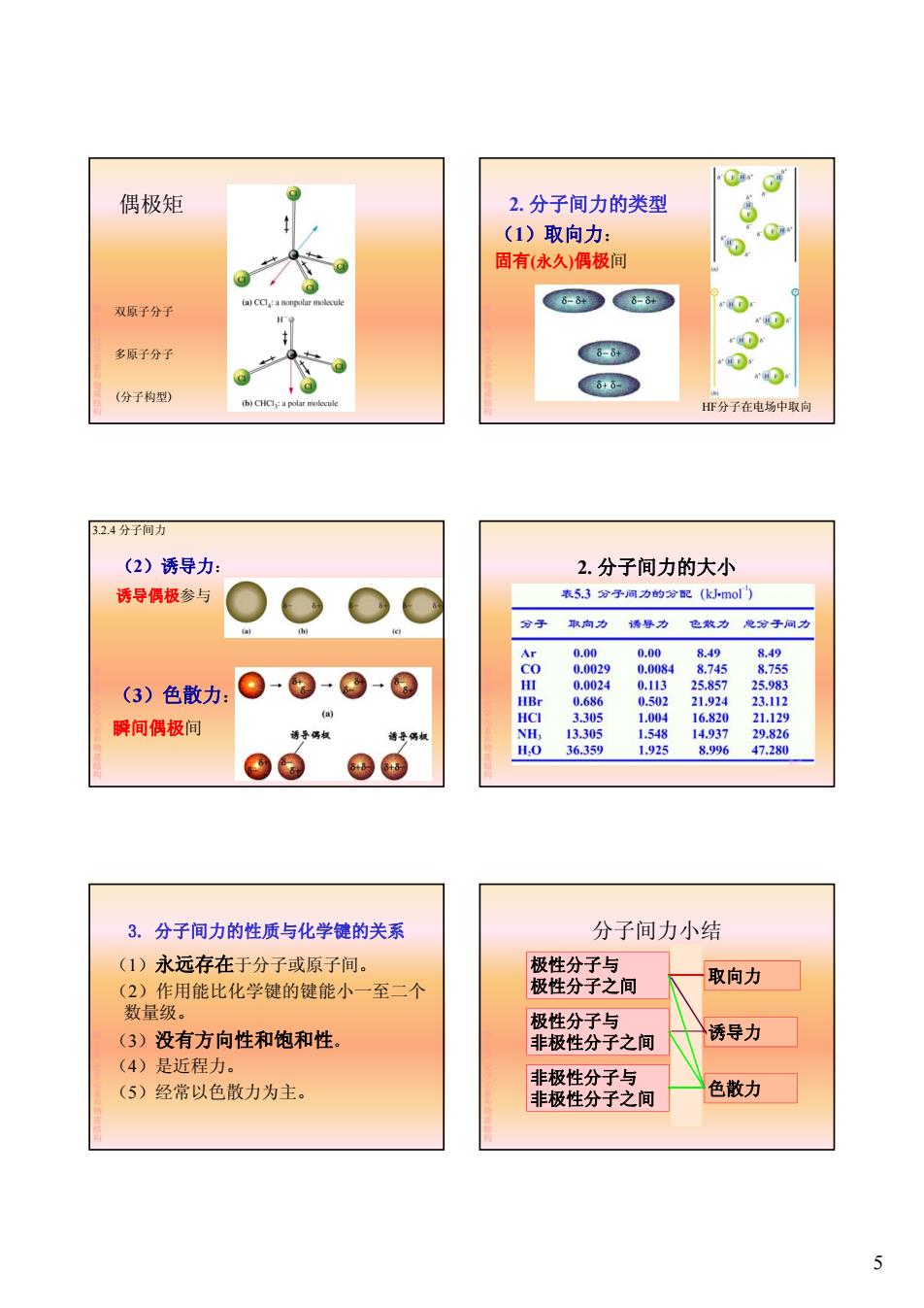
偶极矩 2.分子间力的类型 (1)取向力: 固有(永久)偶极间 双原子分子 多原子分子 8+ (分子构型) (b)CHCl:a polar molecule HF分子在电场中取向 3.2.4分子间力 (2)诱导力: 2.分子间力的大小 诱导偶极参与 表53分子间力的分配(km0l) 分子 取向力 诱绿力 色收力 地分子间力 Ar 0.00 0.00 8.49 8.49 co 0.0029 0.0084 8.745 8.755 (3)色散力: H 0.0024 0.113 25.857 25.983 HBr 0.686 0.502 21.924 23.112 3.305 1.004 瞬间偶极间 HCI 16.820 21.129 NH, 13.305 1.548 14.937 29.826 H.O 36.359 1.925 8.996 47.280 3.分子间力的性质与化学键的关系 分子间力小结 (1)永远存在于分子或原子间。 极性分子与 取向力 (2)作用能比化学键的键能小一至二个 极性分子之间 数量级。 极性分子与 (3)没有方向性和饱和性。 非极性分子之间 诱导力 (4)是近程力。 非极性分子与 (5)经常以色散力为主。 非极性分子之间 色散力 5
5 偶极矩 第 2章化学元素和物质结构 双原子分子 多原子分子 (分子构型) 2. 分子间力的类型 (1)取向力: 固有(永久)偶极间 第 2章化学元素和物质结构 HF分子在电场中取向 (2)诱导力: 诱导偶极参与 3.2.4 分子间力 第 2章化学元素和物质结构 (3)色散力: 瞬间偶极间 2. 分子间力的大小 第 2章化学元素和物质结构 3. 分子间力的性质与化学键的关系 (1)永远存在于分子或原子间。 (2)作用能比化学键的键能小一至二个 数量级。 第 2章化学元素和物质结构 数量级。 (3)没有方向性和饱和性。 (4)是近程力。 (5)经常以色散力为主。 分子间力小结 极性分子与 极性分子之间 极性分子与 取向力 第 2章化学元素和物质结构 极性分子与 非极性分子之间 非极性分子与 非极性分子之间 诱导力 色散力

·He、Ne、Ar、Kr、Xe从左到右原子半 ·为什么水与乙醇可以任意比例混溶? 径(分子半径)依次增大,变形性增大, ·油跟水却不能混溶? 色散力增强,分子间结合力增大,故b.p. 依次增高。 范德华力的大小与物质的m.p.,b.p, 溶解度等物理性质有关。 Which Factors Affecting Solubility vitamin is Vitamin A is soluble in nonpolar compounds (like water-soluble fats). and which is Vitamin C is soluble in water fat-soluble? CH 9 2.4.4氢键 1.氢键的形成条件 2.氢键的类型 ·分子中有H原子且与电负性很大的元素(如F、 O、N等)形成共价键 分子间氢键 ·分子中有电负性很大且带有孤对电子的原子 表5.4氢键的键能和键长 氢键键能(kmo)键长(pm化合物 F.H-F 28.03 255 (HF O-HO 18.83 276 分子内氢键 25.94 266 甲醇、乙醇 N-H-F 20.93 268 NH.F N-HO 286 CH CONH: NHN 344 358 0 NH 酸子的数纯 6
6 • He、Ne、Ar、Kr、Xe 从左到右原子半 径(分子半径)依次增大,变形性增大, 色散力增强,分子间结合力增大,故b. p. 第 2章化学元素和物质结构 色散力增强 分子间结合力增大 故 p 依次增高。 • 范德华力的大小与物质的 m. p. ,b. p., 溶解度等物理性质有关。 • 为什么水与乙醇可以任意比例混溶? • 油跟水却不能混溶? 第 2章化学元素和物质结构 Factors Affecting Solubility • Vitamin A is soluble in nonpolar compounds (like fats). • Vitamin C is soluble in water. 第 2章化学元素和物质结构 Which vitamin is water-soluble and which is fat-soluble? 第 2章化学元素和物质结构 1. 氢键的形成条件 3.2.5 氢键 • 分子中有H原子且与电负性很大的元素(如F、 O、N等) 形成共价键 • 分子中有电负性很大且带有孤对电子的原子 2.4.4 氢键 第 2章化学元素和物质结构 2.氢键的类型 分子间氢键 第 2章化学元素和物质结构 分子内氢键
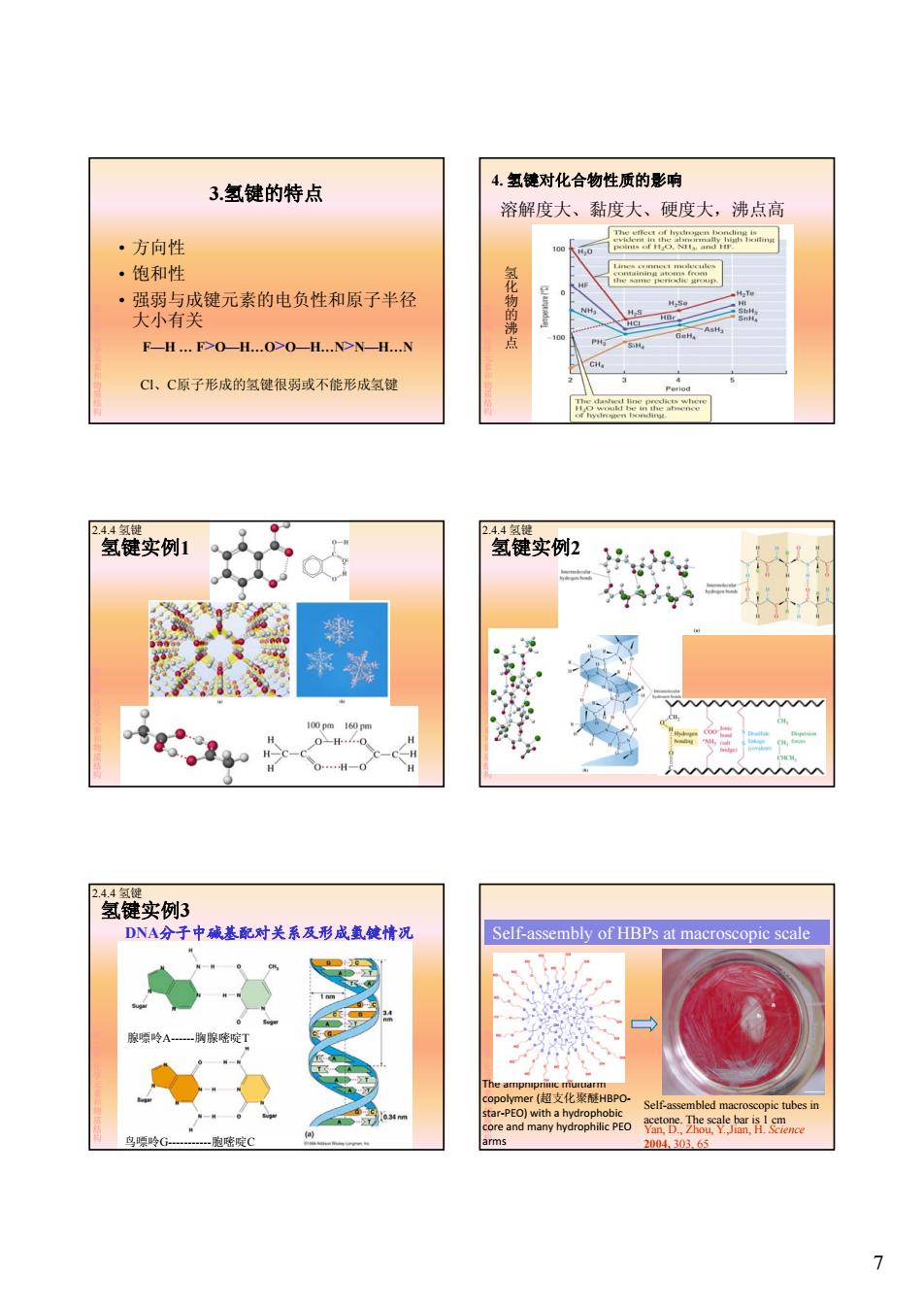
3.氢键的特点 4.氢键对化合物性质的影响 溶解度大、黏度大、硬度大,沸点高 ·方向性 100 0 ·饱和性 40 ·强弱与成键元素的电负性和原子半径 0 NH 大小有关 氢化物的沸 HBr 100 F-H...F>OH...O>O-H...N>N-H...N CI、C原子形成的氢键很弱或不能形成氢键 2.4.4氢键 24.4氢键 氢键实例1 氢键实例2 攀 100 pm 160 pm 0-H+4-0 -C一H H 2.4.4氢键 氢键实例3 DNA分子中碱基配对关系及形成氢健情况 Self-assembly of HBPs at macroscopic scale 腺嘌岭A胸腺嘧啶T The ampnipnic muiuarm copolymer(超支化聚醚HBPO- Self-assembled macroscopic tubes in star-PEO)with a hydrophobic core and many hydrophilic PEO oDhoucye anence 鸟嘌岭G-胞嘘啶C arms 2004.303.65 7
7 3.氢键的特点 • 方向性 • 饱和性 第 2章化学元素和物质结构 • 强弱与成键元素的电负性和原子半径 大小有关 F—H … F>O—H…O>O—H…N>N—H…N Cl、C原子形成的氢键很弱或不能形成氢键 4. 氢键对化合物性质的影响 溶解度大、黏度大、硬度大,沸点高 氢 化 第 2章化学元素和物质结构 物的沸点 氢键实例1 2.4.4 氢键 第 2章化学元素和物质结构 2.4.4 氢键 氢键实例2 第 2章化学元素和物质结构 DNA分子中碱基配对关系及形成氢键情况 2.4.4 氢键 氢键实例3 第 2章化学元素和物质结构 腺嘌呤A------胸腺嘧啶T 鸟嘌呤G-----------胞嘧啶C Self-assembly of HBPs at macroscopic scale 第 2章化学元素和物质结构 The amphiphilic multiarm copolymer (超支化聚醚HBPO‐ star‐PEO) with a hydrophobic core and many hydrophilic PEO arms Self-assembled macroscopic tubes in acetone. The scale bar is 1 cm Yan, D., Zhou, Y.,Jian, H. Science 2004, 303, 65

2.5晶体的结构 2.5晶体的结构 2.5.1离子晶体(I) 晶格:组成晶体的正负离子在空间呈 AB型离子化合物的三种晶胞示意图 有规则的排列 晶胞:晶体中的最小重复单位 氯化铯 Oo Ocr 硫化锌 (e) r+/r~与配位数 NaCl,配位数6 2R 2(R+r 212R r:R=0.732 AB =2 AC 2r*+r)=2(2r) 可以求得 =0.732 r=(2-1)r 停真达到先复过二>0况陆甲阳商子用 r =0.414 图可容纳更多阴离子时,8配位。 者r+变小,当<0414, 离子晶体 则出现阴高子相切,阴高子阳高子 相高的不稳定状态。配位激将变成 4。 总之,配位数与r一之比相关: 0.2250.414 4配位 ZnS式晶体结构 0.414-0.732 6配位 NaCI式晶体结构 0.7321.000 8配位 CsC式晶体结构 Sapphire 陶瓷 8
8 2.5晶体的结构 晶格:组成晶体的正负离子在空间呈 有规则的排列 晶胞:晶体中的最小重复单位 第 2章化学元素和物质结构 2.5.1 离子晶体(I) AB型离子化合物的三种晶胞示意图 2.5晶体的结构 第 2章化学元素和物质结构 r + / r- 与配位数 NaCl,配位数6 A B D C + A + 第 2章化学元素和物质结构 0.414 r r r ( 2 1) r 2(r r ) 2 (2 r ) AB 2 AC + + + D C B + A B C D A B D C 第 2章化学元素和物质结构 A B 当 r + 继续增加,达到并超过 时,即阳离子周 围可容纳更多阴离子时, 8 配位。 0. 732 r r 0. 732 r r 可以求得 若 r + 变小,当 , 则出现阴离子相切,阴离子阳离子 相离的不稳定状态。配位数将变成 4 。 0.414 r r + + + + + 第 2章化学元素和物质结构 总之,配位数与 r +/ r- 之比相关: 0.225 —— 0.414 4 配位 ZnS 式晶体结构 0.414 —— 0.732 6 配位 NaCl 式晶体结构 0.732 —— 1.000 8 配位 CsCl 式晶体结构 离子晶体 第 2章化学元素和物质结构 Ruby Sapphire 陶瓷
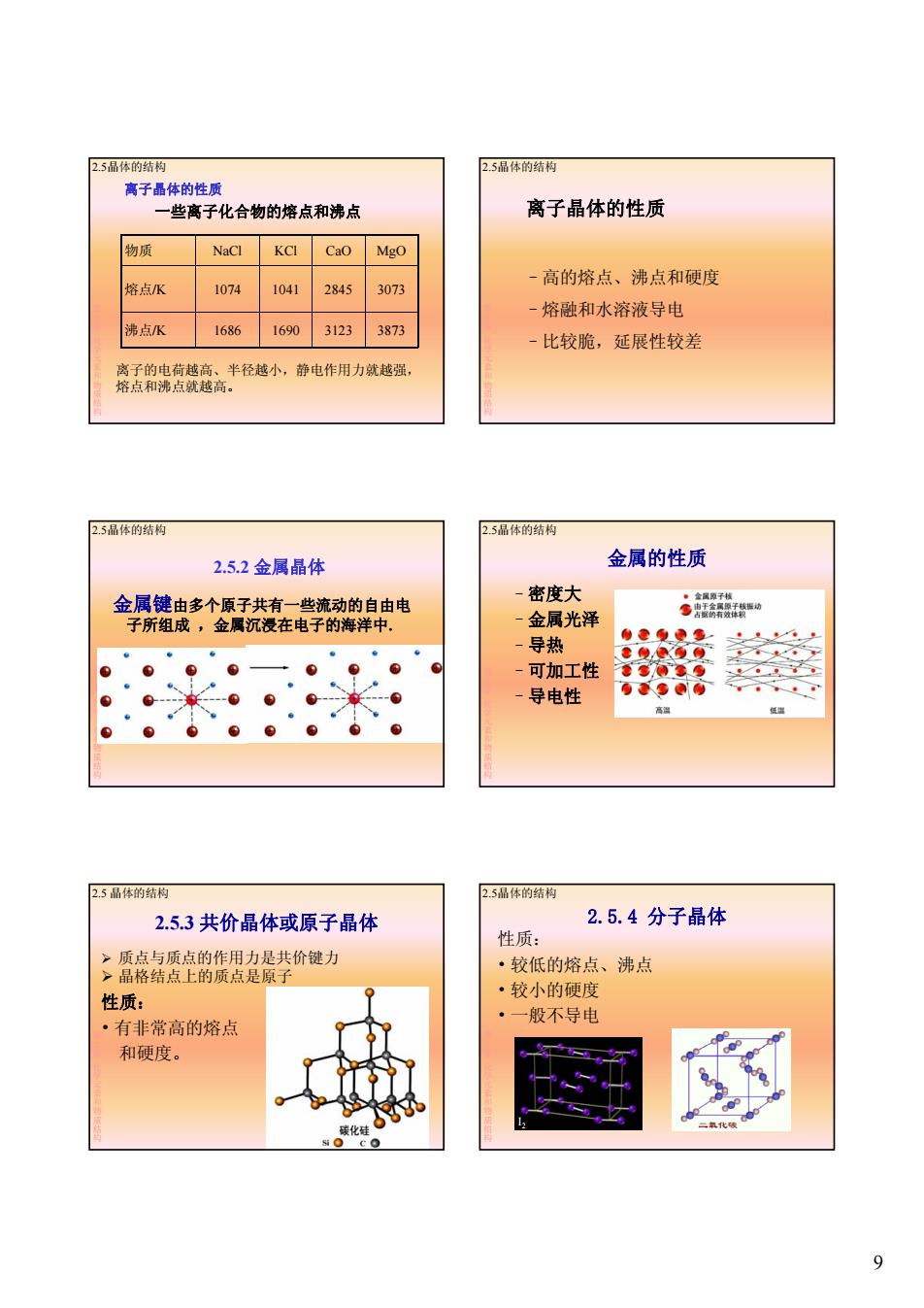
2.5品体的结构 2.5晶体的结构 离子晶体的性质 一些离子化合物的熔点和沸点 离子晶体的性质 物质 NaCl KCI CaO Mgo 一高的熔点、沸点和硬度 熔点/K 1074 1041 2845 3073 熔融和水溶液导电 - 沸点K 1686 1690 3123 3873 比较脆,延展性较差 离子的电荷越高、半径越小,静电作用力就越强, 熔点和沸点就越高。 2.5品体的结构 2.5品体的结构 2.5.2金属晶体 金属的性质 金属键由多个原子共有一些流动的自由电 密度大 海金属夏子植 ◆质新技功 子所组成,金属沉浸在电子的海洋中. 金属光泽 导热 ●惠更典鱼 ●2Q@9 -可加工性 0●00.● -导电性 0◆0的 高温 低温 2.5品体的结构 2.5品体的结构 2.5.3共价晶体或原子晶体 2.5.4分子晶体 性质: >质点与质点的作用力是共价键力 >晶格结点上的质点是原子 ·较低的熔点、沸点 性质: ·较小的硬度 ·一般不导电 ·有非常高的熔点 和硬度。 碳化硅 9
9 物质 NaCl KCl CaO MgO 熔点/K 1074 1041 2845 3073 一些离子化合物的熔点和沸点 离子晶体的性质 2.5晶体的结构 第 2章化学元素和物质结构 熔点/K 1074 1041 2845 3073 沸点/K 1686 1690 3123 3873 离子的电荷越高、半径越小,静电作用力就越强, 熔点和沸点就越高。 离子晶体的性质 –高的熔点、沸点和硬度 2.5晶体的结构 第 2章化学元素和物质结构 –熔融和水溶液导电 –比较脆,延展性较差 2.5.2 金属晶体 金属键由多个原子共有一些流动的自由电 子所组成 ,金属沉浸在电子的海洋中. 2.5晶体的结构 第 2章化学元素和物质结构 金属的性质 –密度大 –金属光泽 –导热 2.5晶体的结构 第 2章化学元素和物质结构 –可加工性 –导电性 2.5.3 共价晶体或原子晶体 质点与质点的作用力是共价键力 晶格结点上的质点是原子 性质: 2.5 晶体的结构 第 2章化学元素和物质结构 • 有非常高的熔点 和硬度。 2.5.4 分子晶体 性质: • 较低的熔点、沸点 • 较小的硬度 • 一般不导电 2.5晶体的结构 第 2章化学元素和物质结构 般不导电 I2

2.5.5同素异型体及混合晶体 非金属材料I一碳 以碳单质为例: 石墨 金刚石 石量、金刚石、富勒烯 。 石墨的混晶结构及在性质上的表现: 。 a.横向sp杂化,形成共价健; b.未参与杂化的轨道在一个大平面上形成共轭大 π键: c层与层之间分子间力。 ·形成了石量晶体的独有特性:导电、光泽、层状 可滑动。在结构上横向与纵向的距离有一定的差 金刚石: 距。 四面体-sp3 ·石墨:平面六边形-sp2 2.5品体的结构 The Nobel Prize in Physics 2010 for groundbreaking experiments regarding the two-dimensional material graphene Konstantin Andre Geim (1958-) Novoselov (1974-) University of Manchester, single laye Manchester,UK University of Manchester. Manchester,UK 2.5品体的结构 单壁和多壁碳纳米管 The Nobel Prize in Chemistry 1996 "for their discovery of fullerenes" 2 b 帽齿形单整碳纳米管 单童碳的米管 Robert F. Sir Harold W. Richard E Curl Jr. Kroto Smalley Rice Unive Rice University University of Houston,USA 1943-2005 Sussex, 手性单建藏纳来管 United Kingdom 10
10 2.5.5同素异型体及混合晶体 • 以碳单质为例: 石墨、金刚石、富勒烯 • 石墨的混晶结构及在性质上的表现: a.横向sp2杂化,形成共价键; 第 2章化学元素和物质结构 b.未参与杂化的p轨道在一个大平面上形成共轭大 π键; c.层与层之间分子间力。 • 形成了石墨晶体的独有特性:导电、光泽、 层状 可滑动。在结构上横向与纵向的距离有一定的差 距。 非金属材料I—碳 石墨 金刚石 第 2章化学元素和物质结构 •金刚石: 四面体---sp3 •石墨:平面六边形---sp2 The Nobel Prize in Physics 2010 "for groundbreaking experiments regarding the two-dimensional material graphene " 2.5晶体的结构 第 2章化学元素和物质结构 Andre Geim (1958-) University of Manchester, Manchester, UK Konstantin Novoselov (1974-) University of Manchester, Manchester, UK 第 2章化学元素和物质结构 • C60, fullerene molecules, carbon nanotubes, and graphite can all be thought of as being formed from graphene sheets, i.e., single layers of carbon atoms arranged in a honeycomb lattice. The Nobel Prize in Chemistry 1996 "for their discovery of fullerenes" 2.5晶体的结构 第 2章化学元素和物质结构 Richard E. Smalley Rice University Houston, USA 1943-2005 Robert F. Curl Jr. Rice University Houston, USA Sir Harold W. Kroto University of Sussex, United Kingdom 单壁和多壁碳纳米管 锯齿形单壁碳纳米管 第 2章化学元素和物质结构 单壁碳纳米管 锯齿形单壁碳纳米管 手性单壁碳纳米管