
上降充通大粤 SHANGHAI JIAO TONG UNIVERSITY 化学问题的实验探究 明矾的制取与铝离子、硫酸根含量测定及净水实验报告 小组成员:孙密广,吴慧珺,柴云凡,张驰 实验日期:3月17日,3月24日,3月31日 一.实验目的 1.利用碱法制取明矾 2.对制取的明矾中的A13+和SO42-进行含量测定 3.比较在不同pH下的明矾的净水能力 二.实验原理与实验步骤 1.碱法制取明矾: (1)实验原理和步骤 2A1+2NaOH+2 H2O=2NaAlO2+3H2t (Na[Al(OH)4]) 2Na[Al(OH)4]+H2SO4=2Al(OH)3+Na2SO4+2H2O 2 Al(OH)3+3 H2SO4 =Al2(SO4)3+6H2O Al2(SO4)3+K2S04+24 H2O =2KAl(SO4)2 12 H2O 废铝 溶解 过滤 调节pH至78 抽滤,洗涤沉淀 NaOH H2S04 H2S04K2S04 明矾,计算产率 减压过滤 结晶 (2)相关说明与思考 >易拉罐的罐体与罐底是3004铝合金,罐盖是5182铝合金,拉环 是5042铝合金。3004为AL-Mn系合金,是应用最广的一种防锈 铝,5042(AIMg3.5Mn)铝合金是铝-镁-锰非热处理强化合金,5182 铝板为Al-Mg系防锈铝。 >调节pH至7~8:根据在20℃下氢氧化铝的溶度积的相应计算公 式可得pH为7~8是AI3+基本沉淀完全。 >减压过滤:利用抽气泵使抽滤瓶中的压强降低,达到固液分离目的 >加入酒精能够帮助结晶,使明矾能够较快结晶析出
化学问题的实验探究 明矾的制取与铝离子、硫酸根含量测定及净水实验报告 小组成员:孙密广,吴慧珺,柴云凡,张驰 实验日期:3 月 17 日,3 月 24 日,3 月 31 日 一.实验目的 1.利用碱法制取明矾 2.对制取的明矾中的 Al3+和 SO42-进行含量测定 3.比较在不同 pH 下的明矾的净水能力 二.实验原理与实验步骤 1.碱法制取明矾: (1)实验原理和步骤 2Al+2NaOH+2 H2O =2NaAlO2+3H2↑ (Na[Al(OH)4]) 2Na[Al(OH)4] + H2SO4 = 2Al(OH)3↓+ Na2SO4 + 2H2O 2 Al(OH)3+ 3 H2SO4 = Al2(SO4)3+ 6H2O Al2(SO4)3+ K2SO4+ 24 H2O = 2KAl(SO4)2·12 H2O 废铝 溶解 过滤 调节 pH 至 7~8 抽滤,洗涤沉淀 明矾,计算产率 减压过滤 结晶 NaOH H2SO4 H2SO4,K2SO4 (2)相关说明与思考 易拉罐的罐体与罐底是 3004 铝合金,罐盖是 5182 铝合金,拉环 是 5042 铝合金。3004 为 AL-Mn 系合金,是应用最广的一种防锈 铝,5042(AlMg3.5Mn)铝合金是铝-镁-锰非热处理强化合金,5182 铝板为 Al-Mg 系防锈铝。 调节 pH 至 7~8:根据在 20℃下氢氧化铝的溶度积的相应计算公 式可得 pH 为 7~8 是 Al3+基本沉淀完全。 减压过滤:利用抽气泵使抽滤瓶中的压强降低,达到固液分离目的 加入酒精能够帮助结晶,使明矾能够较快结晶析出

上降充通大粤 SHANGHAI JIAO TONG UNIVERSITY 化学问题的实验探究 2.返滴定法测铝离子含量测定 (1)实验原理与步骤 加入定量过量的EDTA标准溶液,加热煮沸几分钟,使络合完全, 继在pH为5~6,以二甲酚橙为指示剂,用Zn+标准溶液滴定过量的 EDTA。然后,加入过量的氨水,和HCI加热至沸,使AY与氨水之间 发生置换反应,释放出与AI3+等物质的量的EDTA,再用Z2+盐标液滴 定释放出来的EDTA而得到铝的含量.有关反应如下: pH=3.5时,AI3+(试液)+Y4(过量)=AIY·,Y4(剩) pH=5~6时,加XO指示剂,用Zn2+盐标液滴定剩余的Y4 Zn2++Y4-(剩)=ZnY2- 终点:Zn2*(过量)+X0=Zn-X0颜色变化:黄色→紫红色 置换反应:AIY与氨水置换将开始与AI3+结合的Y4释放出(煮沸) 滴定反应:Y4(置换)+Zn2+=ZnY2- 终点:Zn2+(过量)+XO=Zn-XO 颜色变化:黄色→紫红色 Zn2*溶液配制配 标定EDTA 滴定AI3+ 抽滤,洗涤沉淀 | 六甲基四胺作为指示剂 二甲酚橙作为指示剂 (2)相关说明与思考 >由于A13+易水解而形成一系列多核氢氧基络合物,且与EDTA反应 慢,络合比不恒定。因此用反滴定法 >理论值:5.696% >以上所示的pH值是参考资料给出的,实际的计算需要根据氢氧化 铝和氢氧化锌的溶度积以及形成的络合物计算。 1.012g左右的明矾,得到A13+约为8x10mol/L,由铝的溶度积可以 得出[0H-]=5.5x10,从而得出pH约3.7 >通过理论计算,调节溶液pH至5-6,此时A1Y稳定,也不会重新 水解析出(多核络合物) 3.比浊法硫酸根含量测定 (1)实验原理 比浊法:为测量透过悬浮质点介质的光强度来确定悬浮物质浓度的方 法,这是一种光散射测量技术。主要是用于测定能形成悬浮体的沉淀
化学问题的实验探究 2.返滴定法测铝离子含量测定 (1)实验原理与步骤 加入定量过量的 EDTA 标准溶液,加热煮沸几分钟,使络合完全, 继在 pH 为 5~6,以二甲酚橙为指示剂,用 Zn2+标准溶液滴定过量的 EDTA。然后,加入过量的氨水,和 HCl 加热至沸,使 AlY-与氨水之间 发生置换反应,释放出与 Al3+等物质的量的 EDTA,再用 Zn2+盐标液滴 定释放出来的 EDTA 而得到铝的含量.有关反应如下: pH = 3.5 时, Al3+(试液)+ Y4-(过量)=AlY - , Y4- (剩) pH = 5~6 时,加 XO 指示剂,用 Zn2+盐标液滴定剩余的 Y4- Zn2+ + Y4-(剩) = ZnY2- 终点:Zn2+(过量)+XO= Zn-XO 颜色变化:黄色 → 紫红色 置换反应: AlY-与氨水置换将开始与 Al3+结合的 Y4-释放出(煮沸) 滴定反应: Y4-(置换)+ Zn2+= ZnY2- 终点:Zn2+(过量)+XO=Zn-XO 颜色变化:黄色 → 紫红色 Zn2+溶液配制配 标定 EDTA 滴定 Al3+ 抽滤,洗涤沉淀 六甲基四胺作为指示剂 二甲酚橙作为指示剂 (2)相关说明与思考 由于 Al3+易水解而形成一系列多核氢氧基络合物,且与 EDTA 反应 慢,络合比不恒定。因此用反滴定法 理论值:5.696% 以上所示的 pH 值是参考资料给出的,实际的计算需要根据氢氧化 铝和氢氧化锌的溶度积以及形成的络合物计算。 1.012g 左右的明矾,得到 Al3+约为 8x10-3mol/L,由铝的溶度积可 以 得出[OH-]=5.5x10-11,从而得出 pH 约 3.7 通过理论计算,调节溶液 pH 至 5-6,此时 AlY 稳定,也不会重新 水解析出(多核络合物) 3.比浊法硫酸根含量测定 (1)实验原理 比浊法:为测量透过悬浮质点介质的光强度来确定悬浮物质浓度的方 法,这是一种光散射测量技术。主要是用于测定能形成悬浮体的沉淀

上降充通大粤 SHANGHAI JIAO TONG UNIVERSITY 化学问题的实验探究 物质,当光线通过一混浊溶液时,因悬浮体选择地吸收了一部分光能, 并且悬浮体向各个方面散射了另一部分光线,减弱了透过光线的强 度。在分析时,先做工作曲线,以s对已知散射物的浓度c作图。 (2)实验步骤 配置标准溶液,利用标准溶液得到的得到吸光度的工作曲线从而确定 浓度曲线来测定配制试样的浓度。 (2)相关说明: >适合于分析混浊度较大的样品,光束通过试样后,透射光强度应 有显著减弱。I0与I相差较大,则测量误差较小。 >反应物的浓度、加入的顺序和速度,介质的酸度、温度、放置时 间等对悬浮质点的大小和均匀性都有影响。必要时可加入一些表 面活性剂或其他保护胶体以防止悬浮物迅速沉降。 (由于不同的人加入,其中各个步骤的完成情况也不完全相同,从而 造成结果不相同) >在电脑中显示的浓度只是我们加入的硫酸钾的量,实际上并不表 示浓度与浓度存在一定线性关系,应该乘以倍率20 4.净水:明矾在水中可以电离出两种金属离子: KAl(S04)2=K++A13++2S042- A13+很容易水解,生成胶状的氢氧化铝AI(OH)3: AI3++3H2O=A1(OH)3(胶体)+3H+ 胶粒具有很大的比表面积(比表面积=表面积/颗粒体积),因而有 很强的吸附能力,使胶粒表面吸附溶液中的离子,可以吸附水里悬 浮的杂质,并形成沉淀,使水澄清。 通过比较去离子水,pH分别为3,7,11的处理效果 三.实验结果与相关分析 1.第一次明矾的制取量:6.6g 根据铝守恒初始从易拉罐剪取了0.7g的Al, 理论上m(K4(S0,212H,0)=nA0=0,7 =0.02593mo1 27 产率= 6.6g ×100%=53.66% 0.02593×474.4g 误差分析:
化学问题的实验探究 物质,当光线通过一混浊溶液时,因悬浮体选择地吸收了一部分光能, 并且悬浮体向各个方面散射了另一部分光线,减弱了透过光线的强 度。在分析时,先做工作曲线,以 s 对已知散射物的浓度 c 作图。 (2)实验步骤 配置标准溶液,利用标准溶液得到的得到吸光度的工作曲线从而确定 浓度曲线来测定配制试样的浓度。 (2)相关说明: 适合于分析混浊度较大的样品,光束通过试样后,透射光强度应 有显著减弱。I0 与 I 相差较大,则测量误差较小。 反应物的浓度、加入的顺序和速度,介质的酸度、温度、放置时 间等对悬浮质点的大小和均匀性都有影响。必要时可加入一些表 面活性剂或其他保护胶体以防止悬浮物迅速沉降。 (由于不同的人加入,其中各个步骤的完成情况也不完全相同,从而 造成结果不相同) 在电脑中显示的浓度只是我们加入的硫酸钾的量,实际上并不表 示浓度与浓度存在一定线性关系,应该乘以倍率 20 4.净水:明矾在水中可以电离出两种金属离子: KAl(SO4)2= K+ + Al3+ + 2SO4 2- Al3+很容易水解,生成胶状的氢氧化铝 Al(OH) 3: Al3+ + 3H2O = Al(OH) 3(胶体)+ 3H+ 胶粒具有很大的比表面积(比表面积=表面积/颗粒体积),因而有 很强的吸附能力,使胶粒表面吸附溶液中的离子,可以吸附水里悬 浮的杂质,并形成沉淀,使水澄清。 通过比较去离子水,pH 分别为 3,7,11 的处理效果 三.实验结果与相关分析 1.第一次明矾的制取量:6.6g 根据铝守恒初始从易拉罐剪取了 0.7g 的 Al, 理论上 4 2 2 0.7 ( ( ) 12 0) ( ) 0.02593 27 n KAl SO H n Al mol 产率= 6.6 100%=53.66% 0.02593 474.4 g g 误差分析:

上降充通大粤 SHANGHAI JIAO TONG UNIVERSITY 化学问题的实验探究 (1)选取易拉罐的不同部位得到的A1的成分比例都是不相同的,这 也解释了最后有不少难溶物质的原因。 (2)剩余的难溶物质中也存在因为反应时间不足未能完全溶解的A1 (3)2AI+2NaOH+2HO=2 NaAIO2+3H2↑(NaAI(OH)4])实验中假 设0.7g全部是A1则Al有0.0259mol,称取1 gNaOH有0.025mol,若 称取不足也可能会造成存在未完全溶解的AI (4)在抽滤的过程中存在少量明矾的损失。 (5)溶解至Na0H溶液中的A13*的浓度约为0.2mol/L,铝的溶度积常 数20℃Km=1.9×10,从而可得出让铝完全沉淀的p56即可,考虑 到其他因素,调节pH至78可以完全使A1沉淀。 2.EDTA的标定 0.786 287.55mol1L=0.01095mol/L 250.00 1000 滴定管初始体 滴定管最终体 消耗EDTA体积 积(mL) 积(mL) (mL) CEDTA (mol/L) 0.20 31.40 31.20 2.90 30.45 27.55 0.009936 0.65 28.00 27.35 0.01001 CEDTA=0.009973mol/L,d=3.7×10-mol/L,d,=0.37% CE4=(0.009973±3.700x10-)mo1/L 备注:第一次滴定时由于对于滴定终点紫红色转变为黄色的判定不够 准确,同时由于滴定管没有控制准确。使得最终结果偏大,最终结果 不计入最后计算
化学问题的实验探究 (1)选取易拉罐的不同部位得到的 Al 的成分比例都是不相同的,这 也解释了最后有不少难溶物质的原因。 (2)剩余的难溶物质中也存在因为反应时间不足未能完全溶解的Al (3)2Al+2NaOH+2 H2O =2NaAlO2+3H2↑ (Na[Al(OH)4])实验中假 设 0.7g 全部是 Al 则 Al 有 0.0259mol,称取 1gNaOH 有 0.025mol,若 称取不足也可能会造成存在未完全溶解的 Al (4)在抽滤的过程中存在少量明矾的损失。 (5)溶解至 NaOH 溶液中的 Al3+的浓度约为 0.2mol/L,铝的溶度积常 数 20℃ 33 1.9 10 Ksp ,从而可得出让铝完全沉淀的 pH5~6 即可,考虑 到其他因素,调节 pH 至 7~8 可以完全使 Al3+沉淀。 2.EDTA 的标定 2 0.7869 287.55 / 0.01095 / 250.00 1000 Zn c mol L mol L 滴定管初 始体 积(mL) 滴定管 最终体 积(mL) 消耗 EDTA 体积 (mL) EDTA c (mol/L) 0.20 31.40 31.20 —— 2.90 30.45 27.55 0.009936 0.65 28.00 27.35 0.01001 0.009973 / EDTA c mol L , 5 d mol L 3.7 10 / , dr 0.37% 5 (0.009973 3.700 10 ) / EDTA c mol L 备注:第一次滴定时由于对于滴定终点紫红色转变为黄色的判定不够 准确,同时由于滴定管没有控制准确。使得最终结果偏大,最终结果 不计入最后计算
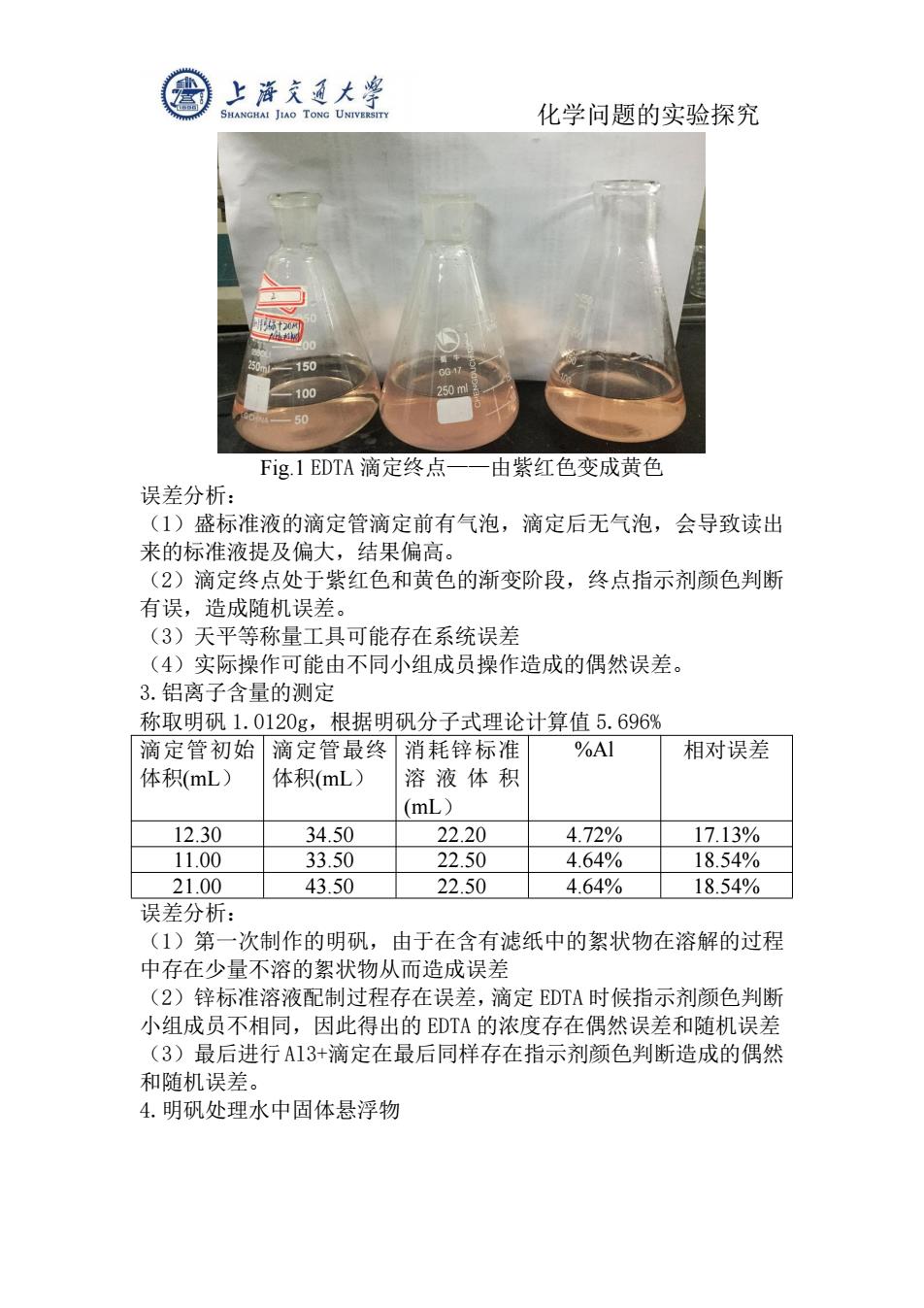
上降充通大粤 SHANGHAI JIAO TONG UNIVERSITY 化学问题的实验探究 150 100 Fig.1EDTA滴定终点 由紫红色变成黄色 误差分析: (1)盛标准液的滴定管滴定前有气泡,滴定后无气泡,会导致读出 来的标准液提及偏大,结果偏高。 (2)滴定终点处于紫红色和黄色的渐变阶段,终点指示剂颜色判断 有误,造成随机误差。 (3)天平等称量工具可能存在系统误差 (4)实际操作可能由不同小组成员操作造成的偶然误差。 3.铝离子含量的测定 称取明矾1.0120g,根据明矾分子式理论计算值5.696% 滴定管初始滴定管最终消耗锌标准 %A1 相对误差 体积(mL) 体积(mL) 溶液体积 (mL) 12.30 34.50 22.20 4.72% 17.13% 11.00 33.50 22.50 4.64% 18.54% 21.00 43.50 22.50 4.64% 18.54% 误差分析: (1)第一次制作的明矾,由于在含有滤纸中的絮状物在溶解的过程 中存在少量不溶的絮状物从而造成误差 (2)锌标准溶液配制过程存在误差,滴定EDTA时候指示剂颜色判断 小组成员不相同,因此得出的EDTA的浓度存在偶然误差和随机误差 (3)最后进行A13+滴定在最后同样存在指示剂颜色判断造成的偶然 和随机误差。 4.明矾处理水中固体悬浮物
化学问题的实验探究 Fig.1 EDTA 滴定终点——由紫红色变成黄色 误差分析: (1)盛标准液的滴定管滴定前有气泡,滴定后无气泡,会导致读出 来的标准液提及偏大,结果偏高。 (2)滴定终点处于紫红色和黄色的渐变阶段,终点指示剂颜色判断 有误,造成随机误差。 (3)天平等称量工具可能存在系统误差 (4)实际操作可能由不同小组成员操作造成的偶然误差。 3.铝离子含量的测定 称取明矾 1.0120g,根据明矾分子式理论计算值 5.696% 滴定管初始 体积(mL) 滴定管最终 体积(mL) 消耗锌标准 溶 液 体 积 (mL) %Al 相对误差 12.30 34.50 22.20 4.72% 17.13% 11.00 33.50 22.50 4.64% 18.54% 21.00 43.50 22.50 4.64% 18.54% 误差分析: (1)第一次制作的明矾,由于在含有滤纸中的絮状物在溶解的过程 中存在少量不溶的絮状物从而造成误差 (2)锌标准溶液配制过程存在误差,滴定 EDTA 时候指示剂颜色判断 小组成员不相同,因此得出的 EDTA 的浓度存在偶然误差和随机误差 (3)最后进行Al3+滴定在最后同样存在指示剂颜色判断造成的偶然 和随机误差。 4.明矾处理水中固体悬浮物

上降充通大粤 SHANGHAI JIAO TONG UNIVERSITY 化学问题的实验探究 Fig.2从左到右,去离子水,pH=11,pH=7,pH=3 实验结果显示:在碱性条件下明矾处理水中的悬浮物效果最好,在中 性条件下次之,酸性条件下最弱。 原因是:碱性促进铝离子水解形成氢氧化铝胶体,由于胶体的比表面 积大,因此导致吸附效果加强。 5.硫酸根含量的测定 Fg.3配置好的等梯度的标准溶液 Fig.4配置好的试样
化学问题的实验探究 Fig.2 从左到右,去离子水,pH=11,pH=7,pH=3 实验结果显示:在碱性条件下明矾处理水中的悬浮物效果最好,在中 性条件下次之,酸性条件下最弱。 原因是:碱性促进铝离子水解形成氢氧化铝胶体,由于胶体的比表面 积大,因此导致吸附效果加强。 5.硫酸根含量的测定 Fig.3 配置好的等梯度的标准溶液 Fig.4 配置好的试样
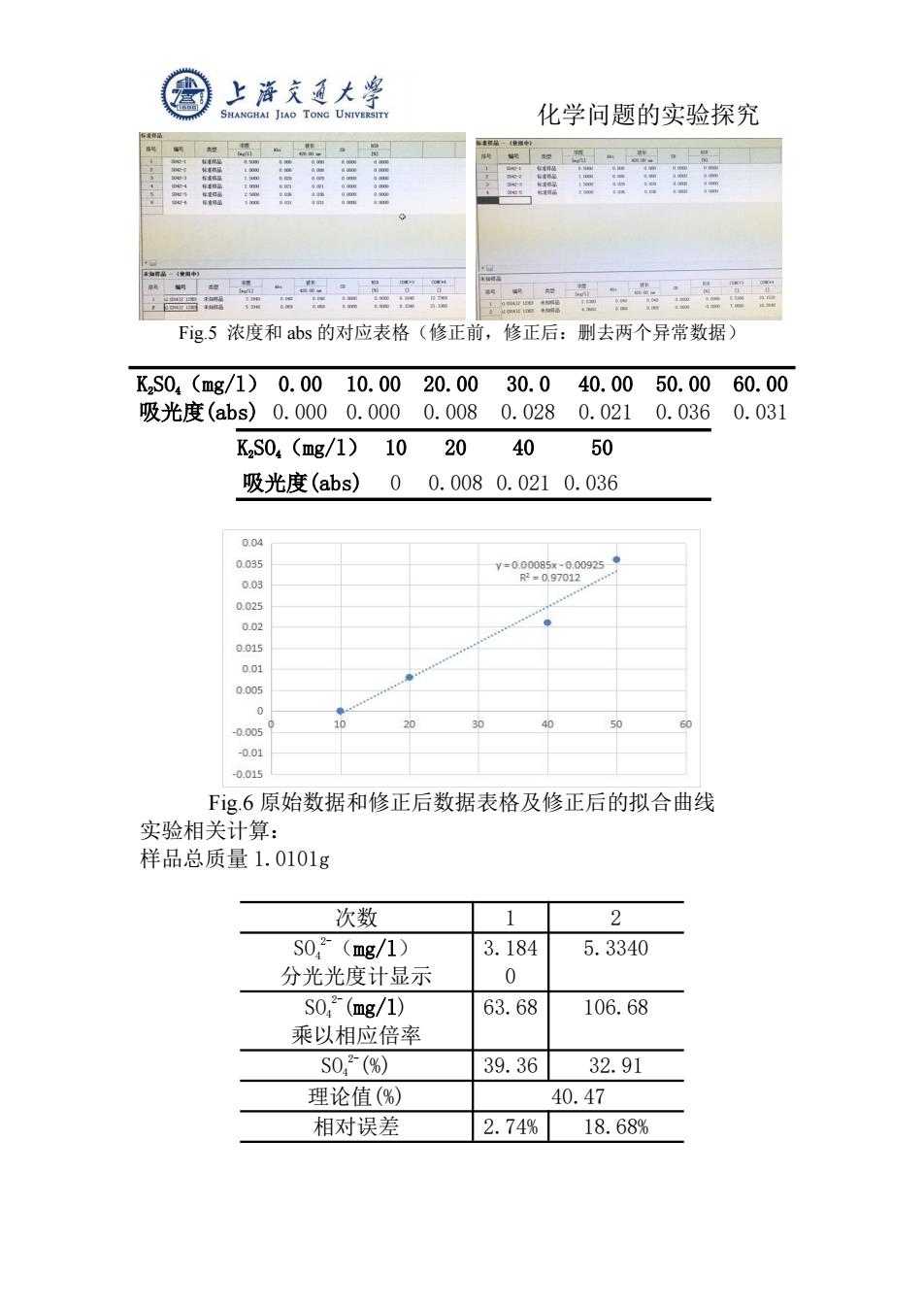
上游文通大警 SHANGHAI JIAO TONG UNIVERSITY 化学问题的实验探究 条物可品一1使图中) Fig5浓度和abs的对应表格(修正前,修正后: 删去两个异常数据) KzS04(mg/1)0.0010.00 20.00 30.0 40.00 50.00 60.00 吸光度(abs)0.0000.0000.008 0.028 0.021 0.036 0.031 K2SO,(mg/1) 10 20 40 50 吸光度(abs)0 0.0080.0210.036 0.04 0.035 V=0.00085x-0.00925 0.03 R2=0,97012 0.025 0.02 0.015 0.01 0.005 0 -0.005 10 50 -0.01 -0.015 Fg.6原始数据和修正后数据表格及修正后的拟合曲线 实验相关计算: 样品总质量1.0101g 次数 1 2 S0,2(mg/1) 3.184 5.3340 分光光度计显示 0 S0,(mg/1) 63.68 106.68 乘以相应倍率 S0,2(%) 39.36 32.91 理论值(%) 40.47 相对误差 2.74% 18.68%
化学问题的实验探究 Fig.5 浓度和 abs 的对应表格(修正前,修正后:删去两个异常数据) K2SO4(mg/l) 0.00 10.00 20.00 30.0 40.00 50.00 60.00 吸光度(abs) 0.000 0.000 0.008 0.028 0.021 0.036 0.031 K2SO4(mg/l) 10 20 40 50 吸光度(abs) 0 0.008 0.021 0.036 Fig.6 原始数据和修正后数据表格及修正后的拟合曲线 实验相关计算: 样品总质量 1.0101g 次数 1 2 SO4 2-(mg/l) 分光光度计显示 3.184 0 5.3340 SO4 2-(mg/l) 乘以相应倍率 63.68 106.68 SO4 2-(%) 39.36 32.91 理论值(%) 40.47 相对误差 2.74% 18.68%

上降充通大粤 SHANGHAI JIAO TONG UNIVERSITY 化学问题的实验探究 误差分析: (1)进行硫酸钾溶解时未将所有的硫酸钾固体倒入烧杯中; (2)用移液管向容量瓶中移入硫酸钾时不够: (3)定容时液面可能超过了刻度线。 (4)明矾本身就并非百分之百纯明矾,在溶解的过程中也观察到没 有完全溶解的絮状物,因此造成实验结果偏小。 (5)由于实验是小组共同完成,可能在实验中存在使用玻璃棒未清 洗,清洗使用自来水引入杂质离子污染,吸量管和移液管不同人使用 情况不同从而造成数值波动等偶然误差。 (6)使用吸量管和移液管的时候,并未完全掌握操作要领。诸如润 洗不到位,润洗次数不够。 五,问题与讨论 1.各种水的区别 种类 主要成分 去离子水 自然界的水去掉了钠、钙、铁、铜等元素的阳离子以及 氯、溴等元素的阴离子后的水。可能有一些有机物以非 离子形态存在于其中。 蒸馏水 将水蒸馏、冷凝的水,蒸二次的叫重蒸水,三次的叫三蒸 水。经过多级蒸馏水,出水才可达到很纯,成本相对比较 高。基本不含其它任何杂质。 矿泉水 从地下深处自然涌出的或者是经人工揭露的、未受污染 的地下矿水;含有一定量的矿物盐、微量元素或二氧化 碳气体 自来水 水其中含有氯离子,消毒时候留下的还有一些钙离子、 镁离子、钾离子、还有一些硫酸盐等微量的矿物质 纯净水 20微量元素,微量的矿物质(特定标准) 饮用水 各种元素的不同标准 2.抽滤操作 > 安装仪器,漏斗管下端的斜面朝向抽气嘴。但不可靠得太近,以免 使滤液从抽气嘴抽走。 >检查布式漏斗与抽滤瓶之间连接是否紧密,抽气泵连接口是否漏 气(未加活塞的笑话) >从漏斗中取出固体时,应将漏斗从抽滤瓶上取下,左手握漏斗管, 倒转,用右手“拍击”左手,使固体连同滤纸一起落入洁净的纸 片或表面皿上。揭去滤纸,再对固体做干燥处理。 >过滤结束时,先缓拔掉吸滤瓶上的橡皮管,再关开关,以防倒吸
化学问题的实验探究 误差分析: (1)进行硫酸钾溶解时未将所有的硫酸钾固体倒入烧杯中; (2)用移液管向容量瓶中移入硫酸钾时不够; (3)定容时液面可能超过了刻度线。 (4)明矾本身就并非百分之百纯明矾,在溶解的过程中也观察到没 有完全溶解的絮状物,因此造成实验结果偏小。 (5)由于实验是小组共同完成,可能在实验中存在使用玻璃棒未清 洗,清洗使用自来水引入杂质离子污染,吸量管和移液管不同人使用 情况不同从而造成数值波动等偶然误差。 (6)使用吸量管和移液管的时候,并未完全掌握操作要领。诸如润 洗不到位,润洗次数不够。 五.问题与讨论 1.各种水的区别 种类 主要成分 去离子水 自然界的水去掉了钠、钙、铁、铜等元素的阳离子以及 氯、溴等元素的阴离子后的水。可能有一些有机物以非 离子形态存在于其中。 蒸馏水 将水蒸馏、冷凝的水,蒸二次的叫重蒸水,三次的叫三蒸 水。经过多级蒸馏水,出水才可达到很纯,成本相对比较 高。基本不含其它任何杂质。 矿泉水 从地下深处自然涌出的或者是经人工揭露的、未受污染 的地下矿水;含有一定量的矿物盐、微量元素或二氧化 碳气体 自来水 水其中含有氯离子,消毒时候留下的还有一些钙离子、 镁离子、钾离子、还有一些硫酸盐等微量的矿物质 纯净水 H20 微量元素,微量的矿物质(特定标准) 饮用水 各种元素的不同标准 2.抽滤操作 安装仪器,漏斗管下端的斜面朝向抽气嘴。但不可靠得太近,以免 使滤液从抽气嘴抽走。 检查布式漏斗与抽滤瓶之间连接是否紧密,抽气泵连接口是否漏 气(未加活塞的笑话) 从漏斗中取出固体时,应将漏斗从抽滤瓶上取下,左手握漏斗管, 倒转,用右手“拍击”左手,使固体连同滤纸一起落入洁净的纸 片或表面皿上。揭去滤纸,再对固体做干燥处理。 过滤结束时,先缓拔掉吸滤瓶上的橡皮管,再关开关,以防倒吸

上降充通大粤 SHANGHAI JIAO TONG UNIVERSITY 化学问题的实验探究 3.移液管与吸量管 710101 Z10180 8041x 763180 605107 760180 603180 Bai个百群 Fg.7移液管(左)与吸量管(右) > 吸量管:称为刻度移液管.它是带有分度线的量出式玻璃量器, 用于移取非固定量的溶液,有1,2,5,和10mL等规格。 > 移液管,有5,10,25,和50mL等规格,是一种量出式仪器,只 用来测量它所放出溶液的体积。它是一根中间有一膨大部分的细 长玻璃管。其下端为尖嘴状,上端管颈处刻有一条标线,是所移 取的准确体积的标志。 >常用的吸量管移液管和吸量管所移取的体积通常可准确到 0.01L。(不同规格在外观上的大小相似,但是由于内径的不同) > 移液管和吸量管在实验中应与溶液对应,不应串用以避免沾染。 使用移液管或吸量管移取溶液的方法是: (1)洗涤。使用前移液管和吸量管都要洗涤,直至内壁不挂水珠为止。 方法与洗涤滴定管一样,先用洗液洗,再用自来水冲洗,最后用蒸馏 水洗涤干净。 (2)润洗。为保证移取溶液时溶液浓度保持不变,应使用滤纸将管口 内外水珠吸去,再用被移溶液润洗三次,置换移液管或吸量管内壁的 水分。润洗后的溶液应该弃去。 (3)吸取溶液。吸取溶液时,吸管下端至少伸入液面1cm,不要伸入 太多,以免管口外壁沾附溶液过多,也不要伸入太少,以免液面下降 后吸空。液面缓慢下降到凹液面与刻度正好相切即可。 (4)放出整管溶液。将移液管放入锥形瓶或容量瓶中,将锥形瓶或容 量瓶略倾斜,管尖靠瓶内壁,移液管垂直(杯壁下流 液体全部留出后停留15秒(移液管上标有“快”,应该不停留) 留在管口的液体不要吹出,因为校正时未将这部分体积计算在内(移 液管上标有“吹”,应该将留在管口的液体吹出) 实验中应尽可能使用同一吸量管的同一区段的体积。 4.过滤细节:
化学问题的实验探究 3.移液管与吸量管 Fig.7 移液管(左)与吸量管(右) 吸量管:称为刻度移液管. 它是带有分度线的量出式玻璃量器, 用于移取非固定量的溶液,有 1,2,5,和 10mL 等规格。 移液管,有 5,10,25,和 50mL 等规格,是一种量出式仪器,只 用来测量它所放出溶液的体积。它是一根中间有一膨大部分的细 长玻璃管。其下端为尖嘴状,上端管颈处刻有一条标线,是所移 取的准确体积的标志。 常用的吸量管移液管和吸量管所移取的体积通常可准确到 0.01mL。(不同规格在外观上的大小相似,但是由于内径的不同) 移液管和吸量管在实验中应与溶液对应,不应串用以避免沾染。 使用移液管或吸量管移取溶液的方法是: (1) 洗涤。使用前移液管和吸量管都要洗涤,直至内壁不挂水珠为止。 方法与洗涤滴定管一样,先用洗液洗,再用自来水冲洗,最后用蒸馏 水洗涤干净。 (2) 润洗。为保证移取溶液时溶液浓度保持不变,应使用滤纸将管口 内外水珠吸去,再用被移溶液润洗三次,置换移液管或吸量管内壁的 水分。润洗后的溶液应该弃去。 (3) 吸取溶液。吸取溶液时,吸管下端至少伸入液面 1cm,不要伸入 太多,以免管口外壁沾附溶液过多,也不要伸入太少,以免液面下降 后吸空。液面缓慢下降到凹液面与刻度正好相切即可。 (4)放出整管溶液。将移液管放入锥形瓶或容量瓶中,将锥形瓶或容 量瓶略倾斜,管尖靠瓶内壁,移液管垂直(杯壁下流 液体全部留出后停留 15 秒(移液管上标有“快”,应该不停留) 留在管口的液体不要吹出,因为校正时未将这部分体积计算在内(移 液管上标有“吹”,应该将留在管口的液体吹出) 实验中应尽可能使用同一吸量管的同一区段的体积。 4.过滤细节:

上降充通大粤 SHANGHAI JIAO TONG UNIVERSITY 化学问题的实验探究 Fg.8滤纸的折叠方法 过滤时滤纸要撕掉一个角,一是为了与漏斗内壁贴的更紧,加快过滤 速度,且不容易产生气泡:二是撕下的那个角可以用来从烧杯里把剩 余的那一点沉淀刮出来。 六.实验感想 孙密广: 总体实验感受: 开始做的时候感觉到化学是一门以实验为基础的学科,在实验开 始感觉到实验步骤的繁琐和复杂,完成实验再回过头思考整个实验, 每个小的步骤都渗透着理论。进一步加深理论到实践的认知以及对于 细节的把握。感谢老师在实验中的帮助。 知识技能上: 1)通过这一系列的化学实验,成功也好失败也罢都唤醒了我沉睡的 化学知识,没有通过亲身的实践,学到的知识很容易遗忘。 2)学习了一些高中没有学过的化学仪器的使用,诸如移液管、吸量 管、布氏漏斗的使用等等为后续的自主设计实验奠定了基础。 3)通过认真的实验过程的相关错误操作和实验报告中的总结和分析 得出了一些操作的主要事项。 具体的内容都体现在我们小组的实验报告中,在此不在赘述。 心态能力上: 1)团队合作的能力,对于我们这个小组成员基本都没有太多化学基 础的同学来说,显得尤为重要。我们小组尽管可能在操作技巧和精度 上面还差些火候,但是通过合理的分配任务使得每个同学都有合适的 事情可以做,最终效率上不比其他组差多少,值得鼓励。实验中的互 相鼓励和幽默也使我尤为印象深刻,让我在快乐中学习。 2)通过反思实验中的一些配置标准溶液等精细的实验,对耐心和细 心的高要求以及对操作的高规范性。 3)通过汇总资料,查阅文献和书写报告提高了我整体思考的能力
化学问题的实验探究 Fig.8 滤纸的折叠方法 过滤时滤纸要撕掉一个角,一是为了与漏斗内壁贴的更紧,加快过滤 速度,且不容易产生气泡;二是撕下的那个角可以用来从烧杯里把剩 余的那一点沉淀刮出来。 六.实验感想 孙密广: 总体实验感受: 开始做的时候感觉到化学是一门以实验为基础的学科,在实验开 始感觉到实验步骤的繁琐和复杂,完成实验再回过头思考整个实验, 每个小的步骤都渗透着理论。进一步加深理论到实践的认知以及对于 细节的把握。感谢老师在实验中的帮助。 知识技能上: 1)通过这一系列的化学实验,成功也好失败也罢都唤醒了我沉睡的 化学知识,没有通过亲身的实践,学到的知识很容易遗忘。 2)学习了一些高中没有学过的化学仪器的使用,诸如移液管、吸量 管、布氏漏斗的使用等等为后续的自主设计实验奠定了基础。 3)通过认真的实验过程的相关错误操作和实验报告中的总结和分析 得出了一些操作的主要事项。 具体的内容都体现在我们小组的实验报告中,在此不在赘述。 心态能力上: 1)团队合作的能力,对于我们这个小组成员基本都没有太多化学基 础的同学来说,显得尤为重要。我们小组尽管可能在操作技巧和精度 上面还差些火候,但是通过合理的分配任务使得每个同学都有合适的 事情可以做,最终效率上不比其他组差多少,值得鼓励。实验中的互 相鼓励和幽默也使我尤为印象深刻,让我在快乐中学习。 2)通过反思实验中的一些配置标准溶液等精细的实验,对耐心和细 心的高要求以及对操作的高规范性。 3)通过汇总资料,查阅文献和书写报告提高了我整体思考的能力