
化学热力学的 初步概念 Primary Conception of Chemical Thermodynamics
化学热力学的 初步概念

★体系(系统) 和环境(system and environment) 体 系(system):被研究的直接对象 环 境(environment):体系外与其密切相关的部分 敞开体系(open system):与环境有物质交换也有能量交换 封闭体系(closed system):与环境有能量交换无物质交换 孤立体系(isolated system):与环境无物质、能量交换 物质 物质 物质 能星 能量 能量
体 系(system):被研究的直接对象 环 境(environment) : 体系外与其密切相关的部分 敞开体系(open system):与环境有物质交换也有能量交换 封闭体系(closed system):与环境有能量交换无物质交换 孤立体系(isolated system):与环境无物质、能量交换 ★ 体系(系统)和环境 (system and environment)

大状态和状态函数(state and state function) 状 态:由一系列表征体系性质的物理量所确定下来的 体系的存在形式称为体系的状态。是系统的各种物理性 质和化学性质的综合表现。 状态函数:描述系统性质的物理量,例如p,V,T等 跫指漾绿的集秀挚斋要
状 态:由一系列表征体系性质的物理量所确定下来的 体系的存在形式称为体系的状态。是系统的各种物理性 质和化学性质的综合表现。 状态函数: 描述系统性质的物理量,例如 p,V,T等 ★ 状态和状态函数 (state and state function)

热力学平衡态 在不改变环境的情况下,如果体系的所 有性质均不随时间而变化,且当体系与 环境脱离接触后不会引起体系任何性质 的改变,这时我们认为体系处于热力学 平衡状态
热力学平衡态 在不改变环境的情况下,如果体系的所 有性质均不随时间而变化,且当体系与 环境脱离接触后不会引起体系任何性质 的改变,这时我们认为体系处于热力学 平衡状态

平衡态应满足以下四个条件 1.热平衡(Thermal equilibrium) 体系与环境不存在热量的交换 2.力平衡(Mechanical equilibrium) 体系与环境的压力平衡 3.相平衡(Phase equilibrium 体系中每一个相的组成和各物质的数量均不随时间而变化 4.化学平衡(Chemical equilibrium) 当化学反应体系的组成不随时间而变化时,体系达到化学平衡
平衡态应满足以下四个条件 1. 热平衡( Thermal equilibrium ) 体系与环境不存在热量的交换 2.力平衡( Mechanical equilibrium ) 体系与环境的压力平衡 3.相平衡( Phase equilibrium ) 体系中每一个相的组成和各物质的数量均不随时间而变化 4.化学平衡( Chemical equilibrium ) 当化学反应体系的组成不随时间而变化时, 体系达到化学平衡

热力学状态函数的特点 (基本特征) 状态函数之间是互相关联的 只能确定体系当时所处的状态。 (1)状态 一定,状态函数一定。 (2)若状态发生变化, 状态函数也随之而变, 且状态函数的变化值只与始态、终态有关, 而与变化途径无关! 其微小变化在数学上是全微分
热力学状态函数的特点 (基本特征) • 状态函数之间是互相关联的 • 只能确定体系当时所处的状态。 (1) 状态 一定,状态函数一定。 (2) 若状态发生变化, 状态函数也随之而变, 且状态函数的变化值只与始态、终态有关, 而与变化途径无关! • 其微小变化在数学上是全微分

状态函数的分类 强度性质(intensive property) 整体=部分温度T,压力P等 表现系统“质”的本质,不具有加和性 广延性质(extensive property). 广延性质的量值与系统中物质的量成正比,在系统内具 有加和性。体积V,物质的量ns等 表现系统“量”的特征,具有加和性
强度性质(intensive property) 整体=部分 温度T,压力P等 广延性质(extensive property) 广延性质的量值与系统中物质的量成正比,在系统内具 有加和性。体积V,物质的量nB等

★过程 (process 过程是系统从一个平衡态到另一个平衡态的途径。 获爨委绕褶天槁裎甏作胃貔星葚募劽桑奢 状态变化的不同情况, 的类型: 恒温过程(isaothermal process):T1=T2=Tex dT=0 恒压过程(isobaric process):P1=p2=Pex dP=0 恒容过程(constant volume process):V1=V2dV=O 绝热过程(adiabatic process):Q=0 可逆过程(reversible process:体系从终态到始态时,消 除了对环境产生的一切影响,可逆过程是理 想化过程,无限接近热力学平衡态
★ 过程 (process) 恒温过程(isaothermal process): T1 = T2 = Tex dT=0 恒压过程(isobaric process): p1 = p2 = pex dP=0 恒容过程(constant volume process): V1 = V2 dV=0 绝热过程(adiabatic process): Q=0 可逆过程(reversible process): 体系从终态到始态时,消 除了对环境产生的一切影响,可逆过程是理 想化过程,无限接近热力学平衡态。 过程是系统从一个平衡态到另一个平衡态的途径。 按照系统和环境相互作用的不同特点和系统 状态变化的不同情况,可把过程区分为不同 的类型:
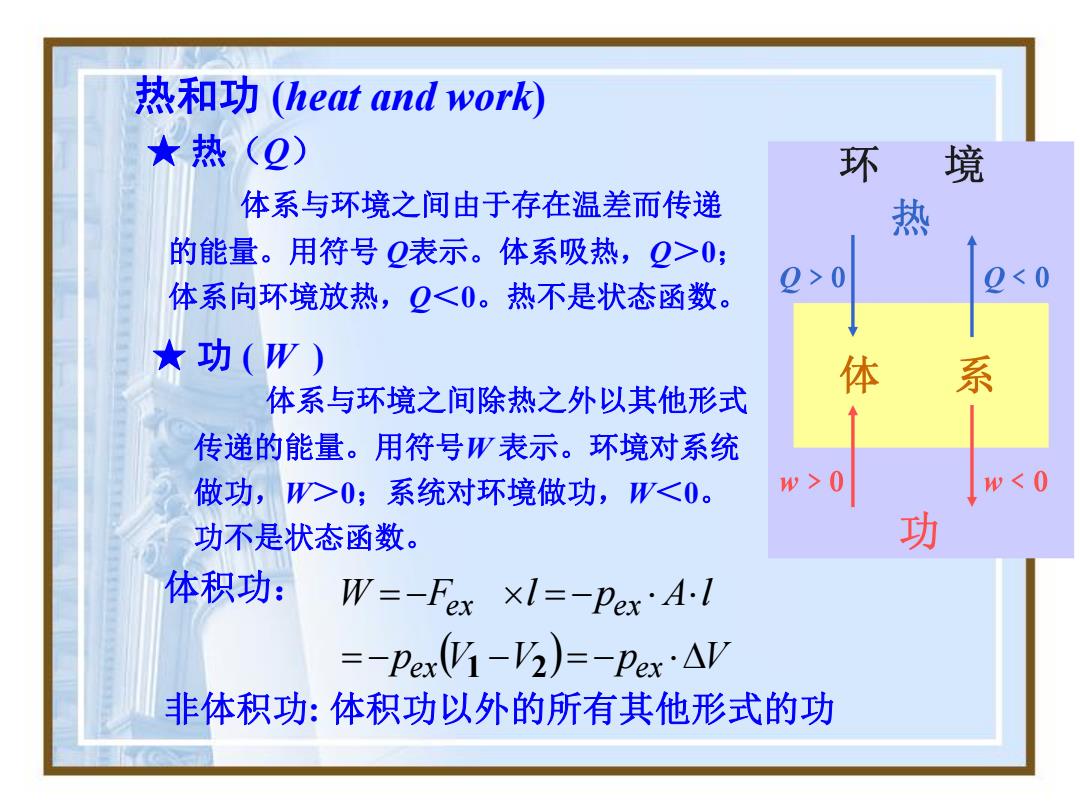
热和功(heat and work) ★热(2) 环 境 体系与环境之间由于存在温差而传递 热 的能量。用符号Q表示。体系吸热,Q>0; 2>0 0;系统对环境做功,W0 w<0 功不是状态函数。 功 体积功: W=-Fex ×I=-pex'AI =-per-3)=-Pex·AV 非体积功:体积功以外的所有其他形式的功
体系与环境之间由于存在温差而传递 的能量。用符号 Q表示。体系吸热,Q>0; 体系向环境放热,Q<0。热不是状态函数。 ★ 热(Q) 热和功 (heat and work) 体系与环境之间除热之外以其他形式 传递的能量。用符号W 表示。环境对系统 做功,W>0;系统对环境做功,W<0。 功不是状态函数。 p V V p V W F l p A l ex ex ex ex 1 2 非体积功: 体积功以外的所有其他形式的功 ★ 功 ( W ) 体积功:

★热力学能(thermodynamic energy) 系统中各物质的各种运动形态的能量之和。包括分子 相互作用的位能,分子的移动能、转动能、振动 能,电子及核的运动能等,用符号U表示。 系统的状态一定,则其热力学能就一定,因此,U是 状态函数,是系统的一个广延性质。热力学能变 化只与始态、终态有关,与变化途径无关。 U)-U1=△U 由于系统内部粒子的运动方式及其相互作用非常复杂, 热力学能的绝对值无法测量,但能测量出其变化 值
系统中各物质的各种运动形态的能量之和。包括分子 相互作用的位能,分子的移动能、转动能、振动 能,电子及核的运动能等,用符号U表示。 系统的状态一定,则其热力学能就一定,因此,U是 状态函数,是系统的一个广延性质。热力学能变 化只与始态、终态有关,与变化途 径无关。 由于系统内部粒子的运动方式及其相互作用非常复杂, 热力学能的绝对值无法测量,但能测量出其变化 值。 U2 U1 U ★热力学能 (thermodynamic energy)