
第一篇能源篇 上海交通大学化学化工学院 大学化学教研室 知识点导读-1 ·基本概念:功、热、能量(动能、势能、热功交换当量) 体系、环境、状态函数以及性质(盖斯定律): ·热力学能U,热力学第一定律,等容反应热: ·化学反应热(焓变),热力学函数H,等压反应热,化学 反应热的计算(几种方法): ·化学反应热的几种计算方法(盖斯定律和标准摩尔生成热 法); ·S的引入,热力学第二、第三定律 ·化学反应自发进行的判别:G的引入,吉布斯自由能变的 计算方法,反应方向的判定: ·标准和非标准状态吉布斯自由能变的关系,浓度商(压力 商)以及平衡常数 1
1 第一篇 能源篇 上海交通大学化学化工学院 大学化学教研室 知识点导读-1 • 基本概念:功、热、能量(动能、势能、热功交换当量) 体系、环境、状态函数以及性质(盖斯定律); • 热力学能U,热力学第一定律,等容反应热; • 化学反应热(焓变),热力学函数H,等压反应热,化学 反应热的计算(几种方法); • 化学反应热的几种计算方法(盖斯定律和标准摩尔生成热 法); • S的引入,热力学第二、第三定律 • 化学反应自发进行的判别:G的引入,吉布斯自由能变的 计算方法,反应方向的判定; • 标准和非标准状态吉布斯自由能变的关系,浓度商(压力 商)以及平衡常数

知识点导读-2 ·平衡以及平衡的移动 。 化学反应速率(活化能); ·影响反应速率的因素: 催化原理及于简单反应机理的关系(第四篇第十一 章) ·氧化还原反应与原电池: ·标准电极电势; ·非标准状态下的电极电势的计算 —能斯特方程 。 电解、电镀及防腐 ·热力学: 研究热和其他形式能量间的转换规律的科学, 它研究某个体系发生变化时,引起体系的物 理量发生的变化。 ·化学热力学: -研究化学反应过程中能量转换与传递的科学。 2
2 知识点导读-2 • 平衡以及平衡的移动 • 化学反应速率(活化能); • 影响反应速率的因素; • 催化原理及于简单反应机理的关系(第四篇第十一 章) • 氧化还原反应与原电池; • 标准电极电势; • 非标准状态下的电极电势的计算——能斯特方程; • 电解、电镀及防腐 • 热力学: - 研究热和其他形式能量间的转换规律的科学, 它研究某个体系发生变化时,引起体系的物 理量发生的变化。 • 化学热力学: - 研究化学反应过程中能量转换与传递的科学

1.1化学热力学知识点 1.1.1基本概念 (1)体系和环境(system Surroundings and surroundings) ·被研究的物质体系(对象) 称体系(系统); ter ·体系以外,与体系相联系 的部分称环境。 Energy 体系的分类: 我们的 研究对象 敞开体系 封闭体系 孤立体系 (open (closed (isolated system) system) system) 物质交换 有 无 无 能量交换 有 有 无 3
3 1.1 化学热力学知识点 1.1.1基本概念 (1)体系和环境(system and surroundings) • 被研究的物质体系(对象) 称体系(系统); • 体系以外,与体系相联系 的部分称环境。 体系的分类: 敞开体系 (open system) 封闭体系 (closed system) 孤立体系 (isolated system) 物质交换 有 无 无 能量交换 有 有 无 我们的 研究对象

体系的性质 热力学变量 ·量度性质(广延性质) 具有加和性,如V,m ·强度性质 不具有加和性,如p,C (2)状态和状态函数 (state and state function 1.状态函数:决定体系热力学状态的物理量称 为状态函数,如温度、压力、体积、密度等。 2.状态:热力学平衡状态,热平衡、力学平衡、 相平衡、化学平衡
4 体系的性质 热力学变量 • 量度性质(广延性质) 具有加和性,如V, m • 强度性质 不具有加和性,如ρ, C (2)状态和状态函数 (state and state function) 1. 状态函数:决定体系热力学状态的物理量称 为状态函数,如温度、压力、体积、密度等。 2. 状态:热力学平衡状态,热平衡、力学平衡、 相平衡、化学平衡
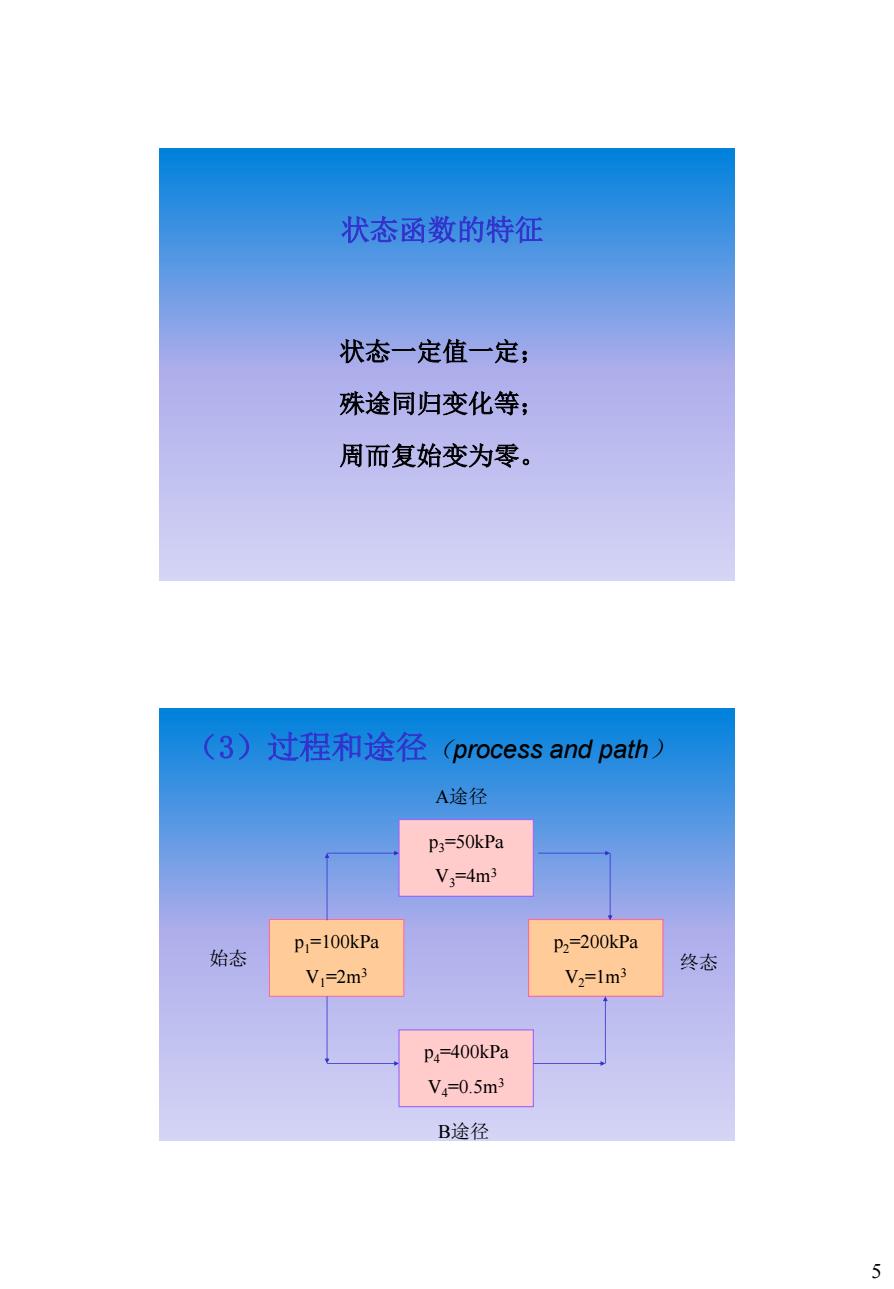
状态函数的特征 状态一定值一定 殊途同归变化等; 周而复始变为零。 (3)过程和途径 (process and path) A途径 p3=50kPa V3=4m3 P=100kPa P2=200kPa 始态 V1=2m3 V2=1m3 终态 P4=400kPa V4=0.5m3 B途径 5
5 状态函数的特征 状态一定值一定; 殊途同归变化等; 周而复始变为零。 (3)过程和途径(process and path) p2=200kPa V2=1m3 p1=100kPa V1=2m3 p4=400kPa V4=0.5m3 B途径 p3=50kPa V3=4m3 A途径 始态 终态

热力学中常见的过程: ·等温过程:体系的始态温度与终态温度相同,并等 于环境的温度:(T,=T2=T环) 。等压过程:始态、终态的压力与环境相同 (p1=p2=P环) 等容过程:体系的体积不发生变化(V,=V,) 绝热过程:体系与环境之间无热量交换(Q=0) 。 循环过程:过程进行后,体系重新回到初始状态 (各种状态函数的增量为零)。 自发过程:一定条件下,不需要外加能量就能够 自动进行的过程。 (4)功和热 (work and heat) 热 热力学中把体系与环境之间因温差而 变化的或传递的能量称为热,以Q表示 体系吸热: + 体系放热: Endothermic Exothermic System Q>0 Q<0 Surroundings 6
6 热力学中常见的过程: • 等温过程:体系的始态温度与终态温度相同,并等 于环境的温度;(T1=T2=T环) • 等压过程:始态、终态的压力与环境相同 (p1=p2=p环) • 等容过程:体系的体积不发生变化(V1=V2) • 绝热过程:体系与环境之间无热量交换(Q=0) • 循环过程:过程进行后,体系重新回到初始状态 (各种状态函数的增量为零)。 • 自发过程:一定条件下,不需要外加能量就能够 自动进行的过程。 (4)功和热 (work and heat) 热——热力学中把体系与环境之间因温差而 变化的或传递的能量称为热,以Q表示 体系吸热: + 体系放热: - System Surroundings Q>0 Q<0 Endothermic Exothermic
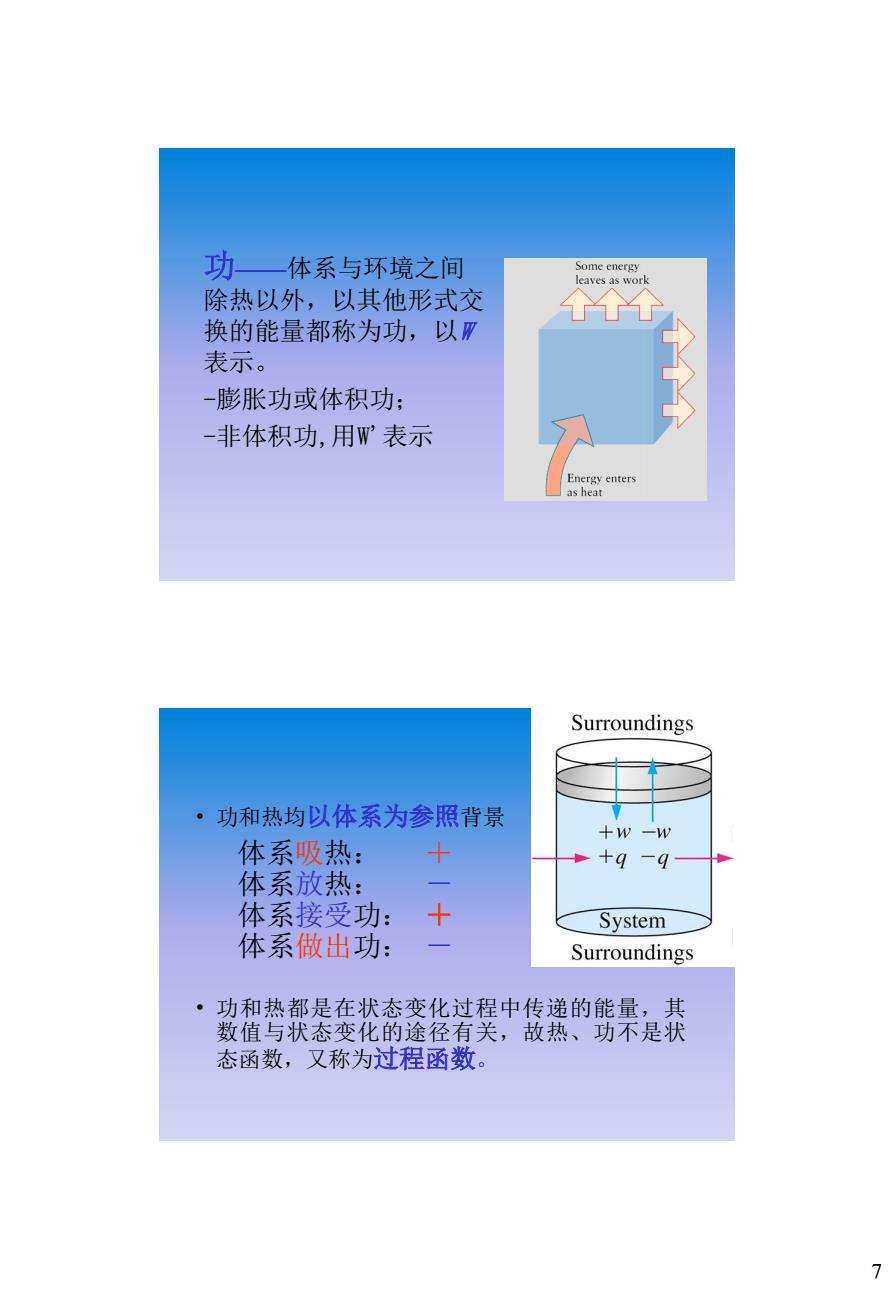
功一体系与环境之间 Some energy leaves as work 除热以外,以其他形式交 个个 换的能量都称为功,以丽 表示。 -膨胀功或体积功: 一非体积功,用W表示 Energy enters as heat Surroundings ·功和热均以体系为参照背景 +w-W 体系吸热: 十 体系放热: 体系接受功: + System 体系做出功: Surroundings ·功和热都是在状态变化过程中传递的能量,其 数值与状态变化的途径有关,故热、功不是状 态函数,又称为过程函数。 7
7 功——体系与环境之间 除热以外,以其他形式交 换的能量都称为功,以W 表示。 -膨胀功或体积功; -非体积功,用W'表示 • 功和热均以体系为参照背景 体系吸热: + 体系放热: - 体系接受功: + 体系做出功: - • 功和热都是在状态变化过程中传递的能量,其 数值与状态变化的途径有关,故热、功不是状 态函数,又称为过程函数

状态函数与过程函数的关系之一 ·状态函数:状态一定值一定,其变化只 与体系变化过程的始态和终态有关,而与 方式或途径无关 ·过程函数:必与发生变化的具体途径有 关,伴随着途径而定 状态函数 过程函数 (5)热力学能U(内能) [thermodynamic energy(internal energy)] 体系内部一切能量的总和: e a.分子或原子的位能、振动能、转动能 平动能、电子的动能以及核能等。 b.绝对值无法测量或计算,只能计算△U。 c.U是体系的状态函数。 d.理想气体的U只是温度的函数, 恒温过 Vibrational 程△U=0。 e.具有加和性。 8
8 状态函数与过程函数的关系之一 • 状态函数:状态一定值一定,其变化只 与体系变化过程的始态和终态有关,而与 方式或途径无关 • 过程函数:必与发生变化的具体途径有 关,伴随着途径而定 状态函数 过程函数 (5)热力学能U(内能) [thermodynamic energy (internal energy)] 体系内部一切能量的总和: a.分子或原子的位能、振动能、转动能、 平动能、电子的动能以及核能等。 b.绝对值无法测量或计算,只能计算ΔU。 c.U是体系的状态函数。 d.理想气体的U只是温度的函数,恒温过 程△U=0。 e.具有加和性

1.1.2热力学第一定律 。数学表达式:△U=Q+W =Q+p△V+W ·研究内容:体系变化过程中热力学能、功、 热的转换方式。 。实质:能量守恒和转化定律。 能量的总量是守恒的,不会凭空产生,也不会凭空 消失,只可能从一种形式转化为另一种形式。 ·在孤立体系中能量的总值恒定不变。 1.1.3化学反应的热效应 1.化学反应热 (1)定义: 当产物与反应物温度相同且化学反应时 只作膨胀功的条件下,化学反应过程中体系 吸收或放出的热量称为反应热
9 1.1.2热力学第一定律 • 数学表达式:ΔU = Q+W = Q + pΔV + W′ • 研究内容:体系变化过程中热力学能、功、 热的转换方式。 • 实质:能量守恒和转化定律。 能量的总量是守恒的,不会凭空产生,也不会凭空 消失,只可能从一种形式转化为另一种形式。 • 在孤立体系中能量的总值恒定不变。 1.1.3 化学反应的热效应 1.化学反应热 (1)定义: 当产物与反应物温度相同且化学反应时 只作膨胀功的条件下,化学反应过程中体系 吸收或放出的热量称为反应热

(2)化学反应热的类型: 恒容反应热: △U=Q+p△V; 因为 △V=0: 所以 △Uy=Qy Q,具有状态函数的性质一恒容条件下的 盖斯定律。 ⅱ恒压反应热: 等压条件下,p△V=△(W) △U=Q+p△V=Q+△(W) Q=△U-p△V=△U-△(pW) = (U2-U1)+(p2V2p1V1) 定义一个新的热力学函数一焙H(enthalpy)) H=U+pV Qp=2-H1=AH。 Q,具有状态函数的性质一恒压条件下的盖斯定律。 10
10 (2)化学反应热的类型: ⅰ 恒容反应热: ΔU=Q+pΔV; 因为 ΔV=0; 所以 ΔUV=QV QV具有状态函数的性质——恒容条件下的 盖斯定律。 ⅱ 恒压反应热 等压条件下, pΔV = Δ(pV) ΔU = Q + pΔV = Q +Δ(pV) Q = ΔU - pΔV = ΔU -Δ(pV) = (U2 -U1)+(p2V2 -p1V1) 定义一个新的热力学函数——焓H (enthalpy) H = U + pV Qp = H2-H1 = H p Qp具有状态函数的性质——恒压条件下的盖斯定律