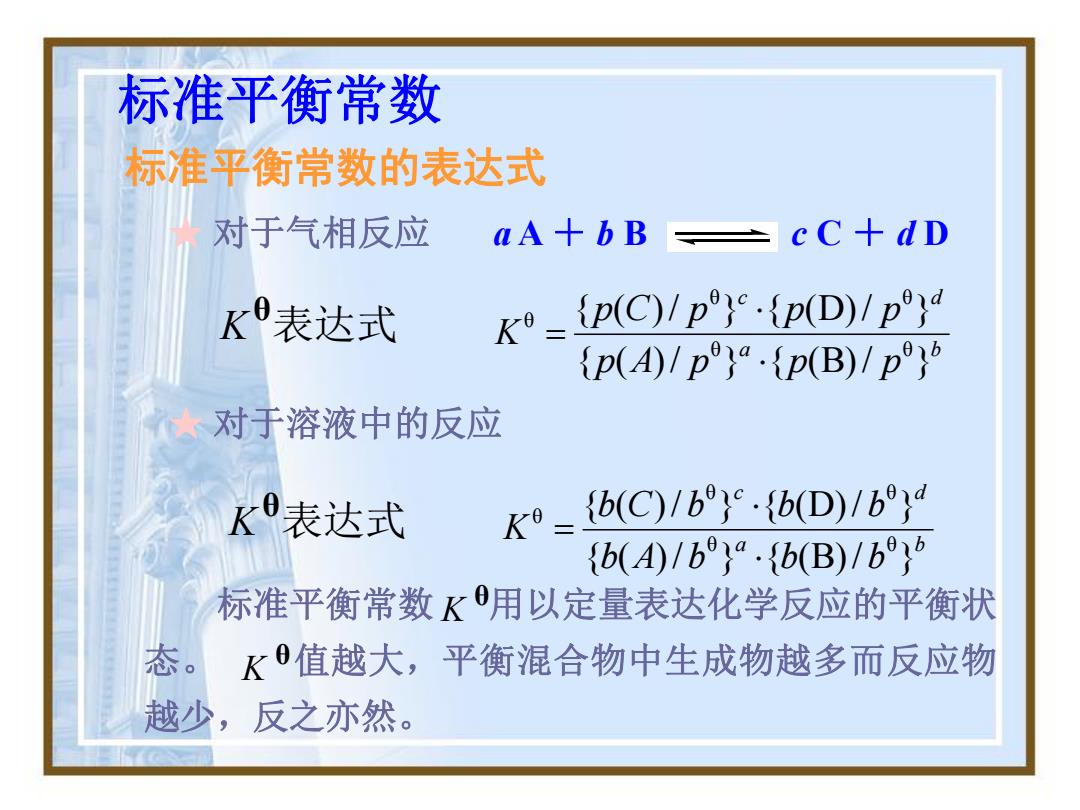
标准平衡常数 标准平衡常数的表达式 对于气相反应 aA+bB ÷cC+dD K表达式 {p(C)1p}{pD)1p} p(A)Ipp(B)/p ★对于溶液中的反应 K9表达式 K9= {b(C)/b}.{b(D)/b,d {b()/b}·{b(B)/b}6 标准平衡常数K用以定量表达化学反应的平衡状 态。 K值越大,平衡混合物中生成物越多而反应物 越少,反之亦然
标准平衡常数 标准平衡常数的表达式 ★ 对于溶液中的反应 K θ表达式 a b c d b A b b b b C b b b K { ( )/ } { (B)/ } { ( )/ } { (D)/ } θ θ θ θ θ 标准平衡常数 用以定量表达化学反应的平衡状 态。 值越大,平衡混合物中生成物越多而反应物 越少,反之亦然。 θ K θ K K θ表达式 a b c d p A p p p p C p p p K { ( )/ } { (B)/ } { ( )/ } { (D)/ } θ θ θ θ θ ★ 对于气相反应 a A + b B c C + d D

对通式 aA(s)+bB(aq) ±cC(aq+dD(g) 所表示的多相反应而言,K0的表达式则为 K0 b(C)/bc.ip(D)pa (b(B)/6) △K是无量纲的量 ▲K是温度的函数,与浓度、分压无关 ▲标准平衡常数表达式必须与化学反应计量式相对应
b c d b b b b p p K { ( )/ } { ( )/ } { ( ) } B θ C D ★ 对通式 ▲ 是无量纲的量 ▲ 是温度的函数,与浓度、分压无关 ▲ 标准平衡常数表达式必须与化学反应计量式相对应 θ K θ K 所表示的多相反应而言, K θ 的表达式则为 a A(s) + b B(aq) c C(aq) + d D(g)

标准平衡常数与标准自由能变 表达K9与△,G(T)之间关系的式子叫范特霍 夫等温式: A,Gm(T)=△,G(T)+RTln p(C)/p.p(D)/pd {p④1pa.{pB)/pb 如果系统达到平衡,则不但意味着△G(T①=0,而 且意味着反应商等于标准平衡常数,则 △,G0(T)=-RT InK 或 lnK=-△G(T)/RT
标准平衡常数与标准自由能变 表达 与 之间关系的式子叫范特霍 夫等温式: ( ) θ fGm T ( ) ( ) ln θ rGm T rGm T RT a b c d p A p p p p C p p p { ( )/ } { ( )/ } { ( )/ } { ( )/ } θ θ θ θ B D 如果系统达到平衡, 则不但意味着△rGm(T)=0, 而 且意味着反应商等于标准平衡常数 ,则 或 θ θ r m G (T) RT lnK lnK G (T)/ RT θ r m θ θ K

③)温度对化学平衡的影响 K(T)是温度的函数。温度变化引起K(T)的变化, 导致化学平衡的移动: 对于放热反应,AK, 平衡向逆向移动: 对于吸热反应,△>0,温度升高,K增大,Q<K, 平衡向正向移动。 9 △H1-1 K 2.303R
(3) 温度对化学平衡的影响 是温度的函数。温度变化引起 的变化, 导致化学平衡的移动; 对于放热反应, , 平衡向逆向移动; 对于吸热反应, >0,温度升高, 增大, Q < , 平衡向正向移动。 θ rHm θ rHm K (T) θ θ K θ K θ K θ K K (T) θ 1 2 θ r m θ 1 θ 2 1 1 2.303 lg R T T H K K

化学反应速率与化 学动力学初步概念 Primary Conception of Chemical Reaction Rate and Chemical Kinetics
化学反应速率与化 学动力学初步概念
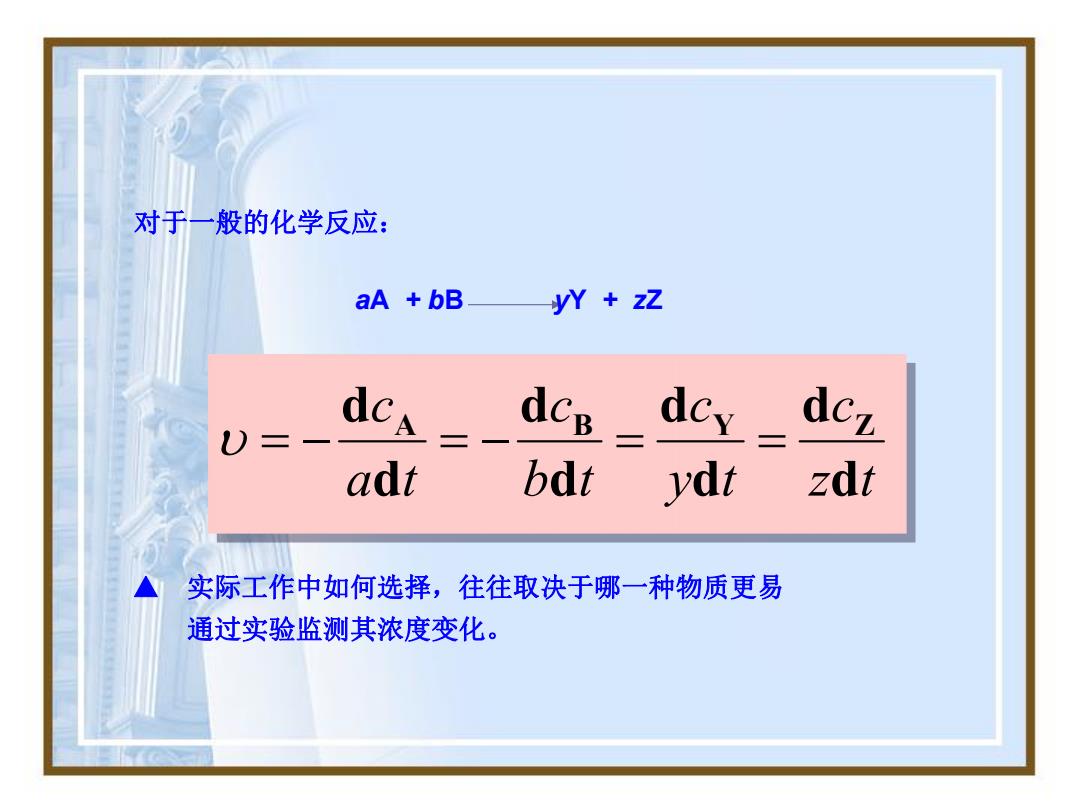
对于一般的化学反应: aA +bB yY zZ dc dcB dcy. dcz U)= adt bdt ydt zdt 实际工作中如何选择,往往取决于哪一种物质更易 通过实验监测其浓度变化
z t c y t c b t c a t c d d d d d d d d A B Y Z ▲ 实际工作中如何选择,往往取决于哪一种物质更易 通过实验监测其浓度变化。 aA + bB yY + zZ 对于一般的化学反应:

反应速率理论简介 Brief introductory to reaction rate theory 碰撞理论 Collision theory 过渡状态理论Transition state theory 活化能E Activation energy
反应速率理论简介 Brief introductory to reaction rate theory 1 碰撞理论 Collision theory 2 过渡状态理论 Transition state theory 3 活化能 Ea Activation energy

发生有效碰撞的两个基本前提: 碰撞粒子的动能必须足够大 碰撞的几何方位要适当
发生有效碰撞的两个基本前提: ● 碰撞粒子的动能必须足够大 ● 碰撞的几何方位要适当
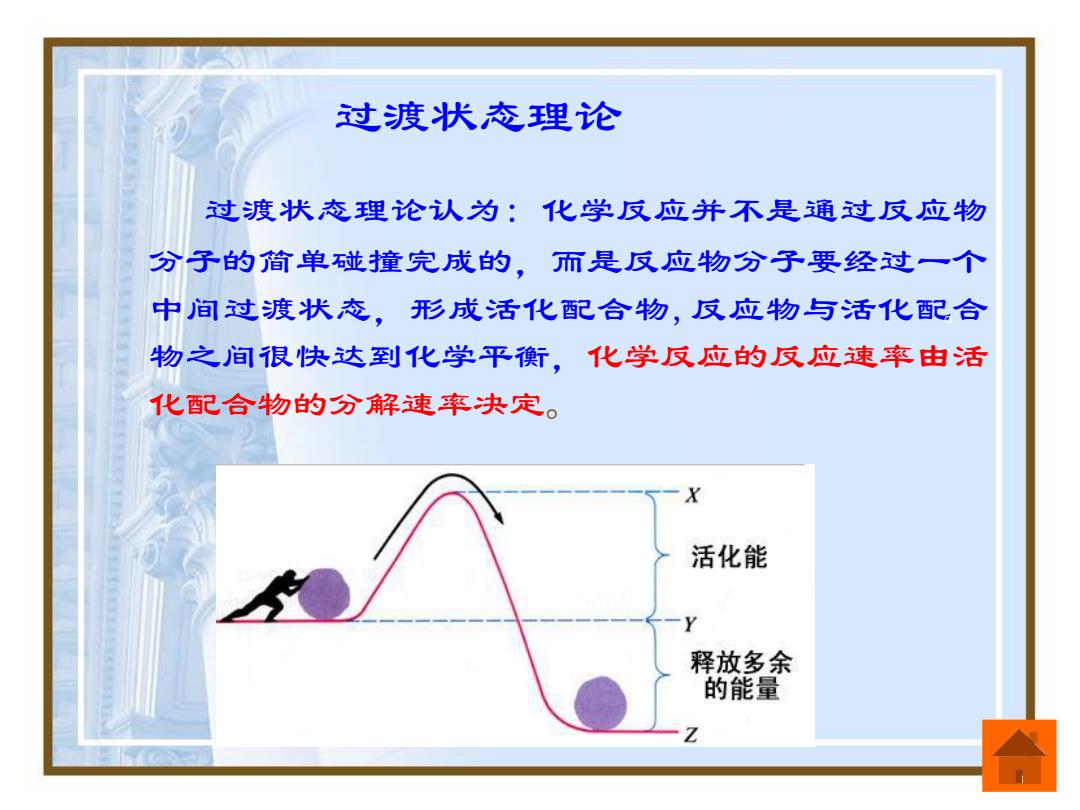
过渡状态理论 过渡状态理论认为:化学反应并不是通过反应物 分子的简单碰撞完成的,而是反应物分子要经过一个 中间过渡状态,形成活化配合物,反应物与活化配合 物之间很快达到化学平斯,化学反应的反应速率由活 化配合物的分解速率快定。 活化能 释放多余 的能量
过渡状态理论 过渡状态理论认为: 化学反应并不是通过反应物 分子的简单碰撞完成的,而是反应物分子要经过一个 中间过渡状态,形成活化配合物,反应物与活化配合 物之间很快达到化学平衡,化学反应的反应速率由活 化配合物的分解速率决定。

影响化学反应速率的因素 Influential factors on chemical reaction rate 1.浓度对化学反应速率的影响:元反应的速 率方程 Effect of concentration on the rate of chemical reaction:rate equation of elemental reaction
1.浓度对化学反应速率的影响:元反应的速 率方程 Effect of concentration on the rate of chemical reaction: rate e q u a t i o n o f e l e m e n t a l r e a c t i o n 影响化学反应速率的因素 Influential factors on chemical reaction rate