
教 ©了解氧化还原滴定法的原理和特,点; ©掌握条件电位及其影响因素; 学 ©掌握条件平衡常数及其影响因素。 ©掌握影响氧化还原反应速度的因素
教 学 目 标 ☺ 了解氧化还原滴定法的原理和特点; ☺ 掌握条件电位及其影响因素; ☺ 掌握条件平衡常数及其影响因素。 ☺ 掌握影响氧化还原反应速度的因素

氧化还原滴定法概述 >定义:以氧化还原反应为基础的滴定分析方法。 >实质:电子的转移. >特点:1)机理复杂、多步反应 2)有的程度虽高但速度缓慢。 3)有的伴有副反应而无明确计量关系, >分类:碘量法、高锰酸钾法、重铬酸钾法、 亚硝酸钠法、溴量法、铈量法, 广泛,直接或间接测定无机物、有机物
氧化还原滴定法 概 述 ➢ 定 义:以氧化还原反应为基础的滴定分析方法。 ➢ 实 质:电子的转移. ➢ 特 点:1)机理复杂、多步反应. 2)有的程度虽高但速度缓慢. 3)有的伴有副反应而无明确计量关系. ➢ 分 类: 碘量法、高锰酸钾法、重铬酸钾法、 亚硝酸钠法、溴量法、铈量法. ➢ 应 用:广泛,直接或间接测定无机物、有机物
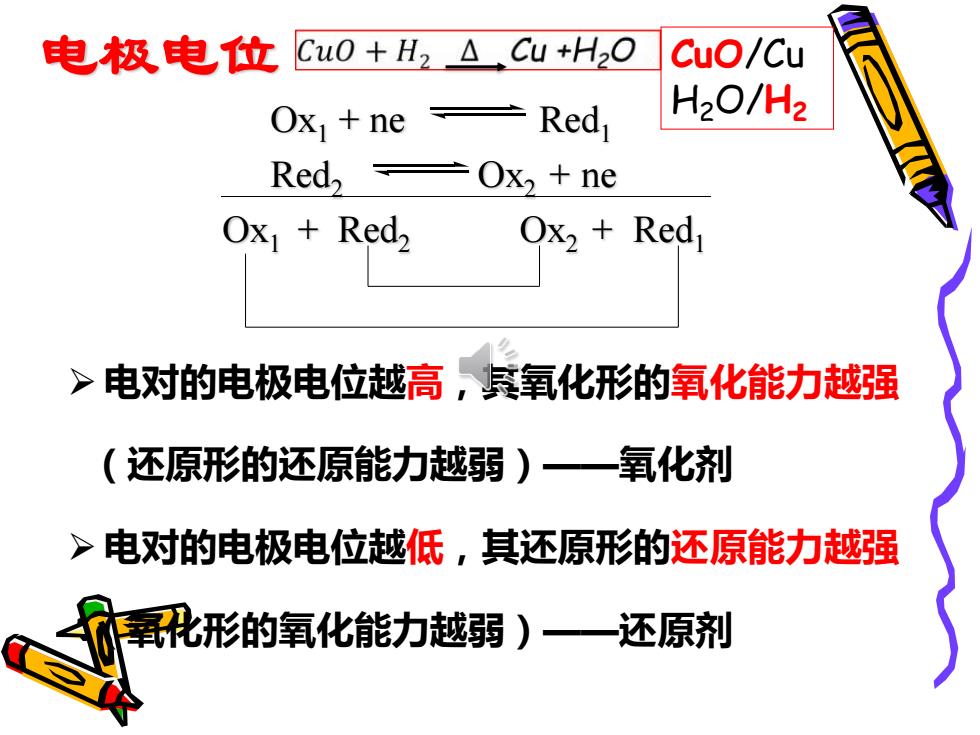
电极电位 Cu0+H2△Cu+H2O CuO/Cu Ox ne H2O/Hz Red,Ox2 ne Ox Red2 Ox2 Red >电对的电极电位越高氧化形的氧化能力越强 (还原形的还原能力越弱)—氧化剂 >电对的电极电位越低,其还原形的还原能力越强 氧化形的氧化能力越弱)—还原剂
电极电位 ➢ 电对的电极电位越高,其氧化形的氧化能力越强 (还原形的还原能力越弱)——氧化剂 ➢ 电对的电极电位越低,其还原形的还原能力越强 (氧化形的氧化能力越弱)——还原剂 Ox1 + ne Red1 Red2 Ox2 + ne Ox1 + Red2 Ox2 + Red1 CuO/Cu H2O/H2

>可逆电对:在反应的任一瞬间都能建立起平衡衡 合能斯特公式。Fe3+/Fe2+2/;Fe(CN63-/Fe(CN6 >不可逆电对:不能在反应的任一瞬间建立起平衡 实际电势与理论电势相较大。以能斯特公式计算 所得的结果,仅作参考。 Mn04-Mn2+,Cr2022-/Cr3+,S4062-/S2032
➢ 可逆电对:在反应的任一瞬间都能建立起平衡,符 合能斯特公式。Fe3+ /Fe2+ ; I2 /I- ; Fe(CN)6 3- /Fe(CN)6 4- ➢ 不可逆电对:不能在反应的任一瞬间建立起平衡, 实际电势与理论电势相差较大。以能斯特公式计算 所得的结果,仅作参考。 ➢ MnO4- /Mn2+ ,Cr2O7 2- /Cr3+ ,S4O6 2- /S2O3 2-

>对称电对:氧化态与还原态的系数相同。 如:Fe3++e=Fe2+; Mn04+8H++5e=Mn2++4H20 >不对称电对:氧化态与还原态系数不同。 如:2+2e=2; Cr2072-+14H++6e=2Cr3++7H20
➢ 对称电对:氧化态与还原态的系数相同。 如: Fe3+ + e = Fe2+; MnO4 - + 8H+ + 5e = Mn2+ + 4H2O ➢ 不对称电对:氧化态与还原态系数不同。 如: I2 + 2e = 2 I - ; Cr2O7 2- + 14H+ + 6e = 2Cr3+ + 7H2O

能斯特方程 1.活度表示式 a1d=p°+2303R7 aox nF ARed 4=0+0059g ox (25C) 2.浓度表示式 dox =Yox[Ox],aRed =YRed[Re d] →=p°+0059g,bl01 n YRed[Re d]
1. 活度表示式 2. 浓度表示式 d Ox Ox d a a n F RT Re / Re ln 2.303 = + lg (25 ) 0.059 0 Re /Re C a a n d O x O x d = + [ ] [Re ] Re Re a Ox a d O x O x d d = , = [Re ] [ ] lg 0.059 Re /Re d Ox n d O x O x d = + 能斯特方程

3.分析浓度表示式 IOx]-Cox,[Red]-CRed d0x CRed →=6+059g之 n YRedCRedOOx 0059g7oau+0.059 n 标准电极电位 YRedOx →标准电极电位 n→半反应中的电子转移数 当a=lol/L时→ox/e4=9 为常数,仅与电对本身性质和温度有关
3.分析浓度表示式 标准电极电位 d d O x O x C d C O x Re Re [ ] [Re ] = , = d d O x O x O x d O x d C C n Re Re Re /Re lg 0.059 = + d O x d O x O x d C C n n Re Re Re lg 0.059 lg 0.059 = + + →标准电极电位 n → 半反应中的电子转移数 当a =1mol / L时 Ox / Re d = 为常数,仅与电对本身性质和温度有关

条件电位 在实际应用时,存在着两个问题: ()不知道活度a(或活度系数y): a=y c (2)离子在溶液中可能发生:络合,沉淀等副反应。 (副反应系数:aMMf/M; [考虑到这两个因素,需要引入条件电极电位! 令°=0°+0059goad →条件电位 YRedaOx
在实际应用时,存在着两个问题: (1) 不知道活度 a(或活度系数 ): a = c (2) 离子在溶液中可能发生: 络合,沉淀等副反应。 ( 副反应系数:αM=[M'] / [M] ; [考虑到这两个因素,需要引入条件电极电位! 条件电位 令 = + 条件电位 d O x O x d n Re ' Re lg 0.059

讨论 °=° +00591gu n 在一定条件下,当氧化态和还原态的浓度均为1ol/儿 时,校正了离子强度及副反应的影响后实际电极电位。 当离子强度和副反应系数等条件不变的情况下为一常数。 >与条件稳定常数与稳定常数K之间的关系一样。条件电位 反映了离子强度与各种副反应影响的总结果,用条件电 极电位能更准确判断氧化还原反应进行的方向、次序及 反应完成的程度
讨 论 ➢ 在一定条件下,当氧化态和还原态的浓度均为1mol/L 时,校正了离子强度及副反应的影响后实际电极电位。 当离子强度和副反应系数等条件不变的情况下为一常数。 ➢ 与条件稳定常数与稳定常数K之间的关系一样。条件电位 反映了离子强度与各种副反应影响的总结果,用条件电 极电位能更准确判断氧化还原反应进行的方向、次序及 反应完成的程度。 d Ox Ox d n Re ' Re lg 0.059 = +

条件电位的影响因素 1.离子强度(盐效应) 离子强度改变→f改变→发生改变 盐效应不易计算,可忽略→规定y=1 →0°≈p°+0.059 aRed n
条件电位的影响因素 离子强度改变 f 改变 ' 发生改变 1. 离子强度(盐效应) O x d n ' Re lg 0.059 + 盐效应不易计算,可忽略 规定 =1