
基本内容 ·绪论 题型分布 ·误差与数据处理 计算 单选题一50题4选1 50*1=50分 ·滴定概论与酸碱滴定计算 单选题二10题 5选1 ·络合滴定 计算 10*3=30分 ·氧化还原滴定 计算 多选题5题 5选2/>2 ·沉淀滴定 5*2=10分 判断题:10*1=10分
基本内容 • 绪 论 • 误差与数据处理 计算 • 滴定概论与酸碱滴定计算 • 络合滴定 计算 • 氧化还原滴定 计算 • 沉淀滴定 单选题一 50题 4选1 50*1=50分 单选题二 10题 5选1 10*3 =30分 多选题 5题 5选2/>2 判断题:

知识框架 绪论与误差 ·分析化学的分类、误差的分类与判断(系统误差 还是偶然误差)、有效数字的判断(记特例) 相关公式:(相对)平均偏差、(相对)标准 偏差RSD 偶然误差的特点(学会分析判断)思维训练 ·显著性检验与置信区间(学会计算): 1、精密度的检验2、准确度的检验(有μ) 单边o双边 如何查表
知识框架 绪论与误差: • 分析化学的分类、误差的分类与判断(系统误差 还是偶然误差)、有效数字的判断(记特例) • 相关公式: (相对)平均偏差、(相对)标准 偏差RSD • 偶然误差的特点(学会分析判断)思维训练 • 显著性检验与置信区间(学会计算): 1、精密度的检验 2、准确度的检验(有μ) 单边or双边 如何查表

网 酸碱滴定 一元弱酸碱HA 多元弱酸碱H2A,H3A 判断条件,确定用近 似以式或最简式 两性物质HA 类两性物质A+HB 先用最简式计算,再 混合酸碱:强+弱.弱+弱 看是否合理 共轭酸碱:HA+A
酸碱滴定 ⚫一元弱酸碱 HA ⚫多元弱酸碱 H2A, H3A ⚫两性物质 HA- ⚫类两性物质 A-+HB ⚫混合酸碱:强+弱. 弱+弱 ⚫ 共轭酸碱:HA+A- 判断条件, 确定用近 似式或最简式 先用最简式计算,再 看是否合理

酸碱滴定应用 计算题解题思路: ·化学计量点sp时,反应按化学计量关系进行 一一 定量 关系; ·滴定终点ep一一指示剂判断: ·反应过程中【H+】的计算一一先判断体系,一般用最简 式; ·注意质量(实验数据)与摩尔数的换算(理论值) 学会分析: ·正误差还是负误差? ·混合碱分析一一判断组成、计算含量 实际情况下如何选择指示剂
• 化学计量点sp时,反应按化学计量关系进行 —— 定量 关系; • 滴定终点ep —— 指示剂 判断; • 反应过程中【H+】的计算 —— 先判断体系,一般用最简 式; • 注意质量(实验数据)与摩尔数的换算(理论值) • 正误差还是负误差? • 混合碱分析—— 判断组成、计算含量 • 实际情况下如何选择指示剂 酸碱滴定应用

阅 非水滴定 学会分析: 一一定性分析与定量计算相结合强化逻辑思维训练 。1 非水溶剂的性质:Kw与Ks ·滴定弱酸碱用什么溶剂 判断溶质在不同溶剂中的酸碱性(区分均化效应) 表观酸/碱常数 ·判断溶质在不同溶剂中反应的完全程度 反应的平衡常数
非水滴定 • 非水溶剂的性质: Kw 与 Ks • 滴定弱酸碱用什么溶剂 • 判断溶质在不同溶剂中的酸碱性(区分/均化效应) 表观酸/碱常数 • 判断溶质在不同溶剂中反应的完全程度 反应的平衡常数
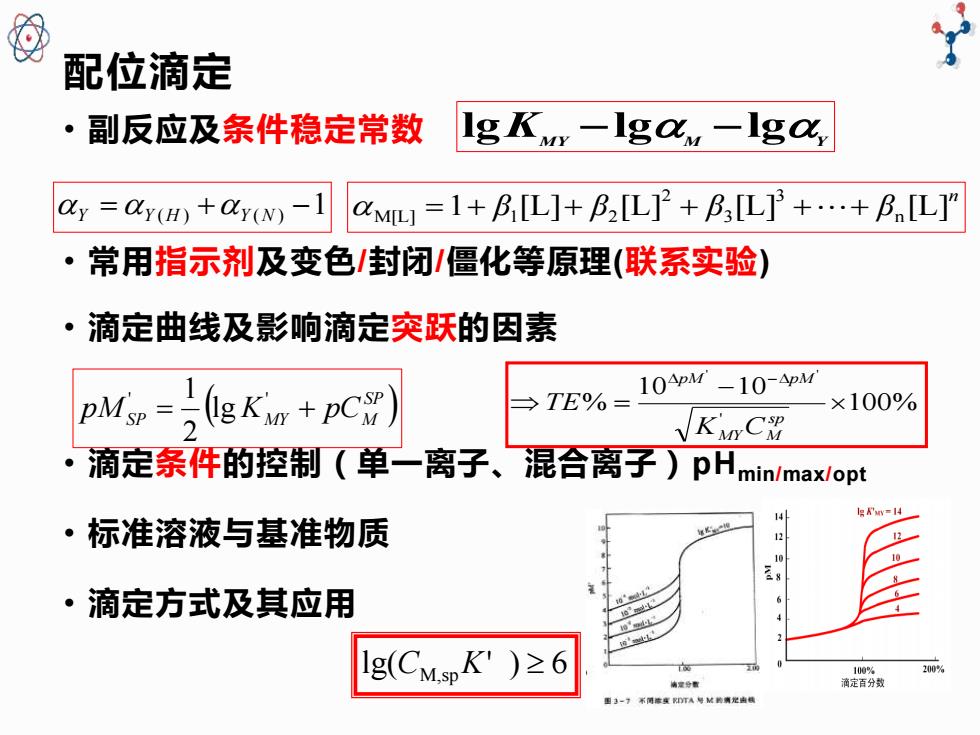
配位滴定 ·副反应及条件稳定常数 Ig Kvy-Igav,-Iga, ay =dy()+ay()-1 axM叫=1+BL]+B2[L]+L]3+.+BnIL]” ·常用指示剂及变色/封闭/僵化等原理(联系实验) ·滴定曲线及影响滴定突跃的因素 pM=)gKw+pC) TE%= 10APM -10-APM ×100% KMyC 滴定条件的控制(单一离子、混合离子)PHmin/max/opt lg &'sry=14 ·标准溶液与基准物质 ·滴定方式及其应用 lg(CMspK')≥6 清定清分我 200% 病定分重
配位滴定 • 副反应及条件稳定常数 • 常用指示剂及变色/封闭/僵化等原理(联系实验) • 滴定曲线及影响滴定突跃的因素 • 滴定条件的控制(单一离子、混合离子)pHmin/max/opt • 标准溶液与基准物质 • 滴定方式及其应用 K MY M Y lg −lg −lg Y =Y (H ) +Y (N ) −1 n 1 β [L] β [L] β [L] β [L] n 3 3 2 M[L] = + 1 + 2 + ++ ( ) SP pMSP = KMY + pCM ' ' lg 2 1 100% 10 10 % ' ' ' − = − sp MY M pM pM K C TE lg(CM,spK' ) 6
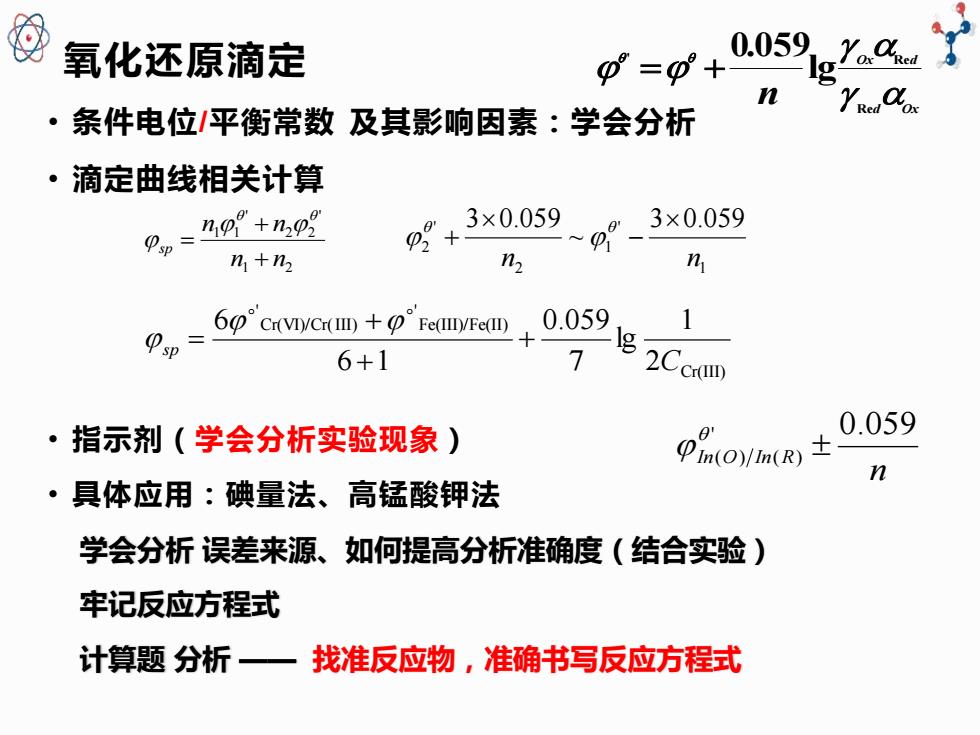
氧化还原滴定 p=0+ 0.059-YoC ·条件电位/平衡常数及其影响因素:学会分析 ·滴定曲线相关计算 9p=%p”+2 0+ ×0.059 3×0.059 n1+n2 n n 5rvcramau 0.059 1 g- 6+1 7 Ccrom ·指示剂(学会分析实验现象) Oyin(K) 0.059 n ·具体应用:碘量法、高锰酸钾法 学会分析误差来源、如何提高分析准确度(结合实验) 牢记反应方程式 计算题分析一 找准反应物,准确书写反应方程式
氧化还原滴定 • 条件电位/平衡常数 及其影响因素:学会分析 • 滴定曲线相关计算 • 指示剂(学会分析实验现象) • 具体应用:碘量法、高锰酸钾法 学会分析 误差来源、如何提高分析准确度(结合实验) 牢记反应方程式 计算题 分析 —— 找准反应物,准确书写反应方程式 1 2 ' 2 2 ' 1 1 n n n n sp + + = 1 ' 1 2 ' 2 3 0.059 ~ 3 0.059 n n − + Cr(III) Fe(III)/Fe(II) ' Cr(VI)/Cr(III) ' 2 1 lg 7 0.059 6 1 6 C s p + + + = d Ox Ox d n Re ' Re lg 0.059 = + n In O In R ' 0.059 ( ) ( )

氧化还原滴定 >条件电位及影响因素: 电极电位越大,氧化性越强,还原性越弱;反之 离子强度、生成沉淀、生成配合物、酸效应 >条件平衡常数计其影响因素 0.05》 g Aw>.035 雅, 反应速度及影响因素 反应物浓度、温度、催化剂、诱导效应
➢条件电位及影响因素: 电极电位越大,氧化性越强,还原性越弱;反之- 离子强度、生成沉淀、生成配合物、酸效应 ➢条件平衡常数计其影响因素 ➢反应速度及影响因素 反应物浓度、温度、催化剂、诱导效应 氧化还原滴定

应用 碘量法 分类(直接间接碘量法)、原理、指示剂 2. 误差来源及减少措施; 3. 标准溶液的配制与标定; 高锰酸钾法 (原理、标准溶液的配制与标定、三度一点、应用) 亚硝酸钠法/K2Cr207
应用 ➢ 碘量法 1. 分类(直接\间接碘量法) 、原理、指示剂 2. 误差来源及减少措施; 3. 标准溶液的配制与标定; ➢ 高锰酸钾法 (原理、标准溶液的配制与标定、三度一点、应用) ➢ 亚硝酸钠法/K2Cr2O7

设 沉淀滴定与重量分析 ·选择题学会分析 1.沉淀的形成过程:晶形沉淀 2.影响沉淀溶解度/纯度的因素 3.重量分析换算因数的计算 4.银量法一一与实验相结合 指示剂、滴定对象、误差减免
沉淀滴定与重量分析 • 选择题 学会分析 1. 沉淀的形成过程: 晶形沉淀 2. 影响沉淀溶解度/纯度的因素 3. 重量分析换算因数的计算 4. 银量法——与实验相结合 指示剂、滴定对象、误差减免