
⑨1 掌握碘量法的原理及误差来源、减 隶 免办法; 学 ©1 掌握高锰酸钾法的原理及实验步骤; ©熟悉其他氧化还原滴定法及其应用。 ©掌握知识的应用一练习题 标 ©课程思政:环境保护,绿水青山就 是金山银山。 的
教 学 目 标 ☺ 掌握碘量法的原理及误差来源、减 免办法; ☺ 掌握高锰酸钾法的原理及实验步骤; ☺ 熟悉其他氧化还原滴定法及其应用。 ☺ 掌握知识的应用——练习题 ☺ 课程思政:环境保护,绿水青山就 是金山银山
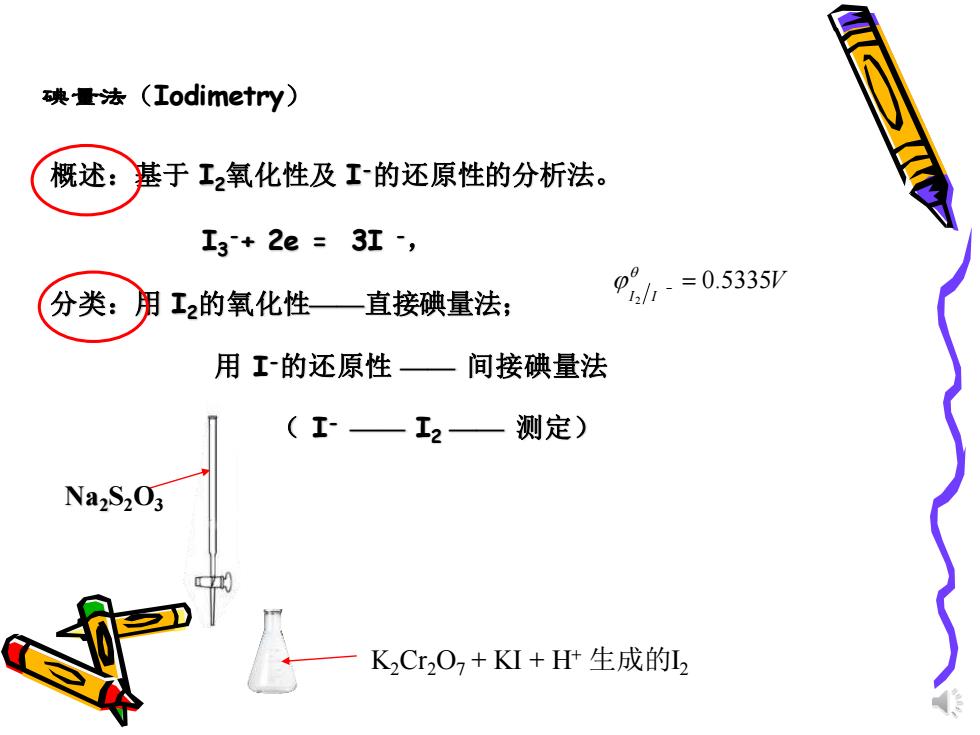
碘量法 (Iodimetry) 概述: 基于工2氧化性及工的还原性的分析法。 I3+2e=3I, 分类: 用工2的氧化性—直接碘量法; 08h-=0.5335 用工的还原性一间接碘量法 (I—I2— 测定) Na2S203 KCr2O2+KI+H+生成的L
碘量法(Iodimetry) 概述:基于 I2氧化性及 I -的还原性的分析法。 I3 -+ 2e = 3I -, 分类:用 I2的氧化性——直接碘量法; 用 I -的还原性 —— 间接碘量法 ( I - —— I2 —— 测定) V I I 0.5335 2 − = Na2S2O3 K2Cr2O7 + KI + H+ 生成的I2

直接碘量法 利用工2的弱氧化性 >对象: 电势比I2/工低的还原性物质,如S2- Sn(Ⅱ),52032-,s032-p°指示剂:淀粉指示剂。 >酸度要求:弱酸性,中性,或弱碱性(H小于)
直接碘量法——利用I2的弱氧化性 ➢ 对象: 电势比 I2/I- 低的还原性物质,如S2-, Sn(Ⅱ),S2O3 2-,SO3 2- ➢ 指示剂:淀粉指示剂。 ➢ 酸度要求:弱酸性,中性,或弱碱性(pH小于9) ' ' 3 − − I I

强酸性介质: 工发生氧化 。 终点拖后; 淀粉水解成糊精 终点不敏锐 4+02+4H+=2L2+2H20(氧化反应) 强碱性介质:工2发生歧化反应 3L2+60H=5+IO3+3H0(歧化反应)
强酸性介质: • I -发生氧化 终点拖后; • 淀粉水解成糊精 终点不敏锐 • 强碱性介质:I2发生歧化反应 4I -+O2 + 4H+ 2I 2 + 2H2O(氧化反应) 3I 2 + 6OH- 5I - + IO3 - + 3H2O(歧化反应)

间接碘量法:利用I的中等强度还原性 >对象:电势比工2/工高的氧化性物质,如 MnO4,Cr2O7,AsO43-,BrO3,IO3, H2O2,CIO- >指示剂:淀粉指示剂。 >酸度要求:中性或弱酸性
间接碘量法:利用I -的中等强度还原性 ➢ 对象:电势比 I2/I- 高的氧化性物质,如 MnO4 -,Cr2O7 -,AsO4 3-,BrO3 -, IO3 -, H2O2,ClO- ➢指示剂:淀粉指示剂。 ➢ 酸度要求:中性或弱酸性
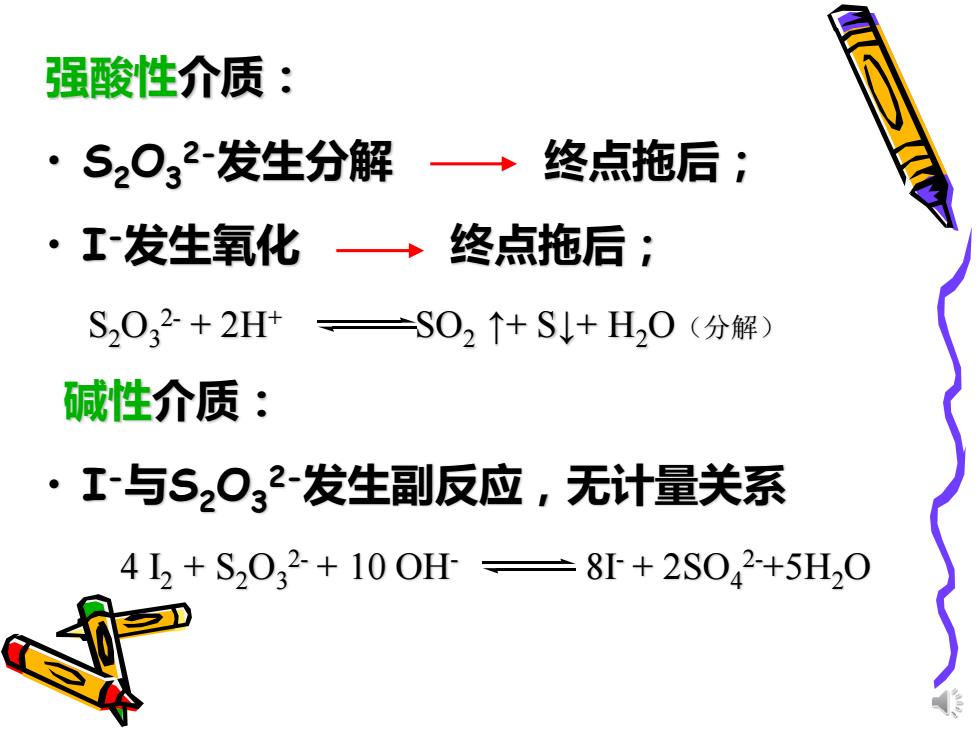
强酸性介质: S2032-发生分解 →终点拖后; ·工发生氧化→终点拖后; S2032+2H+=S02↑+S+H20(分解) 碱性介质: ·1-与S2032-发生副反应,无计量关系 452+S2032+100H=8+2S042+5H,0
强酸性介质: • S2O3 2-发生分解 终点拖后; • I -发生氧化 终点拖后; 碱性介质: • I -与S2O3 2-发生副反应,无计量关系 S2O3 2- + 2H+ SO2 ↑+ S↓+ H2O(分解) 4 I 2 + S2O3 2- + 10 OH- 8I - + 2SO4 2-+5H2O

碘量法误差的主要来源 1.碘单质的挥发 >预防:1)过量加入K红—助溶,防止挥发 增大浓度,提高速度 2)溶液温度勿高 3)碘量瓶中进行反应(磨口塞,水封) 4)滴定中勿过分振摇
碘量法误差的主要来源 1.碘单质的挥发 ➢ 预防: 1)过量加入KI——助溶,防止挥发 增大浓度,提高速度 2)溶液温度勿高 3)碘量瓶中进行反应(磨口塞,水封) 4)滴定中勿过分振摇

2.碘离子的氧化(酸性条件下) 预防:1)控制溶液酸度(勿高) 2)密塞避光(碘瓶暗处放置) 3)工2完全析出后立即滴定 4)除去催化性杂质(NO3,NO,Cu2+) 3.碘单质的吸附(间接碘量法)
2.碘离子的氧化(酸性条件下) 预防:1)控制溶液酸度(勿高) 2)密塞避光(碘瓶暗处放置) 3)I2完全析出后立即滴定 4)除去催化性杂质(NO3 -,NO,Cu2+) 3. 碘单质的吸附(间接碘量法)

标准溶液的配制与标定 1.Na2S2O3溶液—配制 ①含结晶水的Na2S2035H20容易风化潮解,且含少量杂 质,不能直接配制标准溶液。 ②Na2S203化学稳定性差,能被溶解02、 CO,和微生物所 分解析出硫。因此配制N2S2O3标准溶液时应采用新煮沸(除 氧、杀菌)并冷却的蒸馏水。 加入少量N2CO3使溶液呈弱碱性(抑制细菌生长),溶 存在棕色瓶中,置于暗处放置8~12天后标定
标准溶液的配制与标定 1.Na2S2O3溶液——配制 ① 含结晶水的Na2S2O3·5H2O容易风化潮解,且含少量杂 质,不能直接配制标准溶液。 ② Na2S2O3化学稳定性差,能被溶解O2、CO2和微生物所 分解析出硫。因此配制Na2S2O3标准溶液时应采用新煮沸(除 氧、杀菌)并冷却的蒸馏水。 ③ 加入少量Na2CO3使溶液呈弱碱性(抑制细菌生长),溶 液保存在棕色瓶中,置于暗处放置8~12天后标定

标定NaS,0所用基准物有K,Cr,0,KIO,等。采NN接 ④ 碘法标定。在酸性溶液中使K,Cr2O,与KI反应,以淀粉为指示 用Na2S203溶液滴定。 ⑤淀粉指示剂应在近终点时加入,否则吸留1,使终点拖后。 ⑥滴定终点后,如经过五分钟以上溶液变兰,属于正常,如 溶液迅速变兰,说明反应不完全,遇到这种情况应重新标定。 C3O2+6I-+14H+=2Cr3++3L2↓+7H,0 12+2S2O3=2I+S40,2
④ 标定Na2S2O3 所用基准物有K2Cr2O7,KIO3等。采用间接 碘法标定。在酸性溶液中使K2Cr2O7与KI反应, 以淀粉为指示剂, 用Na2S2O3溶液滴定。 ⑤ 淀粉指示剂应在近终点时加入,否则吸留I2使终点拖后。 ⑥ 滴定终点后,如经过五分钟以上溶液变兰,属于正常,如 溶液迅速变兰, 说明反应不完全, 遇到这种情况应重新标定。 Cr O I H Cr I 2 H2 O 2 3 2 7 + 6 +14 = 2 + 3 +7 − − + + − − − + = + 2 2 2 2 3 2 S4 O6 I S O I