
第十一章配合物结构 1、晶体场中的能级分裂变化规律是什么? 答:①同一元素与相同配体形成的配合物中,中心离子电荷多的毕电荷少的△值大。 ②相同配体带相同电荷的同族金属离子,随着中心离子(形成体)的周期数的增加而 增大 ③在配合物构型相同的前提下,各种配体对同一离子产生的分裂能由小到大的顺序为 I八面体>四面体。 2、已知K(CoY)=1.0×106,K(Co(enh=4.9×10。通过计算说明配离子CoY和 Co(em+哪一个更稳定? 答:设两种配离子浓度均为0.10moL1,在溶液中仅离解出金属离子和配体两种产物: 则「CoYICo3++Y4 [Co]=[Y]=x mol-L-1 [CoY-]=0.10-x0.10 mol-L- 010=10×10 解得x=[Co]=3.2×1019(molL) 同理[Co(cn]+一Co+3cn [Co]=y mol -L-I [en]=3y mol L-I [Co(en)]=0.10-y =0.10 mol-L yx7=4.9X10解得y=17X101L 010 计算表明相同浓度下CoY]离解出的Co+离子浓度比Co(en)]+离解的少, 所以CoYT比[Co(en]3+更稳定。 此采取六配位的型形式形成FeF6。 4、实验测得F©(CN)%和[CoNH+均为反磁性物质(磁矩等于零),求它们的杂化轨道类 答:由于F@(CN)、[CoNH)的H=0,因此这两配离子中无未成对d电子,6个d电 子两两耦合占据三个d轨道,Fc(CN)6、[CoNH)%+形成时均以dsp杂化轨道成键。 5、用品休场理论定性说明一价铁和三价铁的水合离子的领色不同的原因 答:同种原子,电荷越高,对分裂能的影响越大 F©HO的△值大。分裂能不同是它们 因d-d跃迁引起颜色不同的主要原因。一般而言,分裂能越大,吸收光子的能量越大,即频 率越同.而它的补色频率越低。因此[F©(O)+为紫色,而Fc(HO)P为绿色
第十一章 配合物结构 1、晶体场中的能级分裂变化规律是什么? 答:① 同一元素与相同配体形成的配合物中,中心离子电荷多的毕电荷少的∆0 值大。 ② 相同配体带相同电荷的同族金属离子,随着中心离子(形成体)的周期数的增加而 增大。 ③ 在配合物构型相同的前提下,各种配体对同一离子产生的分裂能由小到大的顺序为: I -<Br-<S 2-<SCN-<Cl-<NO3 -<F -<OH-<C2O4 2-<H2O<NCS-<NH3<en<bipy< NO2 -<CN-<CO ④ 中心离子、配体均相同时,分裂能与配合物的几何构型有关。分裂能大小顺序为: 平面正方形>八面体>四面体。 2、已知 Kf (CoY- )=1.0×1036 , Kf (Co(en)3 3+)=4.9×1048 。通过计算说明配离子 CoY-和 Co(en)3 3+ 哪一个更稳定? 答:设两种配离子浓度均为 0.10 mol·L -1 ,在溶液中仅离解出金属离子和配体两种产物 : 则 [CoY]- Co3+ + Y4- [Co3+ ]=[Y4- ]= x mol·L -1 [CoY- ]=0.10- x ≈0.10 mol·L -1 2 0.10 x =1.0×1036 解得 x =[Co3+]=3.2×10-19 (mol·L -1 ) 同理 [Co(en)3] 3+ Co3+ + 3 en [Co3+]= y mol·L -1 [en]=3 y mol·L -1 [Co(en)3 3+]=0.10- y ≈0.10 mol·L -1 3 (3 ) 0.10 y y =4.9×1048 解得 y =1.7×10-13 (mol·L -1 ) 计算表明相同浓度下[CoY]-离解出的 Co3+离子浓度比[Co(en)3] 3+离解的少 , 所以[CoY]-比[Co(en)3] 3+更稳定 。 3、[FeF6] 3-为六配位,而[FeCl4] -为四配位,应如何理解? 答:由于 Cl-半径大,导致 Cl-间的斥力大,所以形成的四配位的[FeCl4] -,而 F -半径较小,因 此采取六配位的型形式形成[FeF6] 3-。 4、实验测得[Fe(CN)6] 4-和[Co(NH3)6] 3+均为反磁性物质(磁矩等于零),求它们的杂化轨道类 型。 答:由于 [Fe(CN)6] 4-、[Co(NH3)6] 3+的 μ=0,因此这两配离子中无未成对 d 电子,6 个 d 电 子两两耦合占据三个 d 轨道,[Fe(CN)6] 4-、[Co(NH3)6] 3+形成时均以 d 2 sp3 杂化轨道成键。 5、用晶体场理论定性说明二价铁和三价铁的水合离子的颜色不同的原因。 答:同种原子,电荷越高,对分裂能的影响越大。[Fe(H2O)6] 3+的∆值大。分裂能不同是它们 因 d-d 跃迁引起颜色不同的主要原因。一般而言,分裂能越大,吸收光子的能量越大,即频 率越同.而它的补色频率越低。因此[Fe(H2O)6] 3+为紫色,而[Fe(H2O)6] 2+为绿色
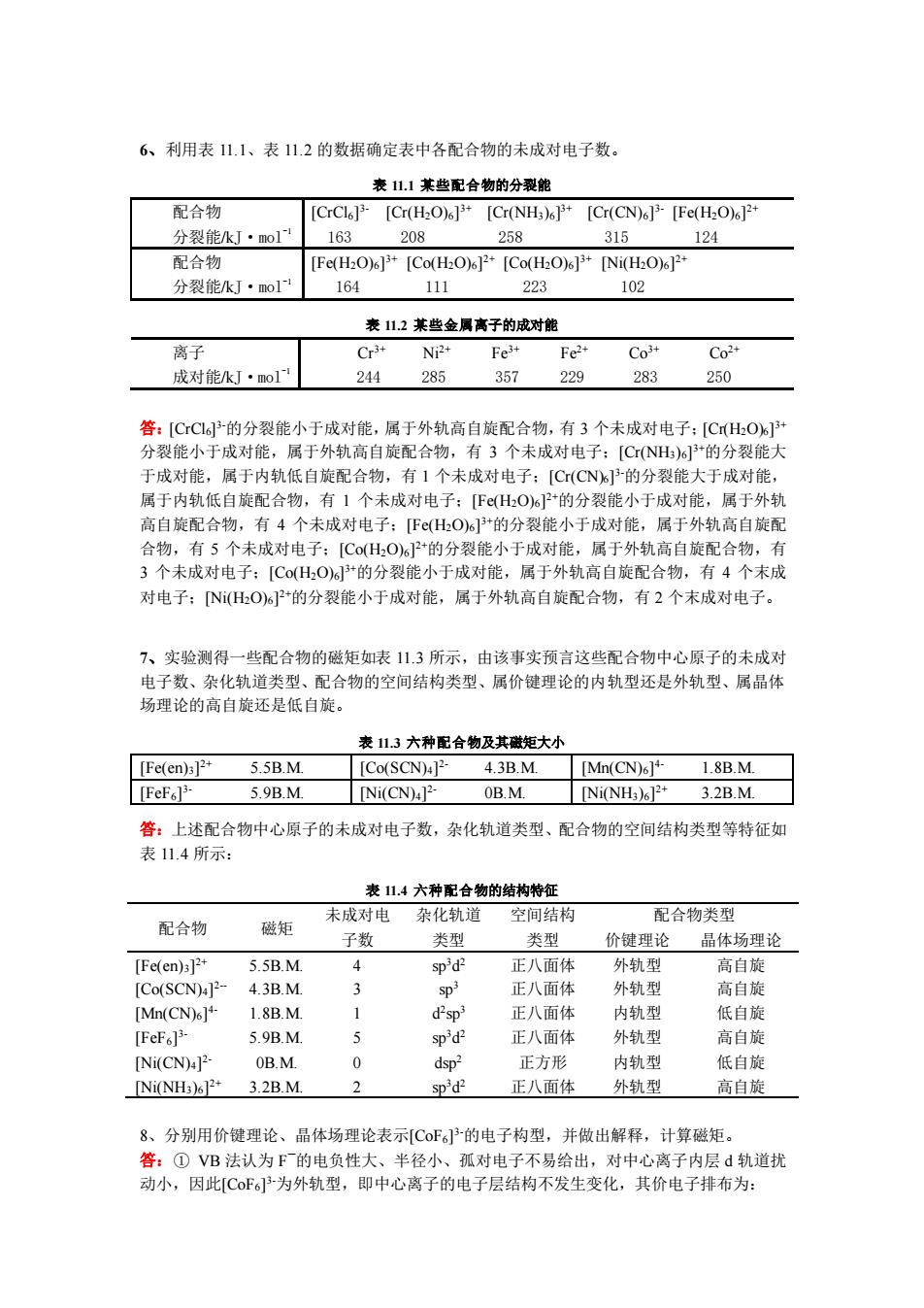
6、利用表11.1、表112的数据确定表中各配合物的未成对电子数 表1.1莱些配合物的分裂能 配合物 [CrCleP [Cr(H2O)][Cr(NH3)6P [Cr(CN)6P [Fe(H2O)oP+ 分裂能kJ·o1 163 08 258 315 194 配合物 [Fe(H2O)][Co(H2O)[Co(H2O)][Ni(H2O) 分裂能kJ·mo1 164 111 223 102 表112某些金属离子的成对能 离子 Np. Fe Fe Co Co- 成对能k灯·mo1 244 285 357 229 283 250 答:[CC的分裂能小于成对能,属于外轨高自旋配合物, 有3个未成对电子:[CHO 分裂能小于成对能,属于外轨高自旋配合物,有3个未成对电子:[CNH)%的分裂能大 于成对能,属于内轨低自旋配合物,有1个未成对电子:[C(CN的分裂能大于成对能, 属于内轨低自旋配合物,有1个未成对电子:[FεHO6P的分裂能小于成对能,属于外轨 高自旋配合物,有4个未成对电子:FHO)s1+的分裂能小于成对能,属于外轨高自旋配 合物,有5个未成对电子:【Co(H,0%P的分裂能小于成对能,属于外轨高自旋配合物, 未成对电子:[C0(,0的分裂能小于成对能,属于外轨高自旋配合物, 有4 末成 对电子:NHO)2+的分裂能小于成对能,属于外轨高自旋配合物,有2个末成对电子。 7、实验测得一些配合物的磁矩如表113所示,由该事实预言这些配合物中心,原子的未成对 电子数、杂化轨道类型、配合物的空间结构类型、属价键理论的内轨型还是外轨型、属晶体 场理论的高自旋还是低自旋。 表113六种配合物及其磁矩大小 [Fe(en)1 55R M ICo(SCNE 43B M [Mn(CN)61+ 1.8B.M. 5.9B.M [Ni(CN)4]- 0B.M. [Ni(NH)6]+3.2B.M. 答:上述配合物中心原子的未成对电子数,杂化轨道类型、配合物的空间结构类型等特征如 表114所示: 表11.4六种配合物的结构特征 未成 配合物 磁矩 电杂化轨道 空间结构 配合物类型 子数 类型 类型 价键理论 晶体场理论 [Fe(en)3]2 5 5B M 4 sp'd- 正八面体 外轨型 高自旋 [Co(SCN)4P- 43BM 正八面体 外轨型 高自旋 IMD(CNMI 正八面体 内轨型 低自 [FeF.P 5.9B.M 正八面名 外 高自 [Ni(CN)4 0B.M 0 dsp- 正方形 内轨型 低自旋 [Ni(NH3)2*3.2B.M. 2 sp'd- 正八面体 外轨型 高自旋 8、分别用价键理论、品体场理论表示C0F6的电子构型,并做出解释,计算磁矩。 答:①VB法认为F的 半径小、 孤对电子不易结 出, 对甲 心离子内层d轨道扰 动小,因此[CF为外轨型,即中心离子的电子层结构不发生变化,其价电子排布为:
6、利用表 11.1、表 11.2 的数据确定表中各配合物的未成对电子数。 表 11.1 某些配合物的分裂能 配合物 分裂能/kJ·mol-1 [CrCl6] 3- [Cr(H2O)6] 3+ [Cr(NH3)6] 3+ [Cr(CN)6] 3- [Fe(H2O)6] 2+ 163 208 258 315 124 配合物 分裂能/kJ·mol-1 [Fe(H2O)6] 3+ [Co(H2O)6] 2+ [Co(H2O)6] 3+ [Ni(H2O)6] 2+ 164 111 223 102 表 11.2 某些金属离子的成对能 离子 成对能/kJ·mol-1 Cr3+ Ni2+ Fe3+ Fe2+ Co3+ Co2+ 244 285 357 229 283 250 答:[CrCl6] 3-的分裂能小于成对能,属于外轨高自旋配合物,有 3 个未成对电子;[Cr(H2O)6] 3+ 分裂能小于成对能,属于外轨高自旋配合物,有 3 个未成对电子;[Cr(NH3)6] 3+的分裂能大 于成对能,属于内轨低自旋配合物,有 1 个未成对电子;[Cr(CN)6] 3-的分裂能大于成对能, 属于内轨低自旋配合物,有 1 个未成对电子;[Fe(H2O)6] 2+的分裂能小于成对能,属于外轨 高自旋配合物,有 4 个未成对电子;[Fe(H2O)6] 3+的分裂能小于成对能,属于外轨高自旋配 合物,有 5 个未成对电子;[Co(H2O)6] 2+的分裂能小于成对能,属于外轨高自旋配合物,有 3 个未成对电子;[Co(H2O)6] 3+的分裂能小于成对能,属于外轨高自旋配合物,有 4 个末成 对电子;[Ni(H2O)6] 2+的分裂能小于成对能,属于外轨高自旋配合物,有 2 个末成对电子。 7、实验测得一些配合物的磁矩如表 11.3 所示,由该事实预言这些配合物中心原子的未成对 电子数、杂化轨道类型、配合物的空间结构类型、属价键理论的内轨型还是外轨型、属晶体 场理论的高自旋还是低自旋。 表 11.3 六种配合物及其磁矩大小 [Fe(en)3] 2+ 5.5B.M. [Co(SCN)4] 2- 4.3B.M. [Mn(CN)6] 4- 1.8B.M. [FeF6] 3- 5.9B.M. [Ni(CN)4] 2- 0B.M. [Ni(NH3)6] 2+ 3.2B.M. 答:上述配合物中心原子的未成对电子数,杂化轨道类型、配合物的空间结构类型等特征如 表 11.4 所示: 表 11.4 六种配合物的结构特征 配合物 磁矩 未成对电 子数 杂化轨道 类型 空间结构 类型 配合物类型 价键理论 晶体场理论 [Fe(en)3] 2+ 5.5B.M. 4 sp3d 2 正八面体 外轨型 高自旋 [Co(SCN)4] 2- 4.3B.M. 3 sp3 正八面体 外轨型 高自旋 [Mn(CN)6] 4- 1.8B.M. 1 d 2 sp3 正八面体 内轨型 低自旋 [FeF6] 3- 5.9B.M. 5 sp3d 2 正八面体 外轨型 高自旋 [Ni(CN)4] 2- 0B.M. 0 dsp2 正方形 内轨型 低自旋 [Ni(NH3)6] 2+ 3.2B.M. 2 sp3d 2 正八面体 外轨型 高自旋 8、分别用价键理论、晶体场理论表示[CoF6] 3-的电子构型,并做出解释,计算磁矩。 答:① VB 法认为 F —的电负性大、半径小、孤对电子不易给出,对中心离子内层 d 轨道扰 动小,因此[CoF6] 3-为外轨型,即中心离子的电子层结构不发生变化,其价电子排布为:

3d 4p 4d sp3d杂化,n=4,4=√4(4+2)=4.90B.M,故为顺磁性。 9、某物质的实验式为PtC14·2NH,其水溶液不导电,加入AgNO3也不产生沉淀,以强碱 答:处理时没有NH放出,写出它的配位化学式。 根据实验现象可知,C1和NH都在配合物的内界,所以它的化学式为[PtCl4(NH)2]。 10、有两种组成相同的CoSO4B(NH)5的配合物。其一的水溶液为无色,加AgNO3后生成 黄色沉淀:若加BaCh溶液无变化。另一水溶液为紫色,加入BaCl2溶液生成沉淀,若加入 AgNO3溶液无变化。试确定它们的结构式,并一一命名。 答:其一:[CoNH)s(OSO)]Br溴化一硫酸根·五氨合钴(四) 其二:[CoNH)sBr]SO4硫酸一溴·五氨合钴()
sp3d 2 杂化,n=4, = 4(4+ 2) = 4.90B.M. ,故为顺磁性。 9、某物质的实验式为 PtCl4·2NH3,其水溶液不导电,加入 AgNO3 也不产生沉淀,以强碱 答:处理时没有 NH3 放出,写出它的配位化学式。 根据实验现象可知,C1—和 NH3 都在配合物的内界,所以它的化学式为[PtCl4(NH3)2]。 10、有两种组成相同的 CoSO4Br(NH3)5 的配合物。其一的水溶液为无色,加 AgNO3 后生成 黄色沉淀;若加 BaCl2 溶液无变化。另一水溶液为紫色,加入 BaCl2 溶液生成沉淀,若加入 AgNO3 溶液无变化。试确定它们的结构式,并一一命名。 答:其一: [Co(NH3)5(OSO3)]Br 溴化一硫酸根·五氨合钴(Ⅲ) 其二: [Co(NH3)5Br]SO4 硫酸一溴·五氨合钴(Ⅲ)