
第 三 滴定分析法 概论 章 刘利红 南方医科大学
1 滴定分析法 概论 第 三 章

基本内容和重点要求 掌握滴定分析法的特点、分类、对化学反应的要求 掌握基准物质的概念和要求,常用的基准物质及其应 用 掌握标准溶液的配制方法、浓度的表示方法、滴定度 的概念和计算; 熟练掌握滴定分析中的各种计算
2 掌握滴定分析法的特点、分类、对化学反应的要求 掌握基准物质的概念和要求,常用的基准物质及其应 用 掌握标准溶液的配制方法、浓度的表示方法、滴定度 的概念和计算; 熟练掌握滴定分析中的各种计算

第一节滴定分析法和滴定方式 一、滴定分析法 3
3
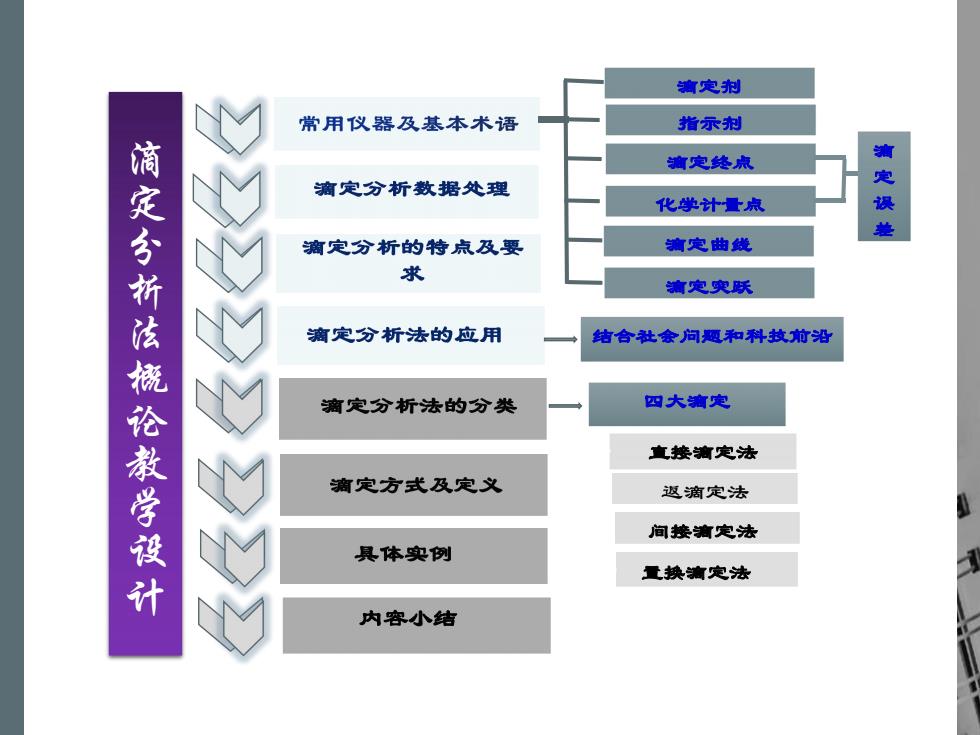
滴定剂 常用仪器及基本术语 指示剂 言定终点 痛定分析数据处理 化学计量点 误 浦定分折法棚论教学设计 滴定分析的特点及要 有定曲线 求 滴定突跃 滴定分析法的应用 结合融会问题和科故前沿 滴定分析法的分类 四大滴定 直接滴定法 滴定方式及定义 返滴定法 间接清定法 具体实例 重换滴定法 内容小结
间接滴定法 置换滴定法 直接滴定法 内容小结 滴定分析法概论教学设计 结合社会问题和科技前沿 化学计量点 滴定终点 指示剂 滴定剂 滴定曲线 滴定突跃 滴定误差 四大滴定

滴定分析法(titrimetry) 将一种已知其准确浓度的试剂溶液( 标准溶液)通过滴定管滴加到被测物质的溶 液中,直到所加试剂与被测物质按化学计量 关系完全作用为止,然后根据所用试剂溶液 的浓度和体积求出被测组分的含量
滴定分析法( titrimetry) 5 将一种已知其准确浓度的试剂溶液( 标准溶液)通过滴定管滴加到被测物质的溶 液中,直到所加试剂与被测物质按化学计量 关系完全作用为止,然后根据所用试剂溶液 的浓度和体积求出被测组分的含量

化学小魔术
化学小魔术 6

科学家简介 罗伯特·波义耳英国物理学家、化学家,近代化学的 黄基人,是酸碱指示利的发现者。 波义耳做实验时,不小心让盐酸飞贱到了鲜花上,发 现紫罗兰额色变红了,他又取来了紫罗兰,发规盐酸 地有同样的作用。由此他推断,不仅盐酸,而县其它 各种酸都能使紫罗兰变为红色。目前,由石慈试液制 成的试纸还在使用中。 受到的启发:在学司生活中培养善于观察、勤于思考、 勇于探索。 遇碱变蓝 遇酸变红
在学习生活中培养善于观察、勤于思考、 勇于探索。 遇碱变蓝 遇酸变红

常用仪器 烧杯 容量瓶 玻璃棒 移液管 锥形瓶 量筒 吸量管 碘量瓶 酸碱两用滴定管
烧杯 容量瓶 玻璃棒 移液管 锥形瓶 量筒 吸量管 碘量瓶 酸碱两用滴定管 8
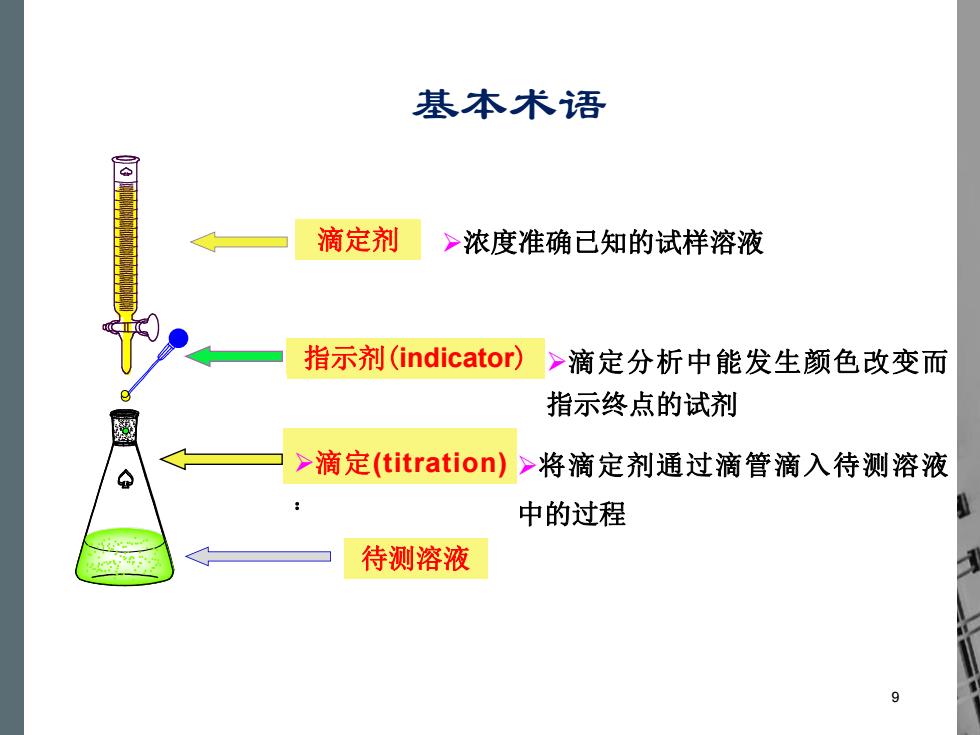
基本术语 滴定剂 >浓度准确已知的试样溶液 指示剂(indicator) >滴定分析中能发生颜色改变而 指示终点的试剂 >滴定(titration)>将滴定剂通过滴管滴入待测溶液 中的过程 待测溶液
滴定剂 Ø浓度准确已知的试样溶液 待测溶液 Ø滴定分析中能发生颜色改变而 指示终点的试剂 指指示示剂剂((iinnddiiccaattoor)r) Ø滴定(titration) : Ø将滴定剂通过滴管滴入待测溶液 中的过程 9 基本术语
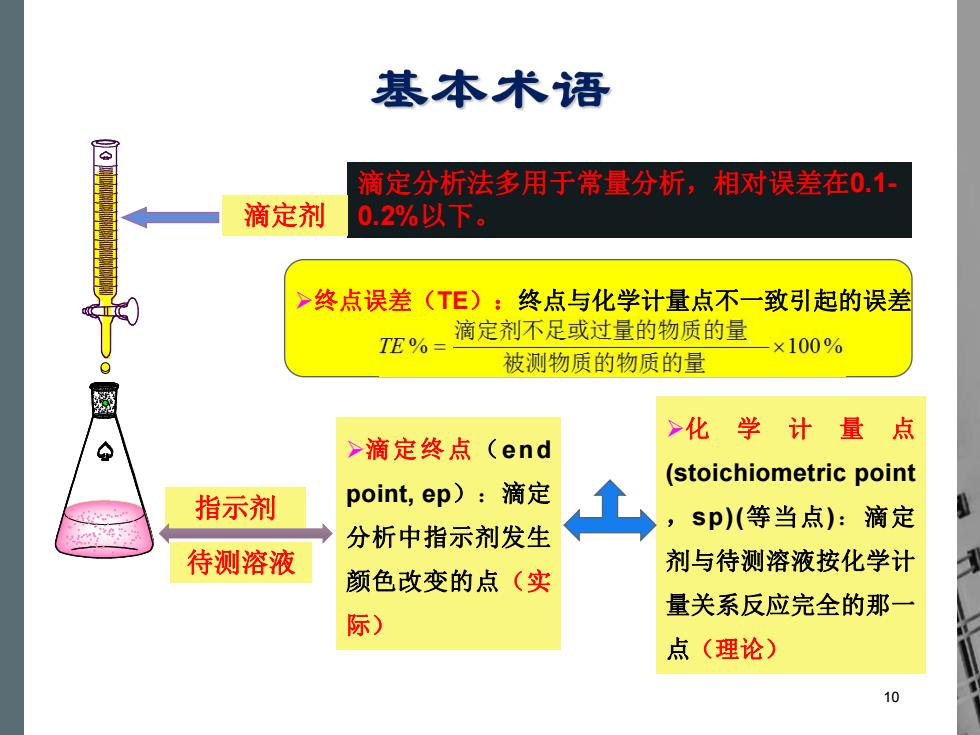
基本术语 滴定分析法多用于常量分析,相对误差在0.1· 滴定剂 0.2%以下。 >终点误差(TE):终点与化学计量点不一致引起的误差 滴定剂不足或过量的物质的量 TE%= ×100% 被测物质的物质的量 >化 学计 量点 >滴定终点(end (stoichiometric point 指示剂 point,ep):滴定 ,sp)(等当点):滴定 分析中指示剂发生 待测溶液 剂与待测溶液按化学计 颜色改变的点(实 量关系反应完全的那一 际) 点(理论) 10
Ø滴定终点(end point, ep):滴定 分析中指示剂发生 颜色改变的点(实 际) Ø化 学 计 量 点 (stoichiometric point ,sp)(等当点):滴定 剂与待测溶液按化学计 量关系反应完全的那一 点(理论) 滴定分析法多用于常量分析,相对误差在0.1- 0.2%以下。 Ø终点误差(TE):终点与化学计量点不一致引起的误差 指示剂 待测溶液 滴定剂 10