
滴定分析法慨论 (2) 刘利红 南方医科大学
滴定分析法概论 (2) 刘利红 南方医科大学
酸度 平衡浓度 基本概念 分析浓度 分布系数公式推导 分布系数 衡的处理方法教学设计 乡布系数及客流中化学平 分布曲线 一元酸 多元酸 奥例及小结 酸碱质子理论 电荷平衡 水溶液中的酸碱平衡 物料平衡 质子条件 零水准法 内容小结
物料平衡 零水准法 电荷平衡 分布系数 分析浓度 平衡浓度 酸度 基本概念 分布系数公式推导 分布曲线 酸碱质子理论 水溶液中的酸碱平衡 质子条件 内容小结 实例及小结 多元酸 一元酸

第四节滴定分析中的化学平衡 1、活度、活度系数和平衡常数 2、水溶液中溶质各型体的分布和分布系数 3、化学平衡的系统处理方法
第四节滴定分析中的化学平衡 1、活度、活度系数和平衡常数 2、水溶液中溶质各型体的分布和分布系数 3、化学平衡的系统处理方法 3

第四节滴定分析中的化学平衡 1、活度、活度系数和平衡常数 ·分析化学关心的问题 ·测定的结果用浓度还是活度表示 ·判断由于离子强度的变化是否会对测量结果产生 不可忽略的影响 ·如何校正不可忽略的影响
1、活度、活度系数和平衡常数 • 分析化学关心的问题 • 测定的结果用浓度还是活度表示 • 判断由于离子强度的变化是否会对测量结果产生 不可忽略的影响 • 如何校正不可忽略的影响 第四节滴定分析中的化学平衡

·1.活度(@):在电解质溶液中,离子的“有效浓度” ·2活度系数(Y):是衡量实际溶液与理想液之间差别 的尺度0 溶液无限稀时:Y=1 ·浓度c与 中性分子:Y=1 容剂活度:a=1 V<1,则a<c: c<104molL,则y→1,aec ·在稀溶液中质量摩尔浓度与物质的量浓度差别不大,所 以计算中用物质的量浓度c表示(mo/L) 即:
• 1.活度(α):在电解质溶液中,离子的“有效浓度” • 2.活度系数(γ):是衡量实际溶液与理想溶液之间差别 的尺度. • 浓度c与活度a的关系 • α=γm • 在稀溶液中质量摩尔浓度与物质的量浓度差别不大,所 以计算中用物质的量浓度c 表示(mol/L) • 即: a ci = m为质量摩尔 浓度(mol/kg) 溶液无限稀时:γ =1 中性分子: γ = 1 容剂活度:α = 1 γ<1,则α<c; c<10-4mol/L,则γ→1,α≈c

活度系数y:对稀溶液m<0.1mol/kg或c<0.10mol/L时 ,用德拜-休克尔(Debye-Hockel)公式求得: 式中:Z1-电荷 -lgY,=0.512Z2 B-常数,25C时为0.00328 A-离子体积华数,三水化离子 半径,以pm(10-12)计,离子 的a值见P41附录表2-1 离子强度较小时,可不考虑水化离子大小 /仁溶液中离子强度 德拜-休克尔极限公式 'i-离子的活度集数,a、人 Zi记知时,ri值见P42附录表2 -lgY,=0.5Z√7 2 1= C:i离子浓度 Z:i离子电荷
+ − = B I I i Zi 1 å lg 0.512 2 活度系数 6 γ:对稀溶液 m<0.1mol/kg 或 c<0.10mol/L时 ,用德拜-休克尔(Debye-Hockel)公式求得: 式中:Zi-电荷 B-常数,25C时为0.00328 Å-离子体积系数,水化离子 半径,以pm(10-12)计,离子 的å值见P41附录表2-1 I-溶液中离子强度 ri-离子i的活度系数, å、 I、 Zi已知时, ri值见P42附录表2- 2 离子强度较小时,可不考虑水化离子大小, 德拜-休克尔极限公式: Z I i i 2 − lg = 0.5 = i i Zi I c 2 2 1 ci:i离子浓度 Zi:i离子电荷

例1计算0.10MOLL1HCL溶液中H+的活度。 解 OH+=YH+[H+]=YH+x0.1 mol/L 1=2∑c2=2Z+CZ) =x010 ml-.x+号x010mL× 2 =0.10mol.L a=0.83×0.10mol/L=0.083mol/L
例1 计算0.10 MOL·L -1 HCL溶液中H+的活度。 解 1 1 2 1 2 2 Cl 2 H 2 i i 0.10 mol L 0.10 mol L 1 2 1 0.10 mol L 1 2 1 ([H ] [Cl ] ) 2 1 2 1 − − − + − = = + I = c Z = Z + + Z − a = 0.83×0.10 mol/L = 0.083 mol/L αH+ =γH+[H+] =γH+ ×0.1 mol/L

例20.050mol/L的AICl3溶液中cc和aaI3+ 1=2∑e2=50050x32+3x0050x1)=030m01- 解 aa=300,aA=900,B=0.00328 -gy,=0.5122 1+Ba厅 -gyc=0.1882→yg-=0.66 -lgYA-=0.9644→Y4=0.11 高价离子影响大 .a=3×0.050×0.66=0.099molL a4=0.050×0.11=0.0055mol.L1
1 1 1 Cl A l 2 2 2 1 0.050 0.11 0.0055 3 0.050 0.66 0.099 lg 0.9644 0.11 lg 0.1882 0.66 lg 0.512 å 300 å 900 0.00328 (0.050 3 3 0.050 1 ) 0.30 2 1 2 1 3 3 3 - 3 − − + − = = = = − = = − = = − = = = = = = + = + − + + − − + a mol L a mol L Z B I c Z mol L A l Cl A l A l Cl Cl B a I I i i i i i , , 例2 0.050mol/L 的 AlCl3 溶液中 αCl- 和 αAl3+ 解 高价离子影响大
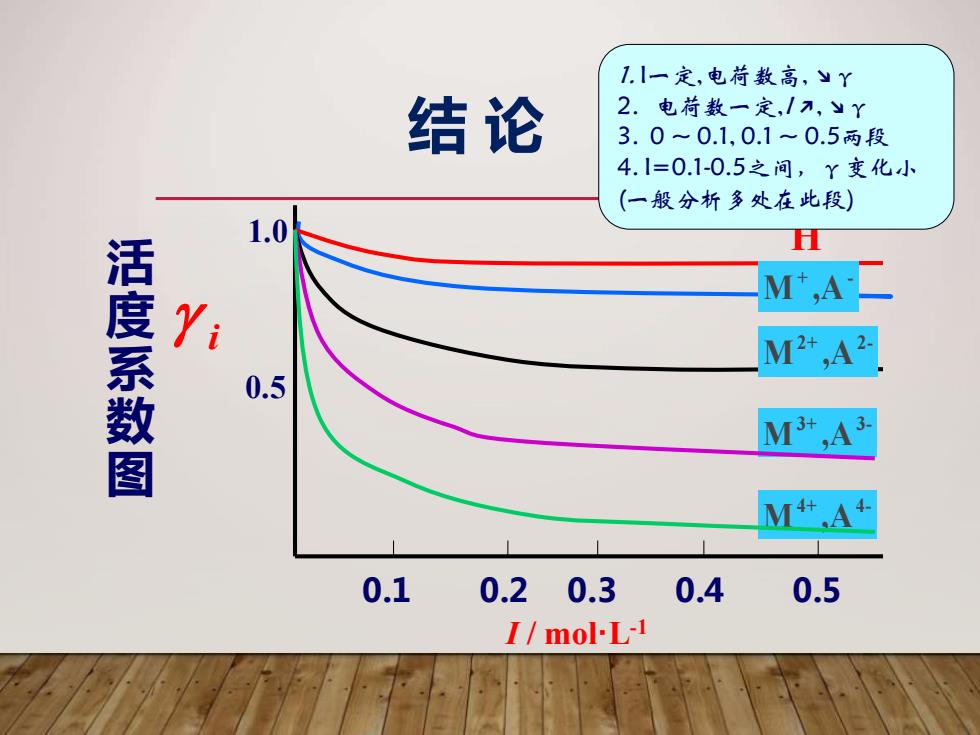
1.I一定,电荷数高,yY 结论 2.电荷数一定,/7,yY 3.0~0.1,0.1~0.5两段 4.1=0.1-0.5之问,Y变化小 (一般分析多处在此段) 1.0 H 活度系数图 M,A Yi M2+,A2 0.5 M3+,A3. M+ A+ 0.1 0.20.3 0.4 0.5 I/mol-L-1
活 度 系 数 图 0.1 0.2 0.3 0.4 0.5 1.0 0.5 i M ,A 3+ 3- M ,A 2+ 2- M ,A+ - + H M ,A 4+ 4- 1. I一定,电荷数高, ↘γ 2. 电荷数一定,I ↗, ↘γ 3. 0 ~ 0.1, 0.1 ~ 0.5两段 4. I=0.1-0.5之间,γ变化小 (一般分析多处在此段) I / mol·L-1 结 论

活度常数始、浓度常数及混合常数 1.活度常数K°: aA+bB cC+dD 形成常数 K 哈8 a 本章用K°处理平衡浓度之间的关系
活度常数Ka、浓度常数及混合常数 本章用K0 a处理平衡浓度之间的关系