
《无机化学》课程教学大纲 (Inorganic Chemistry) 适用专业:应用化学、化学工程与工艺 课程学时:64 课程学分:4 课程代码:GHX001 先修课程:高等数学 一、课程的性质与任务 《无机化学》是研究无机物质组成、结构、性质和变化规律的一门科学,为化学、化工及材 料、生物等化学相关专业的第一门化学基础课,于第一学年开设。通过本门课程学习,学生将掌握 理想气体状态方程式、化学热力学、化学动力学、化学平衡、酸碱平衡、沉淀溶解平衡、氧化还 原、元素周期律、原子结构、分子结构等基本原理知识,以及重要元素和化合物的主要结构、 性 、制备、用途,培养学生独立利用无机化学知识解决具体实践问题, 自学和利用参考资料等方面 的能力,也为《分析化学》、《有机化学》、《物理化学》、《结构化学》和后续专业课程的学习 奠定基础。近十余年,无机化学同其它学科相互渗透,产生了不少新的边缘学科,开设无机化学不 仅在于使学生掌握上述无机化学的基本理论和基础知识,同时使能使学生了解目前与无机化学相关 的新领域,开阔学生的眼界,为将来从事科学研究打下坚实的基础。 二、课程的内容与基本要求 无机化学的理论教学的内容包括化学反应的基本原理、物质结构的基础理论和元素化学的基本知 识。有针对性地学习无机化学的基本概念、化学反应中的能量变化、化学反应速度和化学平衡、电 解质的电离平衡、氧化还原和电化学、物质结构基础、重要元素及其化合物的性质等方面的基本规 律和内容。 下面按各章列出基本要求和内容。基本要求按深入的程度分”了解”、"理解、"掌握"和"熟练掌 握"四个层次。 第一章气体 一、本章基本要求 ·熟练掌握理想气体状态方程。 ·掌握分压、分体积概念及计算。 理解真实气体与理想气体的偏差。 ·了解气体分子动理论。 二、教学纳容 1理想气体及状态方程。 2.分压定律、分体积定律。 3.气体分子动理论(可自学) 4.真实气体 真实气体与理想气体的偏差、范德华方程
《无机化学》课程教学大纲 (Inorganic Chemistry) 适用专业:应用化学、化学工程与工艺 课程学时:64 课程学分:4 课程代码:GHX001 先修课程: 高等数学 一、课程的性质与任务 • 《无机化学》是研究无机物质组成、结构、性质和变化规律的一门科学,为化学、化工及材 料、生物等化学相关专业的第一门化学基础课,于第一学年开设。通过本门课程学习,学生将掌握 理想气体状态方程式、化学热力学、化学动力学、化学平衡、酸碱平衡、沉淀溶解平衡、氧化还 原、元素周期律、原子结构、分子结构等基本原理知识,以及重要元素和化合物的主要结构、性 质、制备、用途,培养学生独立利用无机化学知识解决具体实践问题、自学和利用参考资料等方面 的能力,也为《分析化学》、《有机化学》、《物理化学》、《结构化学》和后续专业课程的学习 奠定基础。近十余年,无机化学同其它学科相互渗透,产生了不少新的边缘学科,开设无机化学不 仅在于使学生掌握上述无机化学的基本理论和基础知识,同时使能使学生了解目前与无机化学相关 的新领域,开阔学生的眼界,为将来从事科学研究打下坚实的基础。 二、课程的内容与基本要求 无机化学的理论教学的内容包括化学反应的基本原理、物质结构的基础理论和元素化学的基本知 识。有针对性地学习无机化学的基本概念、化学反应中的能量变化、化学反应速度和化学平衡、电 解质的电离平衡、氧化还原和电化学、物质结构基础、重要元素及其化合物的性质等方面的基本规 律和内容。 下面按各章列出基本要求和内容。基本要求按深入的程度分"了解"、"理解"、"掌握"和"熟练掌 握"四个层次。 第一章 气体 一、本章基本要求 •熟练掌握理想气体状态方程。 •掌握分压、分体积概念及计算。 •理解真实气体与理想气体的偏差。 •了解气体分子动理论。 二、教学内容 1.理想气体及状态方程。 2.分压定律、分体积定律。 3.气体分子动理论 (可自学) 4.真实气体 真实气体与理想气体的偏差、范德华方程

第二章热化学 一、本章基本要求 理解热力学的术语和基本概念。 熟练掌握热力学第一定律文字表述和数学表达式。 理解功、热、热力学能、焓、热容、摩尔相变焓、标准摩尔反应焓、标准摩尔生成焓、标准摩尔燃烧焓等概念。 掌握热力学第一定律在化学变化中的应用,掌握计算反应热效应。 二、教学纳容 1、热力学的术语和基本概念 系统、环境、状态、状态函数、过程、途径、相、反应进度 2、热力学第一定律 功、热、热力学能,热力学第一定律。 3、化学反应的热效应 定容反应热、定压反应热、热化学方程式、标准摩尔生成焓、标准摩尔然烧焓。 4.Hess定律 5、反应热的求算 第三章化学动力学基础 一、本章基本要求 ·理解化学反应速率的概念。 ·理解反应速率常数以及反应级数的概念。 掌握通过实验确立速率方程的方法。 ·了解一级、二级反应的速率方程及其应用。 ·理解阿累尼乌斯方程的意义,并掌握其应用。理解活化能及指前因子的意义。 ·理解气相双分子碰撞理论和过渡状态理论的基本观点及有关概念。 了解基元反应速率理论的基本思想。(可自学) ·了解催化作用。(可自学) 二、教学纳容 1.化学反应速率的概念 反应速率的表示方法。 2浓度对反应速率的影响, 一速率方程 化学反应的速率方程-质量作用定律。速率方程的一般形式、反应级数、速率常数。由实验确定反应 速率方程的简单方法。浓度与时间的定量关系。 3.温度对反应速率的影响 阿累尼乌斯公式,活化能,应用。 4.反应速度理论和反应机理简介 碰撞理论,过渡状态理论,活化能与反应速率,反应机理与元反应。 5.催化剂与催化作用 催化剂与催化作用的基本特征,均相催化与多相催化,酶催化
第二章 热化学 一、本章基本要求 •理解热力学的术语和基本概念。 •熟练掌握热力学第一定律文字表述和数学表达式。 •理解功、热、热力学能、焓、热容、摩尔相变焓、标准摩尔反应焓、标准摩尔生成焓、标准摩尔燃烧焓等概念。 •掌握热力学第一定律在化学变化中的应用,掌握计算反应热效应。 二、教学内容 1、热力学的术语和基本概念 系统、环境、状态、状态函数、过程、途径、相、反应进度。 2、热力学第一定律 功、热、热力学能,热力学第一定律。 3、化学反应的热效应 定容反应热、定压反应热、热化学方程式、标准摩尔生成焓、标准摩尔燃烧焓。 4、Hess定律 5、反应热的求算 第三章 化学动力学基础 一、本章基本要求 •理解化学反应速率的概念。 •理解反应速率常数以及反应级数的概念。 •掌握通过实验确立速率方程的方法。 •了解一级、二级反应的速率方程及其应用。 •理解阿累尼乌斯方程的意义,并掌握其应用。理解活化能及指前因子的意义。 •理解气相双分子碰撞理论和过渡状态理论的基本观点及有关概念。 了解基元反应速率理论的基本思想。(可自学) •了解催化作用。(可自学) 二、教学内容 1.化学反应速率的概念 反应速率的表示方法。 2.浓度对反应速率的影响——速率方程 化学反应的速率方程-质量作用定律。速率方程的一般形式、反应级数、速率常数。由实验确定反应 速率方程的简单方法。浓度与时间的定量关系。 3.温度对反应速率的影响 阿累尼乌斯公式,活化能,应用。 4. 反应速度理论和反应机理简介 碰撞理论,过渡状态理论,活化能与反应速率,反应机理与元反应。 5.催化剂与催化作用 催化剂与催化作用的基本特征,均相催化与多相催化,酶催化

第四章化学平衡熵和Gibbs函数 一、本章基本要求 掌握标准平衡常数的定义、计算及实验测定。 ·熟练掌握标准平衡常数的应用。 理解化学平衡的移动。 ·了解热力学第三定律,规定熵、标准熵,理解标准摩尔反应熵定义及计算, 理解热力学第二定律的意义。 ,掌握吉布斯函数变判据、标准摩尔生成吉布斯函数△Gm、△rGm9的计算及与平衡的关系。 二、教学纳容 1.标准平衡常数 化学平衡的基本特征,标准平衡常数的表示式及实验测定 2.标准平衡常数的应用 判断反应程度,预测反应方向,计算平衡组成。 3.化学平衡的移动 各种因素(浓度、压力、惰性组分)对平衡的影响 4.自发变化和熵 教型自发变化,混度和微观状态数,热力学第三定律,标准通化学饭应速 5.Gbbs函数 Gibbs函数变判据,标准摩尔生成Gibbs函数,Gibbsi函数与化学平衡,范特霍夫方程 第五章酸碱平衡 一、本章基本要求 ·理解酸碱质子理论。 掌握水的解离平衡和溶液的p叶 熟练掌握一元弱酸弱碱和盐的解离平衡及计算,掌握多元弱酸的解离平衡及计算 熟练掌握缓冲溶液H计算,理解缓冲溶液的作用原理。 掌握配合的组成与命名、配位平衡的有关计算。 二、教学内容 1.酸碱质子理论概述 酸碱质子理论的基本概念,酸和碱的相对强弱。 2.水的解离平衡和溶液的pH 水的解离平衡,溶液的pH。 3.弱酸弱碱的解离平衡 一元弱酸、弱碱的解离平衡,多元弱酸的解离平衡,盐溶液的酸碱平衡。 4.缓冲溶液 同离子效应,缓冲溶液,缓冲溶液pH计算 5.配位化合物
第四章 化学平衡 熵和Gibbs 函数 一、本章基本要求 •掌握标准平衡常数的定义、计算及实验测定。 •熟练掌握标准平衡常数的应用。 •理解化学平衡的移动。 •了解热力学第三定律,规定熵、标准熵,理解标准摩尔反应熵定义及计算。 •理解热力学第二定律的意义。 •掌握吉布斯函数变判据、标准摩尔生成吉布斯函数ΔfGmq、ΔrGmq的计算及与平衡的关系。 二、教学内容 1. 标准平衡常数 化学平衡的基本特征,标准平衡常数的表示式及实验测定 2.标准平衡常数的应用 判断反应程度,预测反应方向,计算平衡组成。 3. 化学平衡的移动 各种因素(浓度、压力、惰性组分)对平衡的影响 4.自发变化和熵 自发变化,熵和自发变化,混乱度、熵和微观状态数,热力学第三定律,标准熵,化学反应熵变和 热力学第二定律 5.Gibbs函数 Gibbs函数变判据,标准摩尔生成Gibbs函数,Gibbs函数与化学平衡,范特霍夫方程。 第五章 酸碱平衡 一、本章基本要求 •理解酸碱质子理论。 •掌握水的解离平衡和溶液的pH •熟练掌握一元弱酸弱碱和盐的解离平衡及计算,掌握多元弱酸的解离平衡及计算。 •熟练掌握缓冲溶液pH计算,理解缓冲溶液的作用原理。 •掌握配合的组成与命名、配位平衡的有关计算。 二、教学内容 1. 酸碱质子理论概述 酸碱质子理论的基本概念,酸和碱的相对强弱。 2. 水的解离平衡和溶液的pH 水的解离平衡,溶液的pH。 3. 弱酸弱碱的解离平衡 一元弱酸、弱碱的解离平衡,多元弱酸的解离平衡,盐溶液的酸碱平衡。 4. 缓冲溶液 同离子效应,缓冲溶液,缓冲溶液pH计算。 5. 配位化合物

配合物组成,配合物的化学式和命名,配合物的分类,配位反应和配位平衡。 第六章沉淀溶解平衡 一、本章基本要求 理解溶解度和溶度积的概念,熟练掌握溶度积与溶解度的关系及计算, ·熟练掌握溶度积规则、理解影响沉淀溶解平衡的因素,掌握沉淀溶解平衡的移动的有关计算。 掌握分步沉淀, ·了解沉淀的转化。 二、教学内容 1.溶解度和容度积 溶解度,溶度积,溶解度和溶度积的关系。 2.沉淀的生成和溶解 溶度积规则,同离子效应与盐效应,酸度对沉淀溶解平衡的影响,配位效应的影响 3.两种沉淀之间的平衡 分步沉淀,沉淀的转化 第七章氧化还原反应电化学基础 一、本章基本要求 掌握氧化还原方程式的配平, ·了解原电池的组成及符号、电能与化学能互变的规律 ,掌握电极电势的概念,熟,练掌握Nernst方程式的计算, •掌据电极电势的应用、元素电势图的意义及应用。 二、教学内容 1.氧化还原反应 氧化数与化合价氧化还原反应氧化还原反应方程式的配平 2.电化学电池 原电池的构造,原电池电动势的测定,原电池的最大功与吉布斯函数 3.电极电势 标准氢电极和甘汞电极,标准电极电势,Nernst方程 4.电极电势的应用 判断氧化剂、还原剂的相对强弱,判断氧化还原反应的方向、限度,元素电势图及其应用。 第八章原子结构 一、本章基本要求 ·了解原子结构的波尔理论 ·了解微观粒子运动的基本特征。 ·掌握波函数、能级的概念、四个量子数的物理意义、5、p、d原子轨道的形状和伸展方向、原子轨道能级 图、原子基态的核外电子排布规律。 ·掌握原子的电子层结构和元素周期系的关系、理解元素性质的周期性。 二、教学纳容 1.原子结构的玻尔理论(可自学) 历史回顾氢原子光谱,玻尔原子结构理论, 2.微观粒子运动的基本特征(可自学)
配合物组成,配合物的化学式和命名,配合物的分类,配位反应和配位平衡。 第六章 沉淀溶解平衡 一、本章基本要求 •理解溶解度和溶度积的概念,熟练掌握溶度积与溶解度的关系及计算。 •熟练掌握溶度积规则、理解影响沉淀-溶解平衡的因素,掌握沉淀-溶解平衡的移动的有关计算。 •掌握分步沉淀, •了解沉淀的转化。 二、教学内容 1. 溶解度和容度积 溶解度,溶度积,溶解度和溶度积的关系。 2.沉淀的生成和溶解 溶度积规则,同离子效应与盐效应,酸度对沉淀-溶解平衡的影响,配位效应的影响 3.两种沉淀之间的平衡 分步沉淀,沉淀的转化 第七章 氧化还原反应 电化学基础 一、本章基本要求 •掌握氧化还原方程式的配平。 •了解原电池的组成及符号、电能与化学能互变的规律 •掌握电极电势的概念,熟练掌握Nernst方程式的计算。 •掌握电极电势的应用、元素电势图的意义及应用。 二、教学内容 1.氧化还原反应 氧化数与化合价,氧化还原反应,氧化还原反应方程式的配平。 2.电化学电池 原电池的构造,原电池电动势的测定,原电池的最大功与吉布斯函数 3.电极电势 标准氢电极和甘汞电极,标准电极电势,Nernst方程。 4. 电极电势的应用 判断氧化剂、还原剂的相对强弱,判断氧化还原反应的方向、限度,元素电势图及其应用。 第八章 原子结构 一、本章基本要求 •了解原子结构的波尔理论。 •了解微观粒子运动的基本特征。 •掌握波函数、能级的概念、四个量子数的物理意义、s、p、d原子轨道的形状和伸展方向、原子轨道能级 图、原子基态的核外电子排布规律。 •掌握原子的电子层结构和元素周期系的关系、理解元素性质的周期性。 二、教学内容 1.原子结构的玻尔理论(可自学) 历史回顾,氢原子光谱, 玻尔原子结构理论。 2.微观粒子运动的基本特征(可自学)

微观粒子的波粒二象性,不确定原理与微观粒子运动的统计规律, 3.氢原子结构的量子力学描述 薛定谔方程与波函数,量子数,概率密度与电子云,原子轨道与电子云的空间图像。 4.多电子原子结构 多电子原子的能级,核外电子排布 5,元素周期表 元素的周期,元素的族,元素的分区, 6元素性质的周期性 原子半径,电离能,电子亲和能,电负性。 第九章分子结构 一、本章基本要求 熟练掌握掌握价键理论的基本内容。 掌握掌握杂化轨道理论和价层电子对互斥理论的基本内容, 理解分子轨首理论的基本内容,了解键参数意义 二、教学内容 1.路易斯理论 2.价键理论 共价键的形成和本质,价键理论的基本要点与共价键的特点,共价键的键型 3.杂化轨道理论 杂化轨道概念,杂化轨道的类型 4价层电子对互斥理论 价层电子对互斥理论的基本要点,分子几何构型的预测,判断分子(离子)几何构型的实例。 5.分子轨道理论 分子轨道理论的要点,分子轨道能级图及其应用,关于原子轨道和分子轨道的对称 6.键参数 第十章固体结构 一、本章基本要求 ·掌握离子晶体、原子晶体,分子晶体的结构类型。 ·了解金屈晶体的概念和混合型晶体的特征 掌握晶体的特性及与质点间作用力的关系和离子极化对物质性质的影响, 二、教学纳容 1.晶体结构和类型 晶体结构的特征与晶格理论,晶体类型 2.金属晶体 金属晶体的结构,金属键理论,能带理论 3.离子晶体 离子晶体的结构,晶格能,离子极化 4.分子晶体
微观粒子的波粒二象性,不确定原理与微观粒子运动的统计规律。 3. 氢原子结构的量子力学描述 薛定谔方程与波函数,量子数,概率密度与电子云,原子轨道与电子云的空间图像。 4.多电子原子结构 多电子原子的能级,核外电子排布。 5.元素周期表 元素的周期,元素的族,元素的分区。 6.元素性质的周期性 原子半径,电离能,电子亲和能,电负性。 第九章 分子结构 一、本章基本要求 •熟练掌握掌握价键理论的基本内容。 •掌握掌握杂化轨道理论和价层电子对互斥理论的基本内容。 •理解分子轨道理论的基本内容,了解键参数意义。 二、教学内容 1. 路易斯理论 2.价键理论 共价键的形成和本质,价键理论的基本要点与共价键的特点,共价键的键型。 3.杂化轨道理论 杂化轨道概念,杂化轨道的类型。 4.价层电子对互斥理论 价层电子对互斥理论的基本要点,分子几何构型的预测,判断分子(离子)几何构型的实例。 5.分子轨道理论 分子轨道理论的要点,分子轨道能级图及其应用,关于原子轨道和分子轨道的对称 性。 6.键参数 第十章 固体结构 一、本章基本要求 •掌握离子晶体、原子晶体,分子晶体的结构类型。 •了解金属晶体的概念和混合型晶体的特征。 •掌握晶体的特性及与质点间作用力的关系和离子极化对物质性质的影响。 二、教学内容 1.晶体结构和类型 晶体结构的特征与晶格理论,晶体类型 2.金属晶体 金属晶体的结构,金属键理论,能带理论。 3.离子晶体 离子晶体的结构,晶格能,离子极化 4.分子晶体

分子偶极矩和极化率,分子间作用力,氢键。 5.层状晶体(可自学) 第十一章配合物结构 一.本音基本要求 ·了解配合物的空间构型、异构现象和磁性。 掌握配合物的价键理论的要点,并用于解释配合物的有关性质 掌握晶体场理论,并用于解释配合物的有关性质。 二、教学内容 1.配合物的空间构型、异构现象和磁性 2.配合物的化学键理论 价键理论,晶体场理论。 第十二章S区元素 一、本章基本要求 ,掌握$区元素的通性。 ·掌握碱金属和减土金属元素的通性、性质与结构、一般的制备方法以及性质。 ·掌握碱金属和碱土金属元素的氢氧化物的碱性和溶解性,以及它们盐类的溶解性、稳定性等性质的变化规 律, ·了解锂、皱的特性及对角线规则, 二、教学内容 1.S区元素概述 2.S区元素的单质 单质的物理性质和化学性质,S区元素的存在和单质的制备。 3.S区元素的化合物 氢化物,氧化物,氢氧化物,重要的盐类及其性质。 4钾和被的特殊性、对角线规则 锂和皱的特殊性,对角线规则。 第十三章P区元素 一、本章基本要求 ,根据元素在周期表中的位置及原子结构的特点理解和掌握非金属元素的通性。 的性 和 理, 化铝及铝 差异 掌握碳和硅的单质、氧化物、含氧酸及其盐以及其他重要化合物的结构和性质, 掌握氨及其重要的化合物的结构、性质和用途,掌握磷及其重要化合物的结构和性质,掌据砷、锑、铋单 质及其化合物的性质,从结构特点分析理解氮族元素的通性和特性。 ·掌握氧、臭氧、氧化物及过氧化物的结构和性质,过氧化氢的制备和用途;掌握单质硫的氢化物、氧化 物、重要含氧酸及其盐的结构、性质、制备和用途。 的规含用转絮
分子偶极矩和极化率,分子间作用力,氢键。 5.层状晶体(可自学) 第十一章 配合物结构 一、本章基本要求 •了解配合物的空间构型、异构现象和磁性。 •掌握配合物的价键理论的要点,并用于解释配合物的有关性质。 •掌握晶体场理论,并用于解释配合物的有关性质。 二、教学内容 1.配合物的空间构型、异构现象和磁性 2.配合物的化学键理论 价键理论,晶体场理论。 第十二章 S区元素 一、本章基本要求 •掌握S区元素的通性。 •掌握碱金属和碱土金属元素的通性、性质与结构、一般的制备方法以及性质。 •掌握碱金属和碱土金属元素的氢氧化物的碱性和溶解性,以及它们盐类的溶解性、稳定性等性质的变化规 律。 •了解锂、铍的特性及对角线规则。 二、教学内容 1. S区元素概述 2. S区元素的单质 单质的物理性质和化学性质,S区元素的存在和单质的制备。 3. S区元素的化合物 氢化物,氧化物,氢氧化物,重要的盐类及其性质。 4.锂和铍的特殊性、对角线规则 锂和铍的特殊性,对角线规则。 第十三章 P 区元素 一、本章基本要求 •根据元素在周期表中的位置及原子结构的特点理解和掌握非金属元素的通性。 •掌握硼的单质、氢化物、含氧化合物的结构与性质,硼原子的结构特点和硼在形成化合物时的成键特征, 掌握铝的性质和冶炼原理,氧化铝、氢氧化铝及铝盐的性质,从原子结构认识硼、铝两种元素成键特点与 差异。 •掌握碳和硅的单质、氧化物、含氧酸及其盐以及其他重要化合物的结构和性质。 •掌握氮及其重要的化合物的结构、性质和用途,掌握磷及其重要化合物的结构和性质,掌握砷、锑、铋单 质及其化合物的性质,从结构特点分析理解氮族元素的通性和特性。 •掌握氧、臭氧、氧化物及过氧化物的结构和性质,过氧化氢的制备和用途;掌握单质硫的氢化物、氧化 物、重要含氧酸及其盐的结构、性质、制备和用途。 •掌握卤素及其重要化合物的结构、性质、制备、用途以及卤素的通性和特性,根据卤素原子的结构成键特 点,分析理解各卤素的单质及化合物的性质,认识一种元素在不同氧化态时物质性质的规律性联系(以氯

为典型)和卤族各元素间的规律性联系,从而掌握研究一族元素的基本方法:从结构和性质对比认识氧族 元素和卤族元素的联系和差异, 综合认识IA~VA族元素性质的变化规律,注意从成键特点认识名族第二周期元素与其它各周期元素的 差异情况及规律. 掌握稀有气体单质的性质及其结构特点,了解稀有气体的发展史、用途、化合物的性质等。 二、教学内容 1.p区元素概述 2.硼族元素 硼的化合物,铝的化合物。 3.碳族元素 碳及其化合物,硅及其化合物,锡、铅的化合物 4.氨族 氮族元素通性,氮及其化合物,磷及其化合物,砷、锑、铋及其化合物。 5.族 氧族元素通性,氧及其化合物,硫及其化合物,硒和碲。 6.卤素 卤素的通性,卤素的单质,卤化氢和卤化物,卤素的含氧化合物,拟卤素。 7.稀有气体 稀有气体的性质和用途,稀有气体的存在和分离,稀有气体的化合物。 第十四章d区元素 一、本章基本要求 ,掌握区元素的价电子层结构的特点及其与过渡元素通性的关系 ,掌握重要元素钛、钒、铬、锰、铁、钴、镍的单质及重要化合物的性质和用途。 ·掌握铜族及锌族元素的单质及其重要化合物的性质和用途;掌握Cu(0和Cu(心、Hg()和Hg()之间 的相互转化;掌握IA与B、A与IB族元素性质的异同,能用结构观点分析。 二、教学纳容 1.d区元素的通性 原子半径,单质的物理性质,金属活泼性,过渡元素的氧化值,离子的颜色,配合性,磁性,催化 2.钛及化合物 钛单质性质及提取,钛的化合物,二氧化钛的制取。 3.钒及化合物 4.铬及其化合物 不同氧化态的铬存在形式及常见反应,铬的重要化合物。 5.锰及其化合物 不同氧化态的锰存在形式及常见反应,锰的重要化合物,影响氧化还原产物的因素。 6.铁、钴、镍及其化合物 铁系元素离子存在形式及常见反应,铁系元素的配合物,铁系元素重要化合物和NSO4的制备 7.铜族元素 铜族元素概述,铜族元素重要化合物,Cu()和Cu()的相互转化。 8控栋示素 锌族元素概述,锌族元素重要化合物,Hg和Hg()的相互转化。 三,学时分配 序号 教学内容 学时课外学时
为典型)和卤族各元素间的规律性联系,从而掌握研究一族元素的基本方法;从结构和性质对比认识氧族 元素和卤族元素的联系和差异。 •综合认识IIIA~VIIA族元素性质的变化规律,注意从成键特点认识各族第二周期元素与其它各周期元素的 差异情况及规律。 •掌握稀有气体单质的性质及其结构特点,了解稀有气体的发展史、用途、化合物的性质等。 二、教学内容 1.p区元素概述 2.硼族元素 硼的化合物,铝的化合物。 3.碳族元素 碳及其化合物,硅及其化合物,锡、铅的化合物。 4.氮族 氮族元素通性,氮及其化合物,磷及其化合物,砷、锑、铋及其化合物。 5.氧族 氧族元素通性,氧及其化合物,硫及其化合物,硒和碲。 6.卤素 卤素的通性,卤素的单质,卤化氢和卤化物,卤素的含氧化合物,拟卤素。 7.稀有气体 稀有气体的性质和用途,稀有气体的存在和分离,稀有气体的化合物。 第十四章 d区元素 一、本章基本要求 •掌握d区元素的价电子层结构的特点及其与过渡元素通性的关系。 •掌握重要元素钛、钒、铬、锰、铁、钴、镍的单质及重要化合物的性质和用途。 •掌握铜族及锌族元素的单质及其重要化合物的性质和用途;掌握Cu(I) 和Cu(II)、Hg(I) 和Hg(II)之间 的相互转化;掌握IA与IB、IIA与IIB族元素性质的异同,能用结构观点分析。 二、教学内容 1.d区元素的通性 原子半径,单质的物理性质,金属活泼性,过渡元素的氧化值,离子的颜色,配合性,磁性,催化 性。 2.钛及化合物 钛单质性质及提取,钛的化合物,二氧化钛的制取。 3.钒及化合物 4.铬及其化合物 不同氧化态的铬存在形式及常见反应,铬的重要化合物。 5.锰及其化合物 不同氧化态的锰存在形式及常见反应,锰的重要化合物,影响氧化还原产物的因素。 6.铁、钴、镍及其化合物 铁系元素离子存在形式及常见反应,铁系元素的配合物,铁系元素重要化合物和NiSO4的制备。 7.铜族元素 铜族元素概述,铜族元素重要化合物,Cu(I)和Cu(II)的相互转化。 8.锌族元素 锌族元素概述,锌族元素重要化合物,Hg(I) 和Hg(II)的相互转化。 三.学时分配 序号 教学内容 学时 课外学时

1 绪论 2 写休 3 热化学 4 化学动力学基础 4 5 化学平衡衙 4 6 酸碱平衡 4 沉淀平衡 4 8 氧化还原反应电化学基础4 q 百子结物 4 10 分子结格 6 11 周体结构 4 3 12 配合物结构 4 3 13 碱金属与碱土金属 2 14 朋族碳族元素 4 15 短族氧族元素 4 2 16 卤素元素与稀有气体 17 d区元素 18 铜族锌族元素 19 镧系和锕系元素 选讲 2 20 核化学 选讲 21 无机化学前沿个绍 4 合计 64 52 四、教学方法与教学手段说明 本课程以课堂讲授为主,辅以课堂讨论和seminar,以及自学,作业等教学环节。教学中采用PowerPointE电子教 案、CAI课件和板书相结合方式教学。 五、考核方式和要求 本课程一学期完成,进行期末统一闭卷考试, 考核成绩由三部分组成:1、平时作业:2、阶段验:3、期末考试 六、教材 教材:大连理工大学无机化学教研室编.《无机化学》第五版,北京:高等教育出版社,2006年。 《无机化学实验A》教学大纲 1.课程名称(中文):无机化学实验A 课程名称(英文):Experiment of Inorganic Chemistry 2.课程编码:GHXS04 3.课程类别:基础 4.课程要求:必修
1 绪论 1 1 2 气体 1 1 3 热化学 4 2 4 化学动力学基础 4 3 5 化学平衡 4 4 6 酸碱平衡 4 3 7 沉淀平衡 4 2 8 氧化还原反应 电化学基础 4 4 9 原子结构 4 4 10 分子结构 6 5 11 固体结构 4 3 12 配合物结构 4 3 13 碱金属与碱土金属 2 1 14 硼族碳族元素 4 2 15 氮族氧族元素 4 2 16 卤素元素与稀有气体 2 1 17 d区元素 4 2 18 铜族锌族元素 2 1 19 镧系和锕系元素 选讲 2 20 核化学 选讲 2 21 无机化学前沿介绍 2 4 合 计 64 52 四、教学方法与教学手段说明 本课程以课堂讲授为主,辅以课堂讨论和seminar,以及自学,作业等教学环节。教学中采用PowerPoint电子教 案、CAI课件和板书相结合方式教学。 五、考核方式和要求 本课程一学期完成,进行期末统一闭卷考试。 考核成绩由三部分组成:1、平时作业;2、阶段测验;3、期末考试。 六、教材 教 材:大连理工大学无机化学教研室编.《无机化学》第五版,北京:高等教育出版社,2006年。 《无机化学实验A》教学大纲 1.课程名称(中文):无机化学实验A 课程名称(英文): Experiment of Inorganic Chemistry 2.课程编码:GHXS04 3.课程类别:基础 4.课程要求:必修

5.课程性质:独立设课 6.实验学时:48学时学分:1.5 7.应开学期:第1学期 8.适用专业:应用化学 9.先修课程:无机化学 一、实验课程简介 它既是一门独立 配合的课 验的其本知 作技能;进 步熟 无素及其化合 物的重要性质和反应: 掌握无机化合物的 股离和纯方法,深对化学基 理解 数科学法,为本专 后续课程的学习和科学研究的开展打良好的 二、教学目标与基本要求 1、 a 度酸机的使用, 了解某些常数的测定方法。注重培养学生养成证确记录、合理处理实验数据的能力。 性质 溶解在及省性质实 合物的提纯实验,学习基本理论、基本知识和基本技能的综合运用,在实验中保证产 能根据实验需要,通过查阅手册,工具书和其他信息源获取必要信息,能独立、正确的设计实验(选择实验方 法、实验条件、所需仪器、设备和试剂等),独立撰写设计方案,具有一定的创新意识与创新能力。 三、实验课程的基本理论与实验技术知识 整赛美如货学的基本原理。元素及其化合物的性质 1、实验室安全及卫生知识: 玻璃仪器的清洗和干燥: 3. 常用玻璃仪器、台秤和电子天平的正确使用; 水浴加热,电热加热,溶解,沉淀,减压过滤,蒸发浓缩,结晶,烘干: 试剂配制及其取用; 6 查阅无机化学手册及有关资料: 7、实验记录、数据处理及实验报告撰写: 四、主要仪器设备 天平;数显恒温水浴锅;:沉淀离心机;电加热器;酸度计;真空水泵;减压过滤器 五、实验项目设置与内容提要 内容提要 群著
5.课程性质:独立设课 6.实验学时:48学时 学分:1.5 7.应开学期:第1学期 8.适用专业:应用化学 9.先修课程:无机化学 一、实验课程简介 无机化学实验A是化学工程、生物工程、应用化学和材料工程各专业本科生的基础课之一。它既是一门独立的 课程,又是与无机化学理论课紧密配合的课程。通过无机化学实验,学习并掌握无机化学实验的基本知识和基本操 作技能;进一步熟悉元素及其化合物的重要性质和反应;掌握无机化合物的一般分离和提纯方法;加深对化学基本 原理和基础知识的理解和掌握;培养细致地观察和记录现象、数据,归纳、综合和正确处理数据,分析实验现象, 表达实验结果的能力;培养独立思考、运用所学理论知识分析问题和解决问题的能力;培养严谨的实事求是的科学 态度、准确细致等良好的科学习惯及科学的思维方法,为本专业后续课程的学习和科学研究的开展打下良好的基 础。 二、教学目标与基本要求 1、基本操作和技能训练 (1)掌握实验室中常用的加热方法。 (2)常用玻璃器皿的洗涤。 (3)固体试剂和液体试剂的取用。 (4)量筒、容量瓶、移液管、台秤、电子天平、酸度计和离心机的使用。 (5)掌握试管反应(包括空白与对照试验)的操作,气体检验。 (6)沉淀的分离和洗涤。 (7)试纸的选择和使用。 (8)常压和减压过滤,蒸发、浓缩结晶、简单干燥等操作。 2、测定实验 了解某些常数的测定方法。注重培养学生养成正确记录、合理处理实验数据的能力。 3、性质实验 通过元素及化合物的性质实验,个别离子和混合离子的检出实验,掌握常见元素及化合物的酸碱 性、溶解性、氧化还原性、水解及配位等性质。培养学生正确观察、记录、分析现象和解释归纳的 能力。 4、提纯实验 通过无机化合物的提纯实验,学习基本理论、基本知识和基本技能的综合运用,在实验中保证产 物的质量及产率。 5、设计和研究实验 能根据实验需要,通过查阅手册,工具书和其他信息源获取必要信息,能独立、正确的设计实验(选择实验方 法、实验条件、所需仪器、设备和试剂等),独立撰写设计方案,具有一定的创新意识与创新能力。 三、实验课程的基本理论与实验技术知识 基本理论:化学的基本原理、元素及其化合物的性质 实验技术知识: 1、 实验室安全及卫生知识; 2、 玻璃仪器的清洗和干燥; 3、 常用玻璃仪器、台秤和电子天平的正确使用; 4、 水浴加热,电热加热,溶解,沉淀,减压过滤,蒸发浓缩,结晶,烘干; 5、 试剂配制及其取用; 6、 查阅无机化学手册及有关资料; 7、 实验记录、数据处理及实验报告撰写; 四、主要仪器设备 天平;数显恒温水浴锅;沉淀离心机;电加热器;酸度计;真空水泵;减压过滤器 五、实验项目设置与内容提要 序 号 实验项目 名称 内容提要 学 时 每组 人数 实验 属性 实验 者 是否 必做
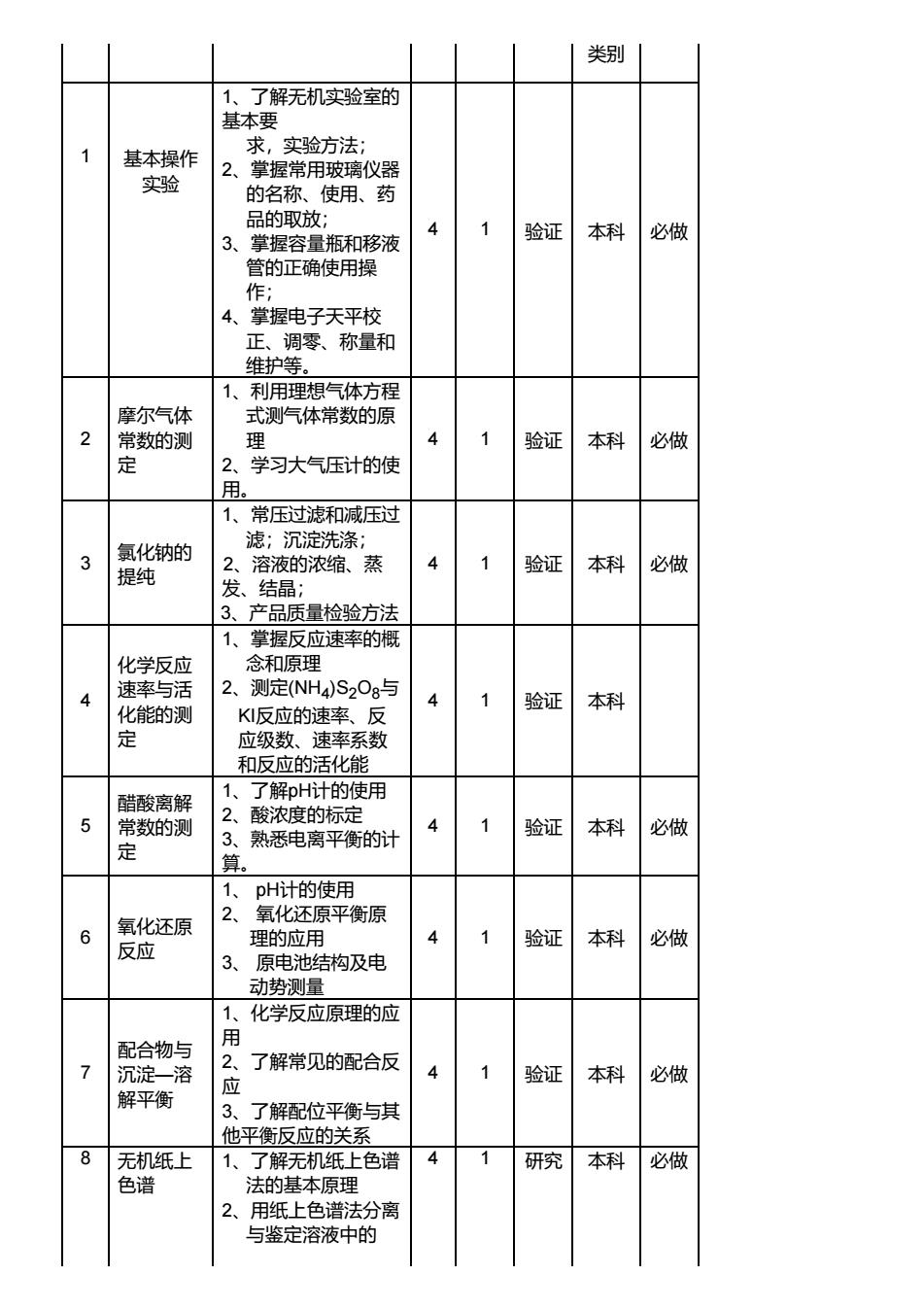
类别 1了解无机实验室的 基本要 基本操作 求,实验方法; 掌握常用玻璃仪器 实验 2 的名称 、使用、药 品的取放; 4 1 3、掌握容量瓶和移液 验证本科 必做 管的正确使用操 作 4、 掌握电子天平校 正、调零、称量和 维护等。 1、利用理想气体方程 摩尔气体 式测气体常数的原 2 常数的测 理 4 验证 本科 必做 2 学习大气压计的使 用 常压过滤和减压过 氯化钠的 滤:沉淀洗涤, 溶液的浓缩、蒸 4 验证本科 必做 提纯 发、结晶: 3、产品质量检验方法 化学反应 速率与活 2、测定(NH4)S2Og与 火能的测 K反应的速率、反 验证本科 定 应级数 ,速率系数 和反应的活化能 了解pH计的使用 酷酸离翻 常数的测 酸浓度的标定 3 电离平衡的计 验证 本科 必做 1 pH计的使用 氧化还原 2、 氧化还原平衡原 理的应 验证 本科 必做 原电也 结构及电 动势刘量 1 化学反应原理的成 配合物与 1 2 了解常见的配合反 沉淀一溶 4 1 验证本科 必做 解平衡 3、了解配位平衡与其 他平衡反应的关系 8 无机纸上 了解无机纸上色谱 4 1 色谱 研究本科 必做 法的基本原理 2、用纸上色谱法分离 与鉴定溶液中的
类别 1 基本操作 实验 1、了解无机实验室的 基本要 求,实验方法; 2、掌握常用玻璃仪器 的名称、使用、药 品的取放; 3、掌握容量瓶和移液 管的正确使用操 作; 4、掌握电子天平校 正、调零、称量和 维护等。 4 1 验证 本科 必做 2 摩尔气体 常数的测 定 1、利用理想气体方程 式测气体常数的原 理 2、学习大气压计的使 用。 4 1 验证 本科 必做 3 氯化钠的 提纯 1、常压过滤和减压过 滤;沉淀洗涤; 2、溶液的浓缩、蒸 发、结晶; 3、产品质量检验方法 4 1 验证 本科 必做 4 化学反应 速率与活 化能的测 定 1、掌握反应速率的概 念和原理 2、测定(NH 4 )S 2 O 8 与 KI反应的速率、反 应级数、速率系数 和反应的活化能 4 1 验证 本科 5 醋酸离解 常数的测 定 1、了解pH计的使用 2、酸浓度的标定 3、熟悉电离平衡的计 算。 4 1 验证 本科 必做 6 氧化还原 反应 1 、 pH计的使用 2 、 氧化还原平衡原 理的应用 3 、 原电池结构及电 动势测量 4 1 验证 本科 必做 7 配合物与 沉淀 — 溶 解平衡 1、化学反应原理的应 用2、了解常见的配合反 应3、了解配位平衡与其 他平衡反应的关系 4 1 验证 本科 必做 8 无机纸上 色谱 1、了解无机纸上色谱 法的基本原理 2、用纸上色谱法分离 与鉴定溶液中的 4 1 研究 本科 必做