
第五节 蛋白质 蛋白质存在于一切生物体内,在细胞的结构和功能中起着十分重要的作用。 根据蛋白质的元素分析,发现其元素组成与糖类和脂类不同,除含有碳、氢、氧 以外,还含有氮和少量的硫,有些还含有磷、铁、铜、碘、锌、钼等。蛋白质的 平均含氮量为 16%,这是凯氏定氮法测定蛋白质含量的计算依据。蛋白质的基本 结构单位是氨基酸,蛋白质分子中的氨基酸残基依靠肽键连接。生物界中蛋白质 的种类数估计在 1010~1012 数量级之间,造成种类如此众多的原因,主要是 20 种参与蛋白质组成的氨基酸在肽链中的排列顺序不同所引起的。蛋白质的这种顺 序异构现象是蛋白质生物功能多样化和种属特异性的结构基础。 根据其分子组成,蛋白质可以分为两类。有些蛋白质完全由氨基酸构成,称 为简单蛋白质。简单蛋白质又可根据其物理化学性质分为清蛋白、球蛋白、谷蛋 白、醇溶蛋白、组蛋白、鱼精蛋白、硬蛋白等。而另有一些蛋白质除了蛋白质部 分外,还含有非蛋白质成分,这类蛋白质称为结合蛋白质。结合蛋白质的非蛋白 质部分称为辅助因子。结合蛋白质又可按辅助因子成分分为核蛋白、脂蛋白、糖 蛋白、磷蛋白、血红素蛋白、黄素蛋白、金属蛋白等等。 每一种蛋白质都有其特定的三维结构。蛋白质分子中氨基酸的排列顺序仅仅 是蛋白质最基本的结构,叫做蛋白质的一级结构。而蛋白质的二级结构和三级结 构与多肽链三维结构有关。有些蛋白质由数条充分折叠、卷曲的多肽链缔合,组 成蛋白质的最高级结构,称为四级结构。在蛋白质的四级结构中,具有三级结构 的多肽链单元称为亚基。蛋白质的三维结构主要由一些非共价键维系。 食品加工的对象是一切具有可食特性的生物材料,而所有的生物材料中都含 有蛋白质。蛋白质是食品的主要营养成分,它除了为机体提供各种氨基酸和含氮 物质所需的氮源外,在决定食品的色、香、味及结构特征上都有很重要的作用。 因此,了解蛋白质的组成、结构、功能和性质,及其在加工过程中所发生的变化, 具有很重要的实际意义。 一、蛋白质的结构及其中的主要作用力 蛋白质是以氨基酸为单位而构成的大分子物质,结构非常复杂。蛋白质的一 级结构是指蛋白质分子中氨基酸的连接方式和排列顺序。在蛋白质分子中氨基酸 彼此以肽键相连呈链状结构。肽链中的肽键是一个氨基酸的羧基与另一个氨基酸 的氨基脱水缩合而成的酰胺键。蛋白质一级结构不但影响蛋白质的基本性质,也 会使二级和三级结构有所不同。蛋白质的二级结构是指蛋白质分子中多肽链本身 的折叠方式。多肽链的二级结构主要是 -螺旋结构和β-折叠结构。它们是依靠 分子内形成的氢键维持其稳定性。二级结构的肽链进一步折叠、卷曲可形成复杂 的三级结构。蛋白质的三级结构大部分为球形,但也有纤维状等其他形状的蛋白 质。稳定蛋白质三级结构的化学键有离子键、氢键、二硫键、范德华力及非极性 的疏水作用力等,这些作用力和键可统称为次级键。在蛋白质三级结构中,依靠 次级键作用,亲水性的极性 R 基团位于分子表面,而非极性的 R 基团则位于分 子内部,从而提高了蛋白质在水溶液中的溶解度。蛋白质四级结构是指在三级结 构基础上两条或多条多肽链以特殊方式结合形成的有生物活性的蛋白质。例如, 血红蛋白是由两条 -链和两条β-链组成的聚合体,这些多肽链称为亚基或亚单
第五节 蛋白质 蛋白质存在于一切生物体内,在细胞的结构和功能中起着十分重要的作用。 根据蛋白质的元素分析,发现其元素组成与糖类和脂类不同,除含有碳、氢、氧 以外,还含有氮和少量的硫,有些还含有磷、铁、铜、碘、锌、钼等。蛋白质的 平均含氮量为 16%,这是凯氏定氮法测定蛋白质含量的计算依据。蛋白质的基本 结构单位是氨基酸,蛋白质分子中的氨基酸残基依靠肽键连接。生物界中蛋白质 的种类数估计在 1010~1012 数量级之间,造成种类如此众多的原因,主要是 20 种参与蛋白质组成的氨基酸在肽链中的排列顺序不同所引起的。蛋白质的这种顺 序异构现象是蛋白质生物功能多样化和种属特异性的结构基础。 根据其分子组成,蛋白质可以分为两类。有些蛋白质完全由氨基酸构成,称 为简单蛋白质。简单蛋白质又可根据其物理化学性质分为清蛋白、球蛋白、谷蛋 白、醇溶蛋白、组蛋白、鱼精蛋白、硬蛋白等。而另有一些蛋白质除了蛋白质部 分外,还含有非蛋白质成分,这类蛋白质称为结合蛋白质。结合蛋白质的非蛋白 质部分称为辅助因子。结合蛋白质又可按辅助因子成分分为核蛋白、脂蛋白、糖 蛋白、磷蛋白、血红素蛋白、黄素蛋白、金属蛋白等等。 每一种蛋白质都有其特定的三维结构。蛋白质分子中氨基酸的排列顺序仅仅 是蛋白质最基本的结构,叫做蛋白质的一级结构。而蛋白质的二级结构和三级结 构与多肽链三维结构有关。有些蛋白质由数条充分折叠、卷曲的多肽链缔合,组 成蛋白质的最高级结构,称为四级结构。在蛋白质的四级结构中,具有三级结构 的多肽链单元称为亚基。蛋白质的三维结构主要由一些非共价键维系。 食品加工的对象是一切具有可食特性的生物材料,而所有的生物材料中都含 有蛋白质。蛋白质是食品的主要营养成分,它除了为机体提供各种氨基酸和含氮 物质所需的氮源外,在决定食品的色、香、味及结构特征上都有很重要的作用。 因此,了解蛋白质的组成、结构、功能和性质,及其在加工过程中所发生的变化, 具有很重要的实际意义。 一、蛋白质的结构及其中的主要作用力 蛋白质是以氨基酸为单位而构成的大分子物质,结构非常复杂。蛋白质的一 级结构是指蛋白质分子中氨基酸的连接方式和排列顺序。在蛋白质分子中氨基酸 彼此以肽键相连呈链状结构。肽链中的肽键是一个氨基酸的羧基与另一个氨基酸 的氨基脱水缩合而成的酰胺键。蛋白质一级结构不但影响蛋白质的基本性质,也 会使二级和三级结构有所不同。蛋白质的二级结构是指蛋白质分子中多肽链本身 的折叠方式。多肽链的二级结构主要是 -螺旋结构和β-折叠结构。它们是依靠 分子内形成的氢键维持其稳定性。二级结构的肽链进一步折叠、卷曲可形成复杂 的三级结构。蛋白质的三级结构大部分为球形,但也有纤维状等其他形状的蛋白 质。稳定蛋白质三级结构的化学键有离子键、氢键、二硫键、范德华力及非极性 的疏水作用力等,这些作用力和键可统称为次级键。在蛋白质三级结构中,依靠 次级键作用,亲水性的极性 R 基团位于分子表面,而非极性的 R 基团则位于分 子内部,从而提高了蛋白质在水溶液中的溶解度。蛋白质四级结构是指在三级结 构基础上两条或多条多肽链以特殊方式结合形成的有生物活性的蛋白质。例如, 血红蛋白是由两条 -链和两条β-链组成的聚合体,这些多肽链称为亚基或亚单
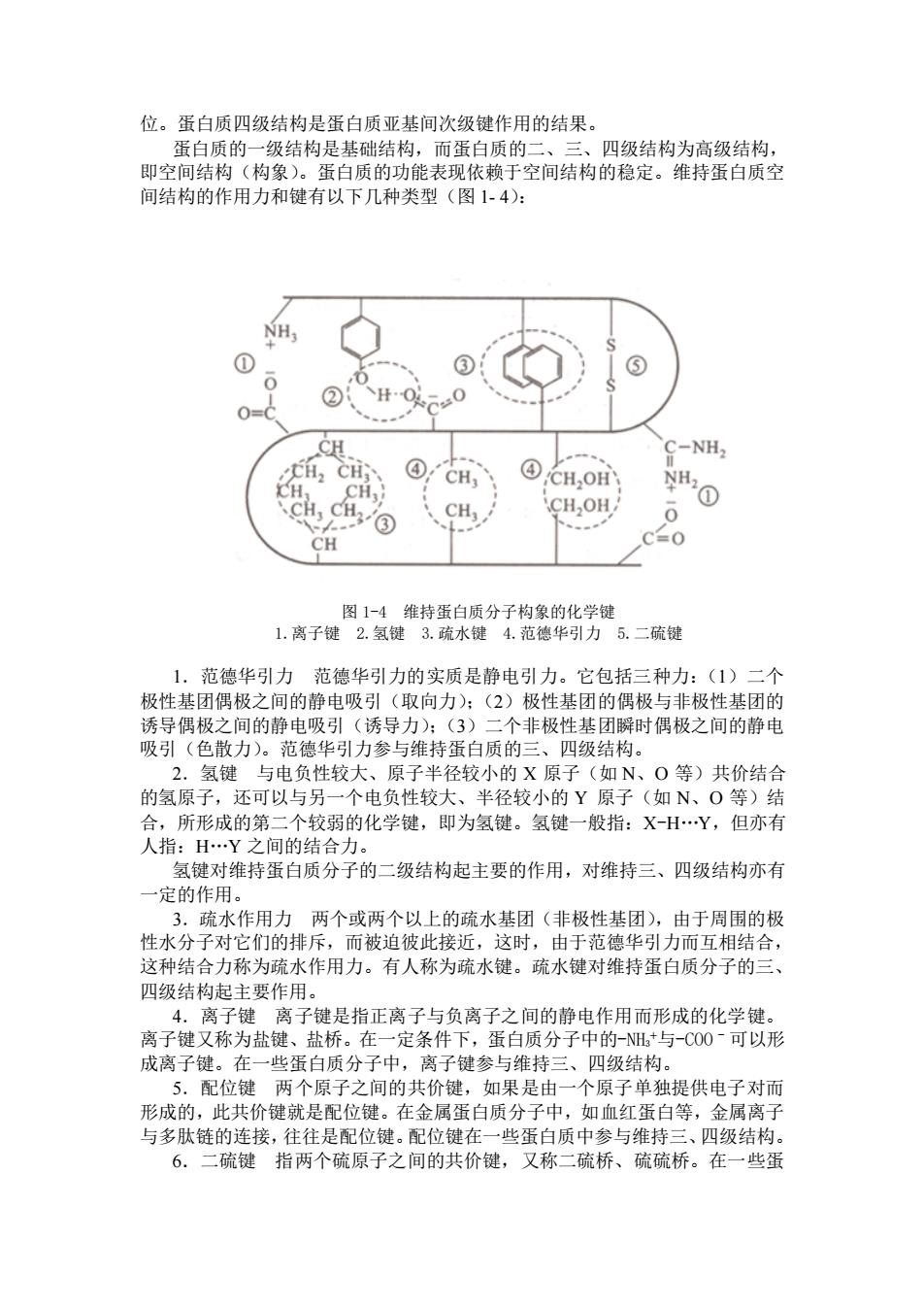
位。蛋白质四级结构是蛋白质亚基间次级键作用的结果。 蛋白质的一级结构是基础结构,而蛋白质的二、三、四级结构为高级结构, 即空间结构(构象)。蛋白质的功能表现依赖于空间结构的稳定。维持蛋白质空 间结构的作用力和键有以下几种类型(图 1- 4): 图 1-4 维持蛋白质分子构象的化学键 1.离子键 2.氢键 3.疏水键 4.范德华引力 5.二硫键 1.范德华引力 范德华引力的实质是静电引力。它包括三种力:(1)二个 极性基团偶极之间的静电吸引(取向力);(2)极性基团的偶极与非极性基团的 诱导偶极之间的静电吸引(诱导力);(3)二个非极性基团瞬时偶极之间的静电 吸引(色散力)。范德华引力参与维持蛋白质的三、四级结构。 2.氢键 与电负性较大、原子半径较小的 X 原子(如 N、O 等)共价结合 的氢原子,还可以与另一个电负性较大、半径较小的 Y 原子(如 N、O 等)结 合,所形成的第二个较弱的化学键,即为氢键。氢键一般指:X-H.Y,但亦有 人指:H.Y 之间的结合力。 氢键对维持蛋白质分子的二级结构起主要的作用,对维持三、四级结构亦有 一定的作用。 3.疏水作用力 两个或两个以上的疏水基团(非极性基团),由于周围的极 性水分子对它们的排斥,而被迫彼此接近,这时,由于范德华引力而互相结合, 这种结合力称为疏水作用力。有人称为疏水键。疏水键对维持蛋白质分子的三、 四级结构起主要作用。 4.离子键 离子键是指正离子与负离子之间的静电作用而形成的化学键。 离子键又称为盐键、盐桥。在一定条件下,蛋白质分子中的-NH3 +与-COOˉ可以形 成离子键。在一些蛋白质分子中,离子键参与维持三、四级结构。 5.配位键 两个原子之间的共价键,如果是由一个原子单独提供电子对而 形成的,此共价键就是配位键。在金属蛋白质分子中,如血红蛋白等,金属离子 与多肽链的连接,往往是配位键。配位键在一些蛋白质中参与维持三、四级结构。 6.二硫键 指两个硫原子之间的共价键,又称二硫桥、硫硫桥。在一些蛋
位。蛋白质四级结构是蛋白质亚基间次级键作用的结果。 蛋白质的一级结构是基础结构,而蛋白质的二、三、四级结构为高级结构, 即空间结构(构象)。蛋白质的功能表现依赖于空间结构的稳定。维持蛋白质空 间结构的作用力和键有以下几种类型(图 1- 4): 图 1-4 维持蛋白质分子构象的化学键 1.离子键 2.氢键 3.疏水键 4.范德华引力 5.二硫键 1.范德华引力 范德华引力的实质是静电引力。它包括三种力:(1)二个 极性基团偶极之间的静电吸引(取向力);(2)极性基团的偶极与非极性基团的 诱导偶极之间的静电吸引(诱导力);(3)二个非极性基团瞬时偶极之间的静电 吸引(色散力)。范德华引力参与维持蛋白质的三、四级结构。 2.氢键 与电负性较大、原子半径较小的 X 原子(如 N、O 等)共价结合 的氢原子,还可以与另一个电负性较大、半径较小的 Y 原子(如 N、O 等)结 合,所形成的第二个较弱的化学键,即为氢键。氢键一般指:X-H.Y,但亦有 人指:H.Y 之间的结合力。 氢键对维持蛋白质分子的二级结构起主要的作用,对维持三、四级结构亦有 一定的作用。 3.疏水作用力 两个或两个以上的疏水基团(非极性基团),由于周围的极 性水分子对它们的排斥,而被迫彼此接近,这时,由于范德华引力而互相结合, 这种结合力称为疏水作用力。有人称为疏水键。疏水键对维持蛋白质分子的三、 四级结构起主要作用。 4.离子键 离子键是指正离子与负离子之间的静电作用而形成的化学键。 离子键又称为盐键、盐桥。在一定条件下,蛋白质分子中的-NH3 +与-COOˉ可以形 成离子键。在一些蛋白质分子中,离子键参与维持三、四级结构。 5.配位键 两个原子之间的共价键,如果是由一个原子单独提供电子对而 形成的,此共价键就是配位键。在金属蛋白质分子中,如血红蛋白等,金属离子 与多肽链的连接,往往是配位键。配位键在一些蛋白质中参与维持三、四级结构。 6.二硫键 指两个硫原子之间的共价键,又称二硫桥、硫硫桥。在一些蛋

白质中,二硫键对稳定蛋白质分子构象起重要的作用。 二、蛋白质的变性 当蛋白质用酸、碱、浓盐溶液、有机溶剂、热、高压、激烈振荡和辐射处理 时,会不同程度地改变其构象。这个过程称为变性。从分子结构上看,变性作用 是多肽链特有的折叠结构发生的变化,成为无规卷曲或混乱伸展的结构,它仅涉 及蛋白质二、三、四级结构的变化,而并不包括一级结构肽链的破坏。也就是说, 变性时蛋白质中氢键、盐键和疏水作用等遭受到破坏,而肽键的共价键并未打断。 变性时蛋白质的性质也发生变化:(1)由于疏水基团大量暴露在分子表面,从而 降低了蛋白质的溶解度;(2)改变了对水的结合能力;(3)由于变性后的蛋白质 分子空间结构破坏,很难保持原有的生物活性;(4)发生絮集,形成不可逆的凝 胶;(5)由于肽键暴露,特别容易受到蛋白酶的攻击,从而提高对蛋白酶水解的 敏感性;(6)黏度增加;(7)不能形成结晶等。 天然蛋白质的变性可以是可逆或不可逆的。当变性因素解除以后,蛋白质恢 复原状的变化称为复性。如果变性时二硫键等较强的键合力被破坏,往往就不能 完全复性。 在食品加工和储藏中,有控制的和适度的蛋白质变性,可能有利于发挥蛋白 质的营养属性和功能性质;强烈的变性则会破坏蛋白质的功能性质,给食品的性 状带来不利。 (一)导致蛋白质变性的物理因素 加热:热是引起蛋白质变性最普通的物理因素,热变性是最常见的变性现象, 大多数蛋白质在 45~50 ℃已可察觉到变性,55 ℃左右变性进行得较快。在这 样不太高的温度下,蛋白质热变性仅仅涉及非共价键的变化,蛋白质分子变形伸 展的这种较短时间的变性为可逆变性。但在 70~80 ℃以上,蛋白质二硫键受热 而断裂的这种蛋白质在较高温度的长时间变性是不可逆变性。变性作用的速度取 决于温度的高低,在典型的变性作用范围内,温度每上升 10 ℃,速度可增加 600 倍左右。 蛋白质对热变性作用的敏感性取决于许多因素。例如,蛋白质的性质、浓度、 水分活度、pH、离子强度和离子种类等等。蛋白质、酶和微生物在干燥条件下 耐受热变性失活的能力比含水时更大,浓蛋白液受热变性后的复性更加困难。 干燥:蛋白质大量脱水,甚至用温和方法,例如冷冻干燥法脱水,仍然可引 起某些蛋白质的变性,这是由于蛋白质的保护性水化膜脱去,蛋白质互相靠近, 分子间相互作用所致。自然风干法脱水时,氧化反应会加大变性程度;喷雾干燥 法脱水时界面作用会加大变性程度;高温脱水中又难免热变性。 低温:低温能使某些蛋白质变性,如 L-苏氨酸脱氨酶在室温下稳定,而在 零度时不稳定。大豆球蛋白、麦醇溶蛋白、鸡蛋和牛乳蛋白冷却或冷冻时会发生 凝集和沉淀。但是有些脂酶和氧化酶不仅能耐受冷冻,而且在低温下能保持活性, 这是因为某些氧化酶因冷冻而能从细胞膜中释放出来而被激活。还应提及的是某 些植物和海洋动物可耐受低温,这是因为其蛋白质中具有较大比例的疏水性氨基 酸和依赖疏水相互作用的结构,因而在低温下能控制变性。但是这类蛋白质一般 在耐寒的植物和动物中并不存在。 机械处理:在加工面包或其他类型的食品面团时,因采用机械处理,如揉捏 或滚压,会由于产生剪切力而导致蛋白质变性。反复拉伸而导致 -螺旋的破坏
白质中,二硫键对稳定蛋白质分子构象起重要的作用。 二、蛋白质的变性 当蛋白质用酸、碱、浓盐溶液、有机溶剂、热、高压、激烈振荡和辐射处理 时,会不同程度地改变其构象。这个过程称为变性。从分子结构上看,变性作用 是多肽链特有的折叠结构发生的变化,成为无规卷曲或混乱伸展的结构,它仅涉 及蛋白质二、三、四级结构的变化,而并不包括一级结构肽链的破坏。也就是说, 变性时蛋白质中氢键、盐键和疏水作用等遭受到破坏,而肽键的共价键并未打断。 变性时蛋白质的性质也发生变化:(1)由于疏水基团大量暴露在分子表面,从而 降低了蛋白质的溶解度;(2)改变了对水的结合能力;(3)由于变性后的蛋白质 分子空间结构破坏,很难保持原有的生物活性;(4)发生絮集,形成不可逆的凝 胶;(5)由于肽键暴露,特别容易受到蛋白酶的攻击,从而提高对蛋白酶水解的 敏感性;(6)黏度增加;(7)不能形成结晶等。 天然蛋白质的变性可以是可逆或不可逆的。当变性因素解除以后,蛋白质恢 复原状的变化称为复性。如果变性时二硫键等较强的键合力被破坏,往往就不能 完全复性。 在食品加工和储藏中,有控制的和适度的蛋白质变性,可能有利于发挥蛋白 质的营养属性和功能性质;强烈的变性则会破坏蛋白质的功能性质,给食品的性 状带来不利。 (一)导致蛋白质变性的物理因素 加热:热是引起蛋白质变性最普通的物理因素,热变性是最常见的变性现象, 大多数蛋白质在 45~50 ℃已可察觉到变性,55 ℃左右变性进行得较快。在这 样不太高的温度下,蛋白质热变性仅仅涉及非共价键的变化,蛋白质分子变形伸 展的这种较短时间的变性为可逆变性。但在 70~80 ℃以上,蛋白质二硫键受热 而断裂的这种蛋白质在较高温度的长时间变性是不可逆变性。变性作用的速度取 决于温度的高低,在典型的变性作用范围内,温度每上升 10 ℃,速度可增加 600 倍左右。 蛋白质对热变性作用的敏感性取决于许多因素。例如,蛋白质的性质、浓度、 水分活度、pH、离子强度和离子种类等等。蛋白质、酶和微生物在干燥条件下 耐受热变性失活的能力比含水时更大,浓蛋白液受热变性后的复性更加困难。 干燥:蛋白质大量脱水,甚至用温和方法,例如冷冻干燥法脱水,仍然可引 起某些蛋白质的变性,这是由于蛋白质的保护性水化膜脱去,蛋白质互相靠近, 分子间相互作用所致。自然风干法脱水时,氧化反应会加大变性程度;喷雾干燥 法脱水时界面作用会加大变性程度;高温脱水中又难免热变性。 低温:低温能使某些蛋白质变性,如 L-苏氨酸脱氨酶在室温下稳定,而在 零度时不稳定。大豆球蛋白、麦醇溶蛋白、鸡蛋和牛乳蛋白冷却或冷冻时会发生 凝集和沉淀。但是有些脂酶和氧化酶不仅能耐受冷冻,而且在低温下能保持活性, 这是因为某些氧化酶因冷冻而能从细胞膜中释放出来而被激活。还应提及的是某 些植物和海洋动物可耐受低温,这是因为其蛋白质中具有较大比例的疏水性氨基 酸和依赖疏水相互作用的结构,因而在低温下能控制变性。但是这类蛋白质一般 在耐寒的植物和动物中并不存在。 机械处理:在加工面包或其他类型的食品面团时,因采用机械处理,如揉捏 或滚压,会由于产生剪切力而导致蛋白质变性。反复拉伸而导致 -螺旋的破坏

将致使蛋白质网络发生变化。 液压(流体静压):液压可以产生变性效应,但低于 50 kPa 时效果不明显。 卵清蛋白和胰蛋白酶分别在 50 kPa 和 60 kPa 时才表现出变性。 辐射:辐射对蛋白质的影响因波长和能量而变化,紫外辐射可被芳香族氨基 酸残基(色氨酸、酪氨酸和苯丙氨酸)所吸收,因而导致蛋白质构象改变。如果 能量水平非常高,则二硫键也会断裂。-辐射和其他电离辐射也可以使构象发生 变化,同时使氨基酸残基氧化、共价键断裂、电离、形成蛋白质自由基和发生重 组以及聚合反应,这些反应有许多是由水的辐解作用来传递的。 界面:凡在水和空气、水和非水溶液或水和固相等界面上吸附的蛋白质分子, 一般会发生不可逆变性。由于蛋白质可作为界面活性剂,许多蛋白质倾向于向界 面迁移及被吸附,吸附速率受天然蛋白质向界面扩散速率的控制。在分散系中, 水以不同能量水平存在:(1)远离界面的那些水分子处于低能态,它们不仅同其 他水分子,而且同蛋白质的离子和极性部位相互作用,(2)靠近界面的水分子处 于高能态,它们主要与其他水分子相互作用。蛋白质向界面扩散过程中,蛋白质 可能同高能量的水分子相互作用,许多蛋白质一蛋白质氢键可能同时遭到破坏, 并且发生结构的“微伸展”,因而许多疏水基团和水相接触,使部分伸展的蛋白 质更加不稳定,最后蛋白质在界面进一步伸展和扩展,亲水和疏水残基力图分别 在水溶液和非水相中取向,导致被吸附在界面上的蛋白质发生变性。 蛋白质在界面上的性质在各种食品体系中都是很重要的,如吸附在界面上的 蛋白质有助于乳浊液和泡沫的形成和稳定。但若欲保持蛋白质的天然构象和功能 性质,在加工或分离中应避免产生如泡沫或乳状液这样的分散系。 (二)导致蛋白质变性的化学因素 酸和碱:蛋白质所处介质的 pH 对变性过程有很大影响,大多数蛋白质在一 定 pH 范围内是稳定的,若与十分高或低的 pH 介质接触,则一般会发生变性。 因为在极端 pH 时,分子内离子基团会产生强烈的静电排斥,这将促使蛋白质分 子伸展(变性)。然而,在某些情况下,当 pH 调节到最初稳定范围时,蛋白质 可以恢复原有的结构。 金属:碱金属如 Na+和 K+仅有限度地与蛋白质起反应,而碱土金属如 Ca2+、 Mg2+则稍为活泼。过渡金属如 Cu2+、Fe2+、Hg2+和 Ag+等离子容易同蛋白质起作 用,能与其中的巯基形成稳定的络合物。Ca2+、Fe2+、Cu2+和 Mg2+可以成为某些 蛋白质分子中的一个组成部分。当用透析法或螯合剂将这些金属离子从蛋白质中 除出时,会明显降低蛋白质结构对热和蛋白酶作用的稳定性。 有机溶剂:大多数有机溶剂可用作蛋白质变性剂,除了降低溶剂(水)与蛋 白质的作用外,它们能改变介质的介电常数,从而改变了有助于蛋白质稳定的静 电作用力,非极性有机溶剂能够渗入疏水区,破坏疏水相互作用,因而促使蛋白 质变性。这类溶剂的变性作用也可能是它们同水彼此间产生的相互作用而引起 的。2-氯乙醇能使 -螺旋构象占优势,这种作用也可认为是一种变性,例如卵 清蛋白在水溶液介质中有 31%的 -螺旋,而在 2-氯乙醇中为 85%。 有机化合物:脲素或胍盐当配制成高浓度(4~8 mol/L)水溶液时,会导致 氢键的断裂,并引起蛋白质不同程度的变性。这些化合物还通过增加疏水氨基酸 残基在水溶液中的溶解度而降低疏水的相互作用。表面活性剂如十二烷基硫酸钠 也是很强的变性剂,这类化合物在蛋白质疏水区和亲水环境之间起着媒介作用。 因此,它们除能破坏疏水相互作用外,还有利于天然蛋白质的伸展。还原剂(半 胱氨酸、抗坏血酸、-巯基乙醇、二硫苏糖醇)可使二硫键还原,因而改变蛋白
将致使蛋白质网络发生变化。 液压(流体静压):液压可以产生变性效应,但低于 50 kPa 时效果不明显。 卵清蛋白和胰蛋白酶分别在 50 kPa 和 60 kPa 时才表现出变性。 辐射:辐射对蛋白质的影响因波长和能量而变化,紫外辐射可被芳香族氨基 酸残基(色氨酸、酪氨酸和苯丙氨酸)所吸收,因而导致蛋白质构象改变。如果 能量水平非常高,则二硫键也会断裂。-辐射和其他电离辐射也可以使构象发生 变化,同时使氨基酸残基氧化、共价键断裂、电离、形成蛋白质自由基和发生重 组以及聚合反应,这些反应有许多是由水的辐解作用来传递的。 界面:凡在水和空气、水和非水溶液或水和固相等界面上吸附的蛋白质分子, 一般会发生不可逆变性。由于蛋白质可作为界面活性剂,许多蛋白质倾向于向界 面迁移及被吸附,吸附速率受天然蛋白质向界面扩散速率的控制。在分散系中, 水以不同能量水平存在:(1)远离界面的那些水分子处于低能态,它们不仅同其 他水分子,而且同蛋白质的离子和极性部位相互作用,(2)靠近界面的水分子处 于高能态,它们主要与其他水分子相互作用。蛋白质向界面扩散过程中,蛋白质 可能同高能量的水分子相互作用,许多蛋白质一蛋白质氢键可能同时遭到破坏, 并且发生结构的“微伸展”,因而许多疏水基团和水相接触,使部分伸展的蛋白 质更加不稳定,最后蛋白质在界面进一步伸展和扩展,亲水和疏水残基力图分别 在水溶液和非水相中取向,导致被吸附在界面上的蛋白质发生变性。 蛋白质在界面上的性质在各种食品体系中都是很重要的,如吸附在界面上的 蛋白质有助于乳浊液和泡沫的形成和稳定。但若欲保持蛋白质的天然构象和功能 性质,在加工或分离中应避免产生如泡沫或乳状液这样的分散系。 (二)导致蛋白质变性的化学因素 酸和碱:蛋白质所处介质的 pH 对变性过程有很大影响,大多数蛋白质在一 定 pH 范围内是稳定的,若与十分高或低的 pH 介质接触,则一般会发生变性。 因为在极端 pH 时,分子内离子基团会产生强烈的静电排斥,这将促使蛋白质分 子伸展(变性)。然而,在某些情况下,当 pH 调节到最初稳定范围时,蛋白质 可以恢复原有的结构。 金属:碱金属如 Na+和 K+仅有限度地与蛋白质起反应,而碱土金属如 Ca2+、 Mg2+则稍为活泼。过渡金属如 Cu2+、Fe2+、Hg2+和 Ag+等离子容易同蛋白质起作 用,能与其中的巯基形成稳定的络合物。Ca2+、Fe2+、Cu2+和 Mg2+可以成为某些 蛋白质分子中的一个组成部分。当用透析法或螯合剂将这些金属离子从蛋白质中 除出时,会明显降低蛋白质结构对热和蛋白酶作用的稳定性。 有机溶剂:大多数有机溶剂可用作蛋白质变性剂,除了降低溶剂(水)与蛋 白质的作用外,它们能改变介质的介电常数,从而改变了有助于蛋白质稳定的静 电作用力,非极性有机溶剂能够渗入疏水区,破坏疏水相互作用,因而促使蛋白 质变性。这类溶剂的变性作用也可能是它们同水彼此间产生的相互作用而引起 的。2-氯乙醇能使 -螺旋构象占优势,这种作用也可认为是一种变性,例如卵 清蛋白在水溶液介质中有 31%的 -螺旋,而在 2-氯乙醇中为 85%。 有机化合物:脲素或胍盐当配制成高浓度(4~8 mol/L)水溶液时,会导致 氢键的断裂,并引起蛋白质不同程度的变性。这些化合物还通过增加疏水氨基酸 残基在水溶液中的溶解度而降低疏水的相互作用。表面活性剂如十二烷基硫酸钠 也是很强的变性剂,这类化合物在蛋白质疏水区和亲水环境之间起着媒介作用。 因此,它们除能破坏疏水相互作用外,还有利于天然蛋白质的伸展。还原剂(半 胱氨酸、抗坏血酸、-巯基乙醇、二硫苏糖醇)可使二硫键还原,因而改变蛋白

质的构象。 三、食品蛋白质的功能性质 食品蛋白质的功能性质是指蛋白质对食品产生必要特征的那些物理、化学性 质。食品蛋白质的功能性质分为三大类:(1)水合性质,包括水的吸收和保持、 湿润性、溶胀性、黏附性、分散性、溶解度和黏度等,这一类性质主要取决于蛋 白质−水的相互作用;(2)蛋白质−蛋白质相互作用的有关性质,包括沉淀、胶凝 和形成其他各种结构时起作用的性质;(3)表面性质,包括蛋白质的表面张力、 乳化作用和蛋白质的发泡性等。这些性质之间不是绝然分开的,是互相关联的。 例如,黏度和溶解度取决于蛋白质−水和蛋白质−蛋白质的相互作用;凝胶作用不 仅包括蛋白质−蛋白质相互作用,而且还有蛋白质−水相互作用。 (一)水合性质 蛋白质在溶液中的构象主要取决于它和水之间的相互作用。大多数食品是水 合固态体系。食品中的蛋白质和其他成分的物理化学及流变学性质,不仅受到体 系中水的强烈影响,而且还受到水活性的影响。 蛋白质从干燥状态开始逐渐水合涉及 5 个步骤(图 1-5): 图 1-5 干蛋白质的蛋白质-水相互作用步骤 蛋白质制品的许多功能性与水合作用有关。例如水吸收作用(也叫水摄取、 亲和性或结合性)、溶胀、润湿性、持水容量(或水保留作用),以及黏附和内聚 力都与水合作用的前 4 个步骤有关;分散性和黏度(或增稠力)涉及第 5 个步骤; 蛋白质的最终状态,可溶性或不溶性(部分或全部)也与功能性质(例如溶解性 或速溶性)有关。胶凝作用是指充分水合的不溶性块状物的形成,而且要求产生 特殊的蛋白质-蛋白质相互作用;与表面性质有关的功能性,例如乳化作用和发 泡性,蛋白质还必须是高度水合和分散的。 蛋白质的水合性质是食品化学上的重要性质。例如当向肉制品、面包或干酪 等食品中添加大豆蛋白时,蛋白质的吸水性便成为一个重要因素。即使加热也能 保持水分,这对肉制品来说是至关重要的,因为只有保持肉汁,肉制品才能有良 好的口感和风味。 1.影响蛋白质水合性质的因素 (1)浓度 水的总吸收率随蛋白质浓度的增大而增加。 (2)pH pH 的变化影响蛋白质分子的解离和净电荷量,因而可影响蛋白质 −蛋白质、蛋白质水相互作用力。在等电点 pH 时,蛋白质蛋白质相互作用最强, 蛋白质的水合作用和溶胀最小。例如宰后僵直前的生牛肉(或牛肉匀浆)pH 从 6.5 下降至近 5.0(等电点),其持水容量显著减小(图 1-6),并导致肉的汁液减 少和嫩度降低。 干蛋 白质 ① 通过极性位点 结合吸附水分子 ② 多分子层 水吸附 ③ 液体水 凝聚 ④ 溶胀 溶剂化 分散作用 ⑤ 溶胀的不溶性 颗粒或块状物 溶液
质的构象。 三、食品蛋白质的功能性质 食品蛋白质的功能性质是指蛋白质对食品产生必要特征的那些物理、化学性 质。食品蛋白质的功能性质分为三大类:(1)水合性质,包括水的吸收和保持、 湿润性、溶胀性、黏附性、分散性、溶解度和黏度等,这一类性质主要取决于蛋 白质−水的相互作用;(2)蛋白质−蛋白质相互作用的有关性质,包括沉淀、胶凝 和形成其他各种结构时起作用的性质;(3)表面性质,包括蛋白质的表面张力、 乳化作用和蛋白质的发泡性等。这些性质之间不是绝然分开的,是互相关联的。 例如,黏度和溶解度取决于蛋白质−水和蛋白质−蛋白质的相互作用;凝胶作用不 仅包括蛋白质−蛋白质相互作用,而且还有蛋白质−水相互作用。 (一)水合性质 蛋白质在溶液中的构象主要取决于它和水之间的相互作用。大多数食品是水 合固态体系。食品中的蛋白质和其他成分的物理化学及流变学性质,不仅受到体 系中水的强烈影响,而且还受到水活性的影响。 蛋白质从干燥状态开始逐渐水合涉及 5 个步骤(图 1-5): 图 1-5 干蛋白质的蛋白质-水相互作用步骤 蛋白质制品的许多功能性与水合作用有关。例如水吸收作用(也叫水摄取、 亲和性或结合性)、溶胀、润湿性、持水容量(或水保留作用),以及黏附和内聚 力都与水合作用的前 4 个步骤有关;分散性和黏度(或增稠力)涉及第 5 个步骤; 蛋白质的最终状态,可溶性或不溶性(部分或全部)也与功能性质(例如溶解性 或速溶性)有关。胶凝作用是指充分水合的不溶性块状物的形成,而且要求产生 特殊的蛋白质-蛋白质相互作用;与表面性质有关的功能性,例如乳化作用和发 泡性,蛋白质还必须是高度水合和分散的。 蛋白质的水合性质是食品化学上的重要性质。例如当向肉制品、面包或干酪 等食品中添加大豆蛋白时,蛋白质的吸水性便成为一个重要因素。即使加热也能 保持水分,这对肉制品来说是至关重要的,因为只有保持肉汁,肉制品才能有良 好的口感和风味。 1.影响蛋白质水合性质的因素 (1)浓度 水的总吸收率随蛋白质浓度的增大而增加。 (2)pH pH 的变化影响蛋白质分子的解离和净电荷量,因而可影响蛋白质 −蛋白质、蛋白质水相互作用力。在等电点 pH 时,蛋白质蛋白质相互作用最强, 蛋白质的水合作用和溶胀最小。例如宰后僵直前的生牛肉(或牛肉匀浆)pH 从 6.5 下降至近 5.0(等电点),其持水容量显著减小(图 1-6),并导致肉的汁液减 少和嫩度降低。 干蛋 白质 ① 通过极性位点 结合吸附水分子 ② 多分子层 水吸附 ③ 液体水 凝聚 ④ 溶胀 溶剂化 分散作用 ⑤ 溶胀的不溶性 颗粒或块状物 溶液

图 1-6 pH 对牛肌肉持水容量的影响 (3)温度 蛋白质结合水的能力一般随温度升高而降低,这是因为降低了 氢键的缔合,同时蛋白质加热时发生变性和聚集,导致减少蛋白质的表面积和降 低极性侧链对水结合的有效性。但另一方面,结构很紧密的蛋白质在加热时,由 于发生解离和伸展,使原来被掩蔽的肽键和极性侧链暴露在表面,从而提高了极 性侧链结合水的能力。例如乳清蛋白质加热时,可发生不可逆胶凝,如果将凝胶 干燥,可增加不溶性蛋白质网络内的毛细管作用,因而使蛋白质的吸水能力显著 增强。 2.蛋白质的吸水性和持水容量的测定方法 (1)相对湿度法 测定一定水活性(Aw)时所吸收的水量。这种方法用于 评价蛋白粉的吸湿性和结块现象。 (2)溶胀法 将蛋白质粉末置于下端连有刻度毛细管的烧结玻璃过滤器上, 让其自发地吸收毛细管中的水,即可测定水合作用的速度和程度。 (3)过量水法 蛋白质试样同超过蛋白质所能结合的水接触,然后通过过 滤、低速离心或挤压等方法使过剩水与蛋白质分离。此法仅适用于溶解度低的蛋 白质。 (4)水饱和法 测定蛋白质饱和溶液所需要的水量。 后 3 种方法可用来测定结合水、不可冻结的水,以及蛋白质分子间借助于物 理作用保持的毛细管水。 (二)溶解度 蛋白质的溶解度是蛋白质的固定性质之一,它随 pH、离子强度、温度和蛋 白质浓度等因素的不同而改变。但水溶性蛋白质是否能够维持其水溶性,对决定 其以后的实用价值是重要的。如果经加热或其他处理后蛋白质的水溶性降低,则 其胶凝性、乳化性、发泡性等其他许多功能性质也会下降。因此,溶解度也是评 价蛋白质饮料的一个主要特征。 蛋白质在中性或等电点 pH 时的溶解性,通常是在制备和加工一种蛋白质过 程中必须首先测定的功能性质。这一试验的目的是测定氮溶解指数(NSI)和找 出溶解度与 pH、离子强度或热处理的关系。 大多数蛋白质在加热时,溶解度会明显地不可逆降低。在通常情况下,为了 使蛋白质溶解,可通过碱处理促进其离解,还可使用半胱氨酸、巯基乙醇、乙醇 等切断二硫键的试剂,这些方法都是有效的。大豆蛋白质受 pH、离子强度的影 响较大,当 pH 为 7~10 时,随着离子强度增加,溶解度降低;但当 pH 为 4~5 时,添加食盐后可提高溶解度。特别是当蛋白质呈酸性时,这类盐类可促使阴离 子与蛋白质的阳离子结合,使溶解度增加。 在制作蛋白质饮料时,有必要考虑使溶液透明、黏度低。因此,pH、离子强
图 1-6 pH 对牛肌肉持水容量的影响 (3)温度 蛋白质结合水的能力一般随温度升高而降低,这是因为降低了 氢键的缔合,同时蛋白质加热时发生变性和聚集,导致减少蛋白质的表面积和降 低极性侧链对水结合的有效性。但另一方面,结构很紧密的蛋白质在加热时,由 于发生解离和伸展,使原来被掩蔽的肽键和极性侧链暴露在表面,从而提高了极 性侧链结合水的能力。例如乳清蛋白质加热时,可发生不可逆胶凝,如果将凝胶 干燥,可增加不溶性蛋白质网络内的毛细管作用,因而使蛋白质的吸水能力显著 增强。 2.蛋白质的吸水性和持水容量的测定方法 (1)相对湿度法 测定一定水活性(Aw)时所吸收的水量。这种方法用于 评价蛋白粉的吸湿性和结块现象。 (2)溶胀法 将蛋白质粉末置于下端连有刻度毛细管的烧结玻璃过滤器上, 让其自发地吸收毛细管中的水,即可测定水合作用的速度和程度。 (3)过量水法 蛋白质试样同超过蛋白质所能结合的水接触,然后通过过 滤、低速离心或挤压等方法使过剩水与蛋白质分离。此法仅适用于溶解度低的蛋 白质。 (4)水饱和法 测定蛋白质饱和溶液所需要的水量。 后 3 种方法可用来测定结合水、不可冻结的水,以及蛋白质分子间借助于物 理作用保持的毛细管水。 (二)溶解度 蛋白质的溶解度是蛋白质的固定性质之一,它随 pH、离子强度、温度和蛋 白质浓度等因素的不同而改变。但水溶性蛋白质是否能够维持其水溶性,对决定 其以后的实用价值是重要的。如果经加热或其他处理后蛋白质的水溶性降低,则 其胶凝性、乳化性、发泡性等其他许多功能性质也会下降。因此,溶解度也是评 价蛋白质饮料的一个主要特征。 蛋白质在中性或等电点 pH 时的溶解性,通常是在制备和加工一种蛋白质过 程中必须首先测定的功能性质。这一试验的目的是测定氮溶解指数(NSI)和找 出溶解度与 pH、离子强度或热处理的关系。 大多数蛋白质在加热时,溶解度会明显地不可逆降低。在通常情况下,为了 使蛋白质溶解,可通过碱处理促进其离解,还可使用半胱氨酸、巯基乙醇、乙醇 等切断二硫键的试剂,这些方法都是有效的。大豆蛋白质受 pH、离子强度的影 响较大,当 pH 为 7~10 时,随着离子强度增加,溶解度降低;但当 pH 为 4~5 时,添加食盐后可提高溶解度。特别是当蛋白质呈酸性时,这类盐类可促使阴离 子与蛋白质的阳离子结合,使溶解度增加。 在制作蛋白质饮料时,有必要考虑使溶液透明、黏度低。因此,pH、离子强

度及温度必须在较大范围内保持稳定。同时还应考虑到该饮料能以溶液状态或浓 缩状态、粉末状态进行贮存。另外,碳酸饮料必须在酸性状态下溶解。类似这类 溶解度与应用直接有关的例子很多。 (三)黏度 流体的黏度反映它对流动的阻力,用黏度系数μ表示。包括蛋白质在内的大 多数亲水性大分子的溶液中分散体(匀浆或悬浮体)、乳浊液、糊状物或凝胶, 都不符合牛顿流体的特性,其黏度系数随剪切速度的增加而降低。 蛋白质分子的体积很大,而且由于水化作用而使蛋白质分子表面带有水化 层,更增大了分子的体积,使得蛋白质溶液的流动阻力很大,其黏度要比一般小 分子溶液大得多。 影响蛋白质流体黏度特性的主要因素如下: 1.浓度 由于蛋白质-蛋白质的相互作用,大多数蛋白质流体的黏度系数随 蛋白质浓度的增加呈现指数增加。 2.蛋白质分子的形状和表面状况 球形分子蛋白质溶液的黏度,一般低于 纤维分子蛋白质溶液的黏度。如果蛋白质分子带有电荷,会增加蛋白质分子表面 水化层的厚度,则溶液的黏度变得更大。 在给定的溶液中,蛋白质并不总是具有相同的黏度。在测定黏度之前,蛋白 质所经历的不同抽提、纯化过程,将影响蛋白质分子结构,从而会导致黏度的差 异。 蛋白质溶液的黏度是液态、酱状食品(例如饮料、肉汤、汤汁、沙司和稀奶 油等)的主要功能性质,了解蛋白质分散体的流体性质对于确定最佳食品加工工 艺具有实际意义。例如泵传送、混合、加热、冷却和喷雾干燥等,都包括质和热 的传递。 (四)凝胶作用 所谓胶凝作用是指蛋白质分子聚集并形成有序的蛋白质网络结构的过程。 蛋白质的胶凝作用与蛋白质溶液分散程序的降低(如缔合、聚集、聚合、沉 淀、絮凝和凝结等)不同。蛋白质的缔合一般是指亚单位或分子水平发生的变化; 聚集或聚合一般包括大的复合物的形成;沉淀是指由于溶解性完全或部分失去而 导致的聚集反应;絮凝是指不发生变性的无规则聚集反应;凝结是指将发生变性 的无规则聚集反应和蛋白质−蛋白质的相互作用大于蛋白质−溶剂的相互作用引 起的聚集反应。 迄今为止,对蛋白质凝胶的立体网络形成机制还不十分清楚。一般认为蛋白 质网络的形成是蛋白质-蛋白质和蛋白质-溶剂(水)的相互作用,以及邻近的肽 链之间的吸引力和排斥力平衡的结果。在蛋白质的胶凝作用中,疏水相互作用、 静电相互作用(如与 Ca2+或其他二价离子桥接)、氢键键合和二硫键的相对贡献, 随蛋白质本身所具有的性质、浓度、环境条件等不同而异。 通常热处理是蛋白质产生胶凝作用必不可少的,因为加热增强了疏水作用, 同时还可以使内部的巯基暴露,促进二硫键的形成或交换,使分子间的网络得到 加强。但有些蛋白质不经过加热也可以发生胶凝,仅需适度酶水解(如酪蛋白胶 束、卵白和血纤维蛋白)即可。或者添加钙离子(钙离子形成桥键,如酪蛋白胶 束)。也可以先碱化,然后恢复到中性或等电点 pH(如大豆蛋白),使蛋白质发 生胶凝作用。因此可以估计在有序的蛋白质−蛋白质相互作用导致聚集之前,蛋 白质必定发生了变性和伸展。变性和伸展使反应基团更易暴露,特别是球蛋白的 疏水基团,有利于蛋白质−蛋白质的疏水相互作用,所以相对分子质量大和疏水
度及温度必须在较大范围内保持稳定。同时还应考虑到该饮料能以溶液状态或浓 缩状态、粉末状态进行贮存。另外,碳酸饮料必须在酸性状态下溶解。类似这类 溶解度与应用直接有关的例子很多。 (三)黏度 流体的黏度反映它对流动的阻力,用黏度系数μ表示。包括蛋白质在内的大 多数亲水性大分子的溶液中分散体(匀浆或悬浮体)、乳浊液、糊状物或凝胶, 都不符合牛顿流体的特性,其黏度系数随剪切速度的增加而降低。 蛋白质分子的体积很大,而且由于水化作用而使蛋白质分子表面带有水化 层,更增大了分子的体积,使得蛋白质溶液的流动阻力很大,其黏度要比一般小 分子溶液大得多。 影响蛋白质流体黏度特性的主要因素如下: 1.浓度 由于蛋白质-蛋白质的相互作用,大多数蛋白质流体的黏度系数随 蛋白质浓度的增加呈现指数增加。 2.蛋白质分子的形状和表面状况 球形分子蛋白质溶液的黏度,一般低于 纤维分子蛋白质溶液的黏度。如果蛋白质分子带有电荷,会增加蛋白质分子表面 水化层的厚度,则溶液的黏度变得更大。 在给定的溶液中,蛋白质并不总是具有相同的黏度。在测定黏度之前,蛋白 质所经历的不同抽提、纯化过程,将影响蛋白质分子结构,从而会导致黏度的差 异。 蛋白质溶液的黏度是液态、酱状食品(例如饮料、肉汤、汤汁、沙司和稀奶 油等)的主要功能性质,了解蛋白质分散体的流体性质对于确定最佳食品加工工 艺具有实际意义。例如泵传送、混合、加热、冷却和喷雾干燥等,都包括质和热 的传递。 (四)凝胶作用 所谓胶凝作用是指蛋白质分子聚集并形成有序的蛋白质网络结构的过程。 蛋白质的胶凝作用与蛋白质溶液分散程序的降低(如缔合、聚集、聚合、沉 淀、絮凝和凝结等)不同。蛋白质的缔合一般是指亚单位或分子水平发生的变化; 聚集或聚合一般包括大的复合物的形成;沉淀是指由于溶解性完全或部分失去而 导致的聚集反应;絮凝是指不发生变性的无规则聚集反应;凝结是指将发生变性 的无规则聚集反应和蛋白质−蛋白质的相互作用大于蛋白质−溶剂的相互作用引 起的聚集反应。 迄今为止,对蛋白质凝胶的立体网络形成机制还不十分清楚。一般认为蛋白 质网络的形成是蛋白质-蛋白质和蛋白质-溶剂(水)的相互作用,以及邻近的肽 链之间的吸引力和排斥力平衡的结果。在蛋白质的胶凝作用中,疏水相互作用、 静电相互作用(如与 Ca2+或其他二价离子桥接)、氢键键合和二硫键的相对贡献, 随蛋白质本身所具有的性质、浓度、环境条件等不同而异。 通常热处理是蛋白质产生胶凝作用必不可少的,因为加热增强了疏水作用, 同时还可以使内部的巯基暴露,促进二硫键的形成或交换,使分子间的网络得到 加强。但有些蛋白质不经过加热也可以发生胶凝,仅需适度酶水解(如酪蛋白胶 束、卵白和血纤维蛋白)即可。或者添加钙离子(钙离子形成桥键,如酪蛋白胶 束)。也可以先碱化,然后恢复到中性或等电点 pH(如大豆蛋白),使蛋白质发 生胶凝作用。因此可以估计在有序的蛋白质−蛋白质相互作用导致聚集之前,蛋 白质必定发生了变性和伸展。变性和伸展使反应基团更易暴露,特别是球蛋白的 疏水基团,有利于蛋白质−蛋白质的疏水相互作用,所以相对分子质量大和疏水

氨基酸含量高的蛋白质容易形成稳定的网络结构。 二硫键的形成通常生成不可逆凝胶(如卵清蛋白和β-乳球蛋白凝胶)。当蛋 白质浓度高时,通常更容易产生胶凝作用,因为更容易产生蛋白质分子间的吸引 力。有时甚至在对胶凝不利的条件下(如不加热、pH 偏离等电点 pH 很大),仍 然可以发生胶凝,因为高浓度蛋白质中的许多疏水键和二硫键,能补偿因 pH 与 蛋白质等电点相差很大时由于大量净电荷所产生的静电排斥力。 将某些不同种类的蛋白质放在一起加热,可产生共胶凝作用形成凝胶。此外, 蛋白质还能通过和多糖胶凝剂相互作用形成凝胶。带正电荷的明胶和带负电荷的 褐藻酸盐或果胶酸盐之间通过非特异离子相互作用,可形成高熔点(80 ℃)凝 胶。 胶凝作用是某些蛋白质的一种十分重要的性质,在许多食品的制备中起着主 要作用。如各种乳品、凝结蛋白、明胶凝胶、各种加热的碎肉或鱼制品、大豆蛋 白质凝胶、膨化或喷丝的组织化植物蛋白和面包面团的制作等。蛋白质胶凝作用 不仅可用来形成固态黏弹性凝胶,而且还能增稠,提高吸水性和颗粒黏结、乳浊 剂或泡沫的稳定性。 (五)乳化性质 牛奶、乳脂、冰淇淋、黄油、干酪、蛋黄酱和肉馅等食品均属于乳胶体。蛋 白质成分在稳定这些胶态体系中通常起着重要的作用。可溶性蛋白质乳化作用最 重要的特征是其向油/水界面扩散和在界面吸附的能力。一般认为蛋白质的一部 分一旦与界面接触,非极性氨基酸残基则朝向非水相,于是体系的自由能降低, 蛋白质的其余部分自动在界面上被吸附。蛋白质的疏水性愈大,界面的蛋白质浓 度也愈大,使界面张力更小,乳浊液更稳定。但是蛋白质的总疏水性(按亲水和 疏水氨基酸残基的体积比或平均疏水性确定)与乳化性质不密切相关。根据疏水 亲和色谱、疏水分配或用疏水性试剂测定的结果,增加蛋白质的表面疏水性与降 低界面张力和增大乳化作用指数,均存在明显的相关性。 蛋白质在乳化性质中所起的作用是:它依靠降低界面张力促进乳浊液的形 成,并依靠界面形成物理势垒维持乳浊液的稳定。 蛋白质一般对水/油(W/O)型乳浊液的稳定性较差,这是因为大多数蛋白质 的强亲水性使大量被吸附的蛋白质分子位于界面的水相一侧。 1.影响蛋白质乳化性质的主要因素 (1)溶解度 蛋白质溶解度和乳化容量或乳浊液稳定性之间通常存在正相 关。因为蛋白质在出现表面性质之前必须溶解,并向界面扩散。不溶性蛋白质对 乳化作用的贡献很小。在肉馅胶体中(pH 4~8)有氯化钠(0.5~1 mol/L)存在 时,可提高蛋白质的乳化容量,这是因为肌原纤维蛋白质发生盐溶,其结果导致溶 解度和分子的伸展性都增大。但不溶性蛋白质颗粒通常在已经形成的乳浊液中起 稳定作用。 (2)pH pH 能影响蛋白质的乳化性质。某些蛋白质在等电点 pH 时仅能微 溶,因而降低乳化能力。此外在等电点或一定离子强度时,由于蛋白质以高黏弹 性紧密结构形式存在,故可防止蛋白质伸展或在界面吸附,不利于乳浊的形成, 或者可以稳定已吸附的蛋白质膜,有利于乳浊液保持稳定。 (3)加热 加热通常可降低被界面吸附的蛋白质膜的黏度和刚性,使乳浊 液稳定性降低。但是高度水合的界面蛋白质膜的胶凝作用可以提高表面的黏度和 刚性,结果使乳浊液保持稳定。因此肌原纤维蛋白的胶凝作用有助于肉类乳胶体 的热稳定性,以提高这类食品对水和脂肪的保持力和黏结性
氨基酸含量高的蛋白质容易形成稳定的网络结构。 二硫键的形成通常生成不可逆凝胶(如卵清蛋白和β-乳球蛋白凝胶)。当蛋 白质浓度高时,通常更容易产生胶凝作用,因为更容易产生蛋白质分子间的吸引 力。有时甚至在对胶凝不利的条件下(如不加热、pH 偏离等电点 pH 很大),仍 然可以发生胶凝,因为高浓度蛋白质中的许多疏水键和二硫键,能补偿因 pH 与 蛋白质等电点相差很大时由于大量净电荷所产生的静电排斥力。 将某些不同种类的蛋白质放在一起加热,可产生共胶凝作用形成凝胶。此外, 蛋白质还能通过和多糖胶凝剂相互作用形成凝胶。带正电荷的明胶和带负电荷的 褐藻酸盐或果胶酸盐之间通过非特异离子相互作用,可形成高熔点(80 ℃)凝 胶。 胶凝作用是某些蛋白质的一种十分重要的性质,在许多食品的制备中起着主 要作用。如各种乳品、凝结蛋白、明胶凝胶、各种加热的碎肉或鱼制品、大豆蛋 白质凝胶、膨化或喷丝的组织化植物蛋白和面包面团的制作等。蛋白质胶凝作用 不仅可用来形成固态黏弹性凝胶,而且还能增稠,提高吸水性和颗粒黏结、乳浊 剂或泡沫的稳定性。 (五)乳化性质 牛奶、乳脂、冰淇淋、黄油、干酪、蛋黄酱和肉馅等食品均属于乳胶体。蛋 白质成分在稳定这些胶态体系中通常起着重要的作用。可溶性蛋白质乳化作用最 重要的特征是其向油/水界面扩散和在界面吸附的能力。一般认为蛋白质的一部 分一旦与界面接触,非极性氨基酸残基则朝向非水相,于是体系的自由能降低, 蛋白质的其余部分自动在界面上被吸附。蛋白质的疏水性愈大,界面的蛋白质浓 度也愈大,使界面张力更小,乳浊液更稳定。但是蛋白质的总疏水性(按亲水和 疏水氨基酸残基的体积比或平均疏水性确定)与乳化性质不密切相关。根据疏水 亲和色谱、疏水分配或用疏水性试剂测定的结果,增加蛋白质的表面疏水性与降 低界面张力和增大乳化作用指数,均存在明显的相关性。 蛋白质在乳化性质中所起的作用是:它依靠降低界面张力促进乳浊液的形 成,并依靠界面形成物理势垒维持乳浊液的稳定。 蛋白质一般对水/油(W/O)型乳浊液的稳定性较差,这是因为大多数蛋白质 的强亲水性使大量被吸附的蛋白质分子位于界面的水相一侧。 1.影响蛋白质乳化性质的主要因素 (1)溶解度 蛋白质溶解度和乳化容量或乳浊液稳定性之间通常存在正相 关。因为蛋白质在出现表面性质之前必须溶解,并向界面扩散。不溶性蛋白质对 乳化作用的贡献很小。在肉馅胶体中(pH 4~8)有氯化钠(0.5~1 mol/L)存在 时,可提高蛋白质的乳化容量,这是因为肌原纤维蛋白质发生盐溶,其结果导致溶 解度和分子的伸展性都增大。但不溶性蛋白质颗粒通常在已经形成的乳浊液中起 稳定作用。 (2)pH pH 能影响蛋白质的乳化性质。某些蛋白质在等电点 pH 时仅能微 溶,因而降低乳化能力。此外在等电点或一定离子强度时,由于蛋白质以高黏弹 性紧密结构形式存在,故可防止蛋白质伸展或在界面吸附,不利于乳浊的形成, 或者可以稳定已吸附的蛋白质膜,有利于乳浊液保持稳定。 (3)加热 加热通常可降低被界面吸附的蛋白质膜的黏度和刚性,使乳浊 液稳定性降低。但是高度水合的界面蛋白质膜的胶凝作用可以提高表面的黏度和 刚性,结果使乳浊液保持稳定。因此肌原纤维蛋白的胶凝作用有助于肉类乳胶体 的热稳定性,以提高这类食品对水和脂肪的保持力和黏结性

(4)小分子表面活性剂 这类物质的添加能降低蛋白质膜的刚性,使蛋白 质保留在界面的能力减弱,因而通常不利于依靠蛋白质得以稳定的乳浊液。 2.测定蛋白质乳化性质的方法 (1)乳化容量(EC) 所谓乳化容量是指乳浊液在发生相转变之前,1 g 蛋白质能够乳化油的体积(ml)。蛋白质水溶液在搅拌下以恒定速度不断地加入 油或熔化脂肪,当黏度突然降低或者电阻增大时,即可察觉出相转变,从而得出 其乳化容量。蛋白质的乳化容量随蛋白质浓度增大而降低。 (2)乳浊液稳定性(ES) ES= 100 最初乳浊液体积 最终乳浊液体积 预先加热(或不加热)的乳浊液,经低速离心(或放置)几小时后,乳浊液 被破坏会出现水和油层分离的现象,当油滴向上移动形成密集的填充层时,乳浊 液常常出现分层(不聚结),同时水相向下移动在底部形成水层。 (六)发泡性 食品泡沫通常是气泡在连续的液相或含可溶性表面活性剂的半固相中形成 的分散体。大多数情况下,气体是空气或二氧化碳,连续相是含蛋白质的水溶液 或悬浊液。泡沫中的薄液层连续相使气泡分散,通常用表面活性剂以保持界面防 止气泡聚集,因为表面活性剂能够降低界面张力,并且在气泡之间形成有弹性的 保护层。各种泡沫的气泡大小很不相同,直径大小可从 m 级到 cm 级不等。气 泡的大小取决于液相的表面张力、黏度、输入的能量等。所以泡沫是由可溶性蛋 白质向空气/水界面扩散、伸展、浓集和快速扩展、降低界面张力而形成的。泡 沫的稳定性取决于气泡是否具有一层黏结、富有弹性而不透气的蛋白质膜。分布 均匀的细微气泡可以使食品具有稠性及细腻和松软的口感,提高分散性和风味 感。 具有良好发泡性质的蛋白质有卵清蛋白、血红蛋白中的球蛋白部分、牛血清 蛋白、明胶、乳清蛋白、酪蛋白胶束、β-酪蛋白、小麦蛋白(特别是麦谷蛋白)、 大豆蛋白和某些蛋白质的低度水解产物。 1.产生泡沫的方法 (1)鼓泡法 气体经过多孔分配器(例如烧结玻璃)通入低浓度的(0.01 ~ 2.0 g/100mL)蛋白质水溶液中,产生泡沫,一般可膨胀 10 倍,在某些情况下可 达到 100 倍。 (2)搅打(搅拌)振摇法 这种方法是大多数食品充气最常用的方法。由 于搅打产生更强的机械应力和剪切作用,故可使气体分散得更均匀。但是更剧烈 的机械应力会影响气泡的聚集和形成,阻碍蛋白质在界面的吸附,因而会增加对 蛋白质的需要量(1~40 g/100mL)。 (3)突然解除预先加于溶液的压力。 2.发泡性的评价 蛋白质的发泡性可以通过气泡的平均大小、发泡率、发泡能力等加以评价。 (1)发泡率的表示方法 发泡率一般可以用以下几种方法表示: “稳态”泡沫体积:100×泡沫体积/液相最初体积; 膨胀量:100×(分散体总体积 − 流体最初体积)/ 流体最初体积; 发泡能力:100×泡沫中气体的体积 / 泡沫中液体的体积; 泡沫中气体与鼓泡气体的体积比; 泡沫密度
(4)小分子表面活性剂 这类物质的添加能降低蛋白质膜的刚性,使蛋白 质保留在界面的能力减弱,因而通常不利于依靠蛋白质得以稳定的乳浊液。 2.测定蛋白质乳化性质的方法 (1)乳化容量(EC) 所谓乳化容量是指乳浊液在发生相转变之前,1 g 蛋白质能够乳化油的体积(ml)。蛋白质水溶液在搅拌下以恒定速度不断地加入 油或熔化脂肪,当黏度突然降低或者电阻增大时,即可察觉出相转变,从而得出 其乳化容量。蛋白质的乳化容量随蛋白质浓度增大而降低。 (2)乳浊液稳定性(ES) ES= 100 最初乳浊液体积 最终乳浊液体积 预先加热(或不加热)的乳浊液,经低速离心(或放置)几小时后,乳浊液 被破坏会出现水和油层分离的现象,当油滴向上移动形成密集的填充层时,乳浊 液常常出现分层(不聚结),同时水相向下移动在底部形成水层。 (六)发泡性 食品泡沫通常是气泡在连续的液相或含可溶性表面活性剂的半固相中形成 的分散体。大多数情况下,气体是空气或二氧化碳,连续相是含蛋白质的水溶液 或悬浊液。泡沫中的薄液层连续相使气泡分散,通常用表面活性剂以保持界面防 止气泡聚集,因为表面活性剂能够降低界面张力,并且在气泡之间形成有弹性的 保护层。各种泡沫的气泡大小很不相同,直径大小可从 m 级到 cm 级不等。气 泡的大小取决于液相的表面张力、黏度、输入的能量等。所以泡沫是由可溶性蛋 白质向空气/水界面扩散、伸展、浓集和快速扩展、降低界面张力而形成的。泡 沫的稳定性取决于气泡是否具有一层黏结、富有弹性而不透气的蛋白质膜。分布 均匀的细微气泡可以使食品具有稠性及细腻和松软的口感,提高分散性和风味 感。 具有良好发泡性质的蛋白质有卵清蛋白、血红蛋白中的球蛋白部分、牛血清 蛋白、明胶、乳清蛋白、酪蛋白胶束、β-酪蛋白、小麦蛋白(特别是麦谷蛋白)、 大豆蛋白和某些蛋白质的低度水解产物。 1.产生泡沫的方法 (1)鼓泡法 气体经过多孔分配器(例如烧结玻璃)通入低浓度的(0.01 ~ 2.0 g/100mL)蛋白质水溶液中,产生泡沫,一般可膨胀 10 倍,在某些情况下可 达到 100 倍。 (2)搅打(搅拌)振摇法 这种方法是大多数食品充气最常用的方法。由 于搅打产生更强的机械应力和剪切作用,故可使气体分散得更均匀。但是更剧烈 的机械应力会影响气泡的聚集和形成,阻碍蛋白质在界面的吸附,因而会增加对 蛋白质的需要量(1~40 g/100mL)。 (3)突然解除预先加于溶液的压力。 2.发泡性的评价 蛋白质的发泡性可以通过气泡的平均大小、发泡率、发泡能力等加以评价。 (1)发泡率的表示方法 发泡率一般可以用以下几种方法表示: “稳态”泡沫体积:100×泡沫体积/液相最初体积; 膨胀量:100×(分散体总体积 − 流体最初体积)/ 流体最初体积; 发泡能力:100×泡沫中气体的体积 / 泡沫中液体的体积; 泡沫中气体与鼓泡气体的体积比; 泡沫密度

(2)发泡能力(Fp)评价 发泡能力一般随液相中蛋白质浓度的增大而增 大,直至某一最大值。各种蛋白质发泡能力的大小可以通过测定 Fp 最大值和相 当于 Fp 最大值的一半的相应蛋白质浓度进行比较。 (3)泡沫稳定性评价 泡沫稳定性可以采用以下几个标准来衡量: 经一定时间后,液体泄漏或泡崩溃(体积减少)的程度; 全部或一半泄漏(体积减少一半)的时间; 泄漏开始前的时间。 四、食品蛋白质在加工中的变化 (一)营养和安全性的变化 一般来说,食品加工能延长食品的保质期,并能使各种季节性的食品能以稳 定的形式供应,这种形式必须是吸引人的、有营养的、安全的。大多数情况下, 加工过程对蛋白质的营养价值没有显著影响,有时甚至能得到改善。但是有时也 可发生一些不需要的反应,通常是蛋白质一级结构改变,使必需氨基酸含量降低 或形成抗营养的可能有毒的衍生物。当破坏的氨基酸并未构成膳食中营养限制因 素时,或者受损坏的蛋白质仅为膳食中蛋白质很少的一部分时,营养价值降低是 不重要的。如果膳食是由有限几类食品所构成时,如牛乳、谷物或豆类,或者膳 食仅具有营养要求的最低含量的蛋白质时,那么这样的损坏是十分有害的。 热处理引起的变化:加热处理分离蛋白或含蛋白质的食品会引起蛋白质结构 的改变,使其失去生物活性和改变功能性质,但若加热温度保持适度时,共价键 不会破坏,也不会形成,也不会强烈影响到蛋白质的高级结构。从营养学观点来 看,温和热处理所引起的变化一般是有利的。 热烫或蒸煮可以使酶失去活性,例如脂酶、脂氧合酶、蛋白酶、多酚氧化酶 和糖水解酶。酶失活能防止食品产生非需要的颜色、风味、质地变化和纤维素含 量的降低。食品中存在的大多数天然蛋白质毒素或抗营养因子都可通过加热而变 性钝化,由微生物污染产生的大多数蛋白质毒素亦然,但少数微生物蛋白需高温 灭活,如肉毒杆菌毒素在 100 ℃下加热 10 min 可破坏,而金色葡萄球菌产生的 毒素,必须经 218~248 ℃下加热 30 min,才使毒素完全消除。 豆科植物(大豆、花生、菜豆、蚕豆、豌豆和苜蓿等)的种子或叶片含有能 在体内结合和抑制酶的蛋白质,因而会降低摄入蛋白质的消化率和营养价值。例 如大豆种子中存在的胰蛋白酶抑制剂和胰凝乳蛋白酶抑制剂。这种热不稳定性蛋 白质抑制剂可以使某些动物胰脏过度分泌和增生,从而影响其生长。豆科植物的 植物红血球凝集素是一种能和多糖苷类分子结合的热不稳定性蛋白质,随膳食进 入人体后,可能是由于与肠细胞膜多糖形成复合物,因而减弱了氨基酸的转移和 消化能力,并且还发现对人和动物可产生毒性作用。 当种子、面粉或蛋白质浓缩物在高温潮湿条件下加热如高压灭菌、挤压加工、 焙烤和烹煮时,所有抗营养因子都会变性和失活。由于适当热处理可明显提高植 物蛋白对某些动物的营养价值,所以某些动物饲料中植物蛋白质成分通常要经过 加热处理。许多蛋白质,例如大豆球蛋白、骨胶原和卵清蛋白在适当热处理后更 容易消化,这是由于蛋白质结构发生伸展而使原来被掩蔽的氨基酸残基暴露,从 而使蛋白酶迅速、广泛地作用。 蛋白质及蛋白质食品在不添加外来物质的条件下进行高热处理,即可引起氨 基酸的脱硫、脱酰胺、异构化和其他化学改性,甚至有时会伴随产生有毒化合物
(2)发泡能力(Fp)评价 发泡能力一般随液相中蛋白质浓度的增大而增 大,直至某一最大值。各种蛋白质发泡能力的大小可以通过测定 Fp 最大值和相 当于 Fp 最大值的一半的相应蛋白质浓度进行比较。 (3)泡沫稳定性评价 泡沫稳定性可以采用以下几个标准来衡量: 经一定时间后,液体泄漏或泡崩溃(体积减少)的程度; 全部或一半泄漏(体积减少一半)的时间; 泄漏开始前的时间。 四、食品蛋白质在加工中的变化 (一)营养和安全性的变化 一般来说,食品加工能延长食品的保质期,并能使各种季节性的食品能以稳 定的形式供应,这种形式必须是吸引人的、有营养的、安全的。大多数情况下, 加工过程对蛋白质的营养价值没有显著影响,有时甚至能得到改善。但是有时也 可发生一些不需要的反应,通常是蛋白质一级结构改变,使必需氨基酸含量降低 或形成抗营养的可能有毒的衍生物。当破坏的氨基酸并未构成膳食中营养限制因 素时,或者受损坏的蛋白质仅为膳食中蛋白质很少的一部分时,营养价值降低是 不重要的。如果膳食是由有限几类食品所构成时,如牛乳、谷物或豆类,或者膳 食仅具有营养要求的最低含量的蛋白质时,那么这样的损坏是十分有害的。 热处理引起的变化:加热处理分离蛋白或含蛋白质的食品会引起蛋白质结构 的改变,使其失去生物活性和改变功能性质,但若加热温度保持适度时,共价键 不会破坏,也不会形成,也不会强烈影响到蛋白质的高级结构。从营养学观点来 看,温和热处理所引起的变化一般是有利的。 热烫或蒸煮可以使酶失去活性,例如脂酶、脂氧合酶、蛋白酶、多酚氧化酶 和糖水解酶。酶失活能防止食品产生非需要的颜色、风味、质地变化和纤维素含 量的降低。食品中存在的大多数天然蛋白质毒素或抗营养因子都可通过加热而变 性钝化,由微生物污染产生的大多数蛋白质毒素亦然,但少数微生物蛋白需高温 灭活,如肉毒杆菌毒素在 100 ℃下加热 10 min 可破坏,而金色葡萄球菌产生的 毒素,必须经 218~248 ℃下加热 30 min,才使毒素完全消除。 豆科植物(大豆、花生、菜豆、蚕豆、豌豆和苜蓿等)的种子或叶片含有能 在体内结合和抑制酶的蛋白质,因而会降低摄入蛋白质的消化率和营养价值。例 如大豆种子中存在的胰蛋白酶抑制剂和胰凝乳蛋白酶抑制剂。这种热不稳定性蛋 白质抑制剂可以使某些动物胰脏过度分泌和增生,从而影响其生长。豆科植物的 植物红血球凝集素是一种能和多糖苷类分子结合的热不稳定性蛋白质,随膳食进 入人体后,可能是由于与肠细胞膜多糖形成复合物,因而减弱了氨基酸的转移和 消化能力,并且还发现对人和动物可产生毒性作用。 当种子、面粉或蛋白质浓缩物在高温潮湿条件下加热如高压灭菌、挤压加工、 焙烤和烹煮时,所有抗营养因子都会变性和失活。由于适当热处理可明显提高植 物蛋白对某些动物的营养价值,所以某些动物饲料中植物蛋白质成分通常要经过 加热处理。许多蛋白质,例如大豆球蛋白、骨胶原和卵清蛋白在适当热处理后更 容易消化,这是由于蛋白质结构发生伸展而使原来被掩蔽的氨基酸残基暴露,从 而使蛋白酶迅速、广泛地作用。 蛋白质及蛋白质食品在不添加外来物质的条件下进行高热处理,即可引起氨 基酸的脱硫、脱酰胺、异构化和其他化学改性,甚至有时会伴随产生有毒化合物