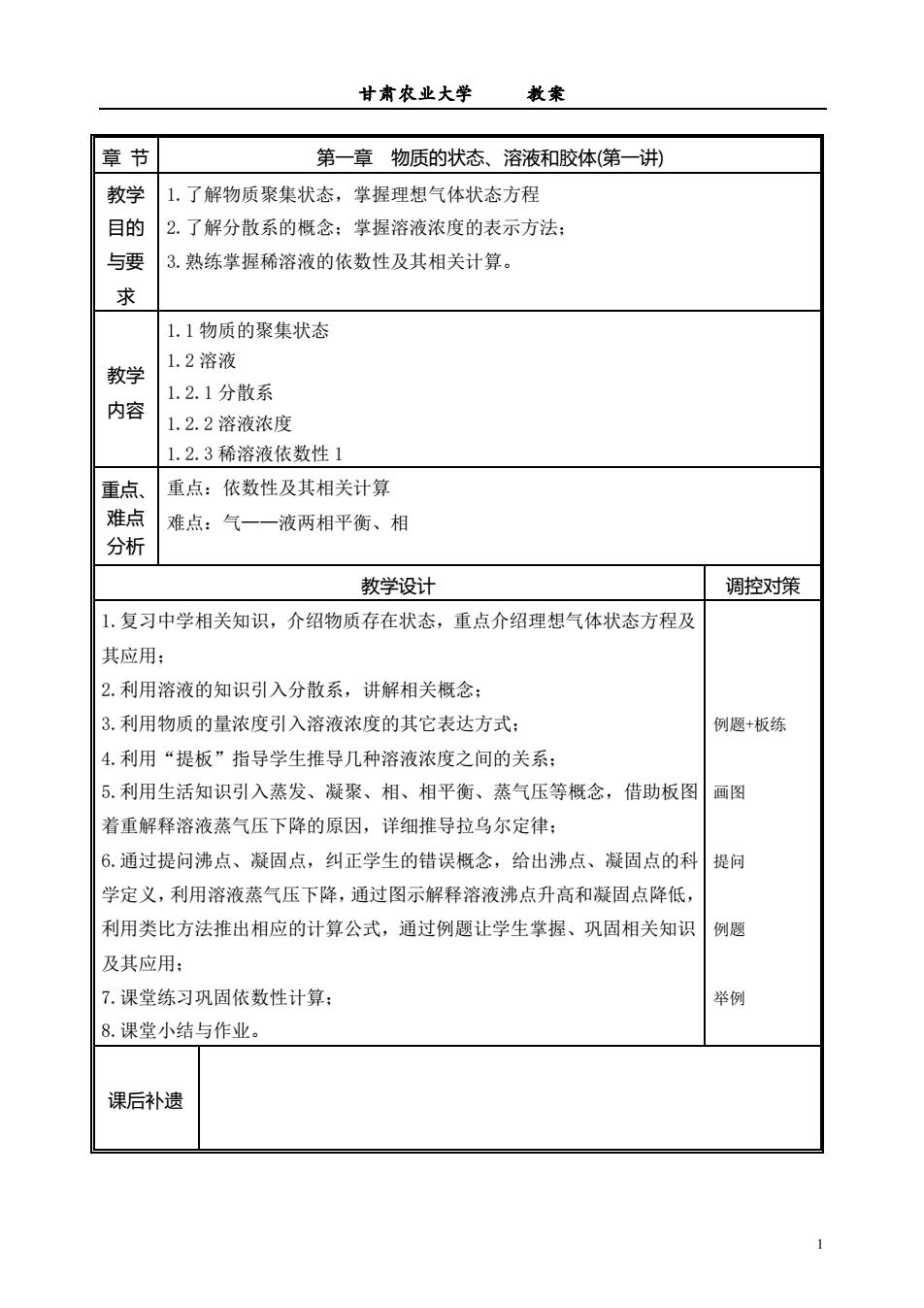
甘肃农业大学 教聚 章节 第一章物质的状态、溶液和胶体(第一讲) 教学 1.了解物质聚集状态,掌握理想气体状态方程 目的 2.了解分散系的概念:掌握溶液浓度的表示方法: 与要 3.熟练掌握稀溶液的依数性及其相关计算。 求 1.1物质的聚集状态 1.2溶液 教学 1.2.1分散系 内容 1.2.2溶液浓度 1.2.3稀溶液依数性1 重点、 重点:依数性及其相关计算 难点 难点:气一一液两相平衡、相 分析 教学设计 调控对策 1.复习中学相关知识,介绍物质存在状态,重点介绍理想气体状态方程及 其应用; 2.利用溶液的知识引入分散系,讲解相关概念; 3.利用物质的量浓度引入溶液浓度的其它表达方式: 例题+板练 4.利用“提板”指导学生推导几种溶液浓度之间的关系: 5.利用生活知识引入蒸发、凝聚、相、相平衡、蒸气压等概念,借助板图 画图 着重解释溶液蒸气压下降的原因,详细推导拉乌尔定律: 6.通过提问沸点、凝固点,纠正学生的错误概念,给出沸点、凝固点的科 提问 学定义,利用溶液蒸气压下降,通过图示解释溶液沸点升高和凝固点降低, 利用类比方法推出相应的计算公式,通过例题让学生掌握、巩固相关知识 例题 及其应用: 7.课堂练习巩固依数性计算: 举例 8.课堂小结与作业。 课后补遗
甘肃农业大学 教案 1 章 节 第一章 物质的状态、溶液和胶体(第一讲) 教学 目的 与要 求 1.了解物质聚集状态,掌握理想气体状态方程 2.了解分散系的概念;掌握溶液浓度的表示方法; 3.熟练掌握稀溶液的依数性及其相关计算。 教学 内容 1.1 物质的聚集状态 1.2 溶液 1.2.1 分散系 1.2.2 溶液浓度 1.2.3 稀溶液依数性 1 重点、 难点 分析 重点:依数性及其相关计算 难点:气——液两相平衡、相 教学设计 调控对策 1.复习中学相关知识,介绍物质存在状态,重点介绍理想气体状态方程及 其应用; 2.利用溶液的知识引入分散系,讲解相关概念; 3.利用物质的量浓度引入溶液浓度的其它表达方式; 4.利用“提板”指导学生推导几种溶液浓度之间的关系; 5.利用生活知识引入蒸发、凝聚、相、相平衡、蒸气压等概念,借助板图 着重解释溶液蒸气压下降的原因,详细推导拉乌尔定律; 6.通过提问沸点、凝固点,纠正学生的错误概念,给出沸点、凝固点的科 学定义,利用溶液蒸气压下降,通过图示解释溶液沸点升高和凝固点降低, 利用类比方法推出相应的计算公式,通过例题让学生掌握、巩固相关知识 及其应用; 7.课堂练习巩固依数性计算; 8.课堂小结与作业。 例题+板练 画图 提问 例题 举例 课后补遗

甘肃农业大学 教策 教学过程 批注 一,导入新课(3~5分钟) 由世界是物质的,物质的聚集状态与物质的属性及其周围环境条件的关系导出所要介 绍的内容。 二讲授新内容(90分钟) 第一章物质的聚集状态、溶液和胶体 1.1物质的聚集状态 一板书标题 1.1.1气体 一一设疑提问 11.1.1理想气体的状态方程 一一板书 (1)气体的特征 (2)理想气体模型 一一板书 (a)气体分子是一个质点无体积, (b)气体分子间无作用力, (c)气体分子碰撞是完全弹性碰撞。 一一板书 (3)理想气体状态方程 PV=nRT 例题 方程可以变形为 PV=RT P=PRT M M 用来计算气体的分子量M及密度p 一一板书 1.1.1.2 Dalton气体分压定律 在一定温度下,各组分气体单独占据与混合气体相同体积时所呈现的压力叫做该组 强调正确理解 分气体的分压。I801年英国化学家道尔顿(Dalton)通过实验发现,在一定温度下气体混合 分压的概念 物的总压力等于其中各组分气体分压力之和,这就是Dalton分压定律。用数学式表示为: p=P+p,+P,+=∑p 一板书 式中,p是混合气体的总压力,p1、p2、p3..是气体1,2,3,的分压。 根据状态方程式有 卫-h p n 一一板书 式中,n为混合气体总物质的量,即n=n+乃,+乃+=∑n,m为某组分气体物质 的量。将凸称为摩尔分数,用表示。故有∑x=】 n 所以,某一组分气体的分压和该气体组分的摩尔分数成正比。 一一板书 P=px 一一板书 可见,气体的分压只与它的摩尔分数和混合气体的总压力有关,而不涉及它的体积。 1.1.2液体 例题 1.1.2.1液体的蒸汽压 (1)液体的蒸发 (a)蒸气压的概念及与温度、外压的关系 2
甘肃农业大学 教案 教 学 过 程 批 注 2 一.导入新课(3~5 分钟) 由世界是物质的,物质的聚集状态与物质的属性及其周围环境条件的关系导出所要介 绍的内容。 二 讲授新内容(90 分钟) 第一章 物质的聚集状态、溶液和胶体 1.1 物质的聚集状态 1.1.1 气体 1.1.1.1 理想气体的状态方程 (1)气体的特征 (2)理想气体模型 (a)气体分子是一个质点无体积, (b)气体分子间无作用力, (c)气体分子碰撞是完全弹性碰撞。 (3) 理想气体状态方程 PV = nRT 方程可以变形为 RT M RT P M m PV = = 用来计算气体的分子量 M 及密度ρ 1.1.1.2 Dalton 气体分压定律 在一定温度下,各组分气体单独占据与混合气体相同体积时所呈现的压力叫做该组 分气体的分压。1801 年英国化学家道尔顿(Dalton)通过实验发现,在一定温度下气体混合 物的总压力等于其中各组分气体分压力之和,这就是 Dalton 分压定律。用数学式表示为: p = p1 + p2 + p3 +=∑pi 式中,p 是混合气体的总压力,p1、p2、p3…是气体 1,2,3,…的分压。 根据状态方程式有 n n p pi i = 式中,n 为混合气体总物质的量,即 n = n1 + n2 + n3 +=ni ,ni 为某组分气体物质 的量。将 n ni 称为摩尔分数,用 xi 表示。故有 ∑xi = 1 所以,某一组分气体的分压和该气体组分的摩尔分数成正比。 i i p = px 可见,气体的分压只与它的摩尔分数和混合气体的总压力有关,而不涉及它的体积。 1.1.2 液体 1.1.2.1 液体的蒸汽压 (1)液体的蒸发 (a)蒸气压的概念及与温度、外压的关系 —―板书标题 ――设疑提问 ――板书 ――板书 ――板书 例题 ――板书 强调正确理解 分压的概念 ――板书 ――板书 ――板书 ――板书 例题

甘肃农业大学 教秉 教学过程 批注 1.1.2.2液体的正常沸点和凝固点 1.1.3固体 简介 1.1.4水的相图 (1)相的概念 附图 (2)水的三相点 1.1.5物质的第四态一一等离子体 1.2溶液 1.2.1分散系的概念 按分散质颗粒大小分散系的分类及其性质 一板书标题 一设疑提问 1.2.2溶液浓度的表示方法 一一板书 溶液的浓度是指一定量的溶液中所含溶质的量或一定量溶剂中所含溶质的量,我们 用A表示溶剂,用B表示溶质,常用的浓度表示方法有如下几种: 一一板书 1.质量分数溶液中某一组分的质量与溶液总质量之比。其数学表达式为, de=Ma m 一一板书 式中,⊙B为溶质的质量分数,单位为1:为溶质的质量,SI单位为μg、mg、kg 等: m为溶液的质量,SI单位为kg: 例题 稀溶液中,通常用每kg溶液中所含溶质的mg数表示,单位为mgkg',表示痕量组 分的浓度时,采用每kg溶液中所含溶质的μg表示,单位为μgkg。 2.以物质的量表示溶质含量的浓度 (1)物质的量浓度。物质的量浓度是指单位体积溶液中所含溶质物质的量,用符号 一一板书 c表示,即 c=Ma 式中,m为溶质的物质的量,单位为mol:V为溶液的体积,单位为dm3:则浓度的 一一板书 单位为mol-dm3。 (2)质量摩尔浓度。质量摩尔浓度是指每kg溶剂中所含溶质的物质的量,常用b加 表示,其数学表达式为: be=Ii 一强调概念 mA 式中,B为溶质的物质的量,单位为mol:m溶剂的质量,单位为kg。所以质量摩 一一板书 尔浓度的单位为mol-kg。 (3)摩尔分数。溶液中某一组分物质的量与全部溶液的物质的量之比称为该物质的 摩尔分数,用x来表示。对于一个两组分溶液体系来说,溶质的摩尔分数与溶剂的摩尔 分数分别为: 一一板书 XB nB XA- nA na+nB na+nB 一一板书 式中,na为溶剂的物质的量,单位为mol:ns为溶质的物质的量,单位为mol。 显然,对两组分体系有x“十m=1。同理,多组分体系中有∑x,=1。 例题 3
甘肃农业大学 教案 教 学 过 程 批 注 3 1.1.2.2 液体的正常沸点和凝固点 1.1.3 固体 1.1.4 水的相图 (1)相的概念 (2)水的三相点 1.1.5 物质的第四态——等离子体 1.2 溶液 1.2.1 分散系的概念 按分散质颗粒大小分散系的分类及其性质 1.2.2 溶液浓度的表示方法 溶液的浓度是指一定量的溶液中所含溶质的量或一定量溶剂中所含溶质的量,我们 用 A 表示溶剂,用 B 表示溶质,常用的浓度表示方法有如下几种: 1.质量分数 溶液中某一组分的质量与溶液总质量之比。其数学表达式为, m mB B = 式中, ωB为溶质的质量分数,单位为 1;mB为溶质的质量,SI 单位为μg、mg、kg 等; m 为溶液的质量,SI 单位为 kg; 稀溶液中,通常用每 kg 溶液中所含溶质的 mg 数表示,单位为 mg∙kg -1,表示痕量组 分的浓度时,采用每 kg 溶液中所含溶质的μg 表示,单位为μg∙kg -1。 2. 以物质的量表示溶质含量的浓度 (1) 物质的量浓度。物质的量浓度是指单位体积溶液中所含溶质物质的量,用符号 c 表示,即 V n c B = 式中,nB为溶质的物质的量,单位为 mol;V 为溶液的体积,单位为 dm3;则浓度的 单位为 mol∙dm-3。 (2) 质量摩尔浓度。质量摩尔浓度是指每 kg 溶剂中所含溶质的物质的量,常用 bB 表示,其数学表达式为: A B B = m n b 式中,nB为溶质的物质的量,单位为 mol;mA 溶剂的质量,单位为 kg。所以质量摩 尔浓度的单位为 mol∙kg -1。 (3)摩尔分数。溶液中某一组分物质的量与全部溶液的物质的量之比称为该物质的 摩尔分数,用 x 来表示。对于一个两组分溶液体系来说,溶质的摩尔分数与溶剂的摩尔 分数分别为: A B A A A B B B n n n x n n n x + = + = 式中,nA为溶剂的物质的量,单位为 mol;nB为溶质的物质的量,单位为 mol。 显然,对两组分体系有 xA+xB=1。同理,多组分体系中有 xi = 1。 简介 附图 —―板书标题 ――设疑提问 ――板书 ――板书 ――板书 例题 ――板书 ――板书 --强调概念 ――板书 ――板书 ――板书 例题

甘肃农业大学 教策 教学过程 批注 1.2.3稀溶液的依数性 1.溶液的蒸气压下降 1886年法国化学家拉乌尔(F.Raoult)根据一系列实验结果提出:“在一定温度下, 难挥发非电解质稀溶液的蒸气压等于纯溶剂的饱和蒸气压与溶剂的摩尔分数的乘积”,这 就是 拉乌尔定律。它可用下式来表达: p=p*xA 一一板书 式中,p为溶液的蒸气压:p*为纯溶剂的饱和蒸气压,xa为溶剂的摩尔分数。 因为xA十郑=1, 所以p=p*xA=p*(I一阳)=p*一p*B 又因p*一p=△p 一一用图说明 所以△p=p*xB 拉乌尔定律也可以这样描述:“在一定温度下,稀溶液的蒸气压下降△P和溶质的摩尔分 一一板书 数成正比”。拉乌尔定律只适用于非电解质的稀溶液。 一板书 三小结(3~5分钟) 1理想气体状态方程及分压定律内容表达形式及其相关计算: 2蒸气压的概念以及温度对蒸气压的影响(蒸气压曲线): 3正确理解相的概念,气一液二相平衡体系: 4正常沸点的概念。 四布置作业: 附:板书设计: 主板: 副板: 第一章物质的聚集状态、溶液和胶体 11物质的聚集状态 1.1.1气体 1.1.1.1理想气体的状态方程 (1)气体的特征 (2)理想气体模型 (a)气体分子是一个质点无体积, (b)气体分子间无作用力, (c)气体分子碰撞是完全弹性碰撞。 (3)理想气体状态方程 PV=nRT 例题 1.1.2 Dalton分压定律 4
甘肃农业大学 教案 教 学 过 程 批 注 4 1.2.3 稀溶液的依数性 1. 溶液的蒸气压下降 1886 年法国化学家拉乌尔(F.Raoult)根据一系列实验结果提出:“在一定温度下, 难挥发非电解质稀溶液的蒸气压等于纯溶剂的饱和蒸气压与溶剂的摩尔分数的乘积”,这 就是 拉乌尔定律。它可用下式来表达: p=p* xA 式中,p 为溶液的蒸气压;p*为纯溶剂的饱和蒸气压,xA 为溶剂的摩尔分数。 因为 x A + xB = 1, 所以 p=p* xA = p*(1-xB)=p*-p* xB 又因 p*-p=Δp 所以 Δp=p* xB 拉乌尔定律也可以这样描述:“在一定温度下,稀溶液的蒸气压下降Δp 和溶质的摩尔分 数成正比”。拉乌尔定律只适用于非电解质的稀溶液。 三 小结(3~5 分钟) 1 理想气体状态方程及分压定律内容表达形式及其相关计算; 2 蒸气压的概念以及温度对蒸气压的影响(蒸气压曲线); 3 正确理解相的概念,气-液二相平衡体系; 4 正常沸点的概念。 四 布置作业: 附:板书设计: 主板: 副板: 第一章 物质的聚集状态、溶液和胶体 1.1 物质的聚集状态 1.1.1 气体 1.1.1.1 理想气体的状态方程 (1)气体的特征 (2)理想气体模型 (a)气体分子是一个质点无体积, (b)气体分子间无作用力, (c)气体分子碰撞是完全弹性碰撞。 (3)理想气体状态方程 PV = nRT 1.1.2 Dalton 分压定律 ――板书 ――用图说明 ――板书 ――板书 例题

甘肃农业大学 教策 教学过程 批注 p=n+P2+P,+…=∑p 分析并举例说明 1.2液体 (1)液体的蒸发 (a)蒸气压的概念及与温度、外压的关系 示意图 1.1.2.2液体的正常沸点和凝固点 1.1.3固体 1.1.4水的相图 示意图 1.1.5等离子体 1.2溶液 1.2.1分散系的概念 1.2.2溶液 1.4.1溶液浓度的表示方法 1.质量分数 a÷ m 2.物质的量浓度 c= 3.质量摩尔浓度 bu=in mA 4.摩尔分数 XB = XA = na +nB nA +nB 1.2.2稀溶液的依数性 1.溶液的蒸气压下降 p=p*xA △p=p*xB
甘肃农业大学 教案 教 学 过 程 批 注 5 p = p1 + p2 + p3 +=∑pi 分析并举例说明 1.2 液体 (1)液体的蒸发 (a)蒸气压的概念及与温度、外压的关系 示意图 1.1.2.2 液体的正常沸点和凝固点 1.1.3 固体 1.1.4 水的相图 示意图 1.1.5 等离子体 1.2 溶液 1.2.1 分散系的概念 1.2.2 溶液 1.4.1 溶液浓度的表示方法 1.质量分数 m mB B = 2. 物质的量浓度 V n c B = 3. 质量摩尔浓度 A B B = m n b 4. 摩尔分数 A B A A A B B B n n n x n n n x + = + = 1.2.2 稀溶液的依数性 1. 溶液的蒸气压下降 p=p* xA Δp=p* xB