甘肃农业大学 教案 章节 第七章配位平衡(3学时) 1了解配位化合物的组成、结构及常见配体及相关术语,掌握配位化合物的命名。; 教学目 2了解配位化合物的配位-离解平衡,掌握配位化合物的稳定常数及不稳定常数: 3掌握配合平衡的多重平衡体系(包括与酸碱电离、沉淀溶解、氧化还原及相关的配合平衡) 的与要 的相互作用, 求 4可熟练处理涉及配合平衡的多重平衡体系的相关计算。 5学生学会分析和解决问题,培养创新能力。 7.1配合物的基本概念 7.1.1配合物的组成 7.1.2配合物的命名 教学内 7.1.3配合物的类型 容 7.2配位平衡 7.2.1配合物的稳定常数K 7.2.2配位平衡的移动 7.3配合物的应用 重点、 重点:配合物的组成与命名 难点分 难点:配合物的命名及配合平衡 析 教学设计 调控对策 1.通过配合物的有关实验现象,分析配合物的组成,让学生熟悉配合 物的组成和相关名词: 2.介绍配合物的命名原则,通过练习使学生熟练掌握简单配合物的命 练习 名: 2.利用化学平衡原理和多重平衡规则,通过例题和练习使学生熟练掌 握配位平衡的相关计算; 3.安排学生自学配合物的应用 4.本章复习、作业。 3.小结。 课后补遗 47
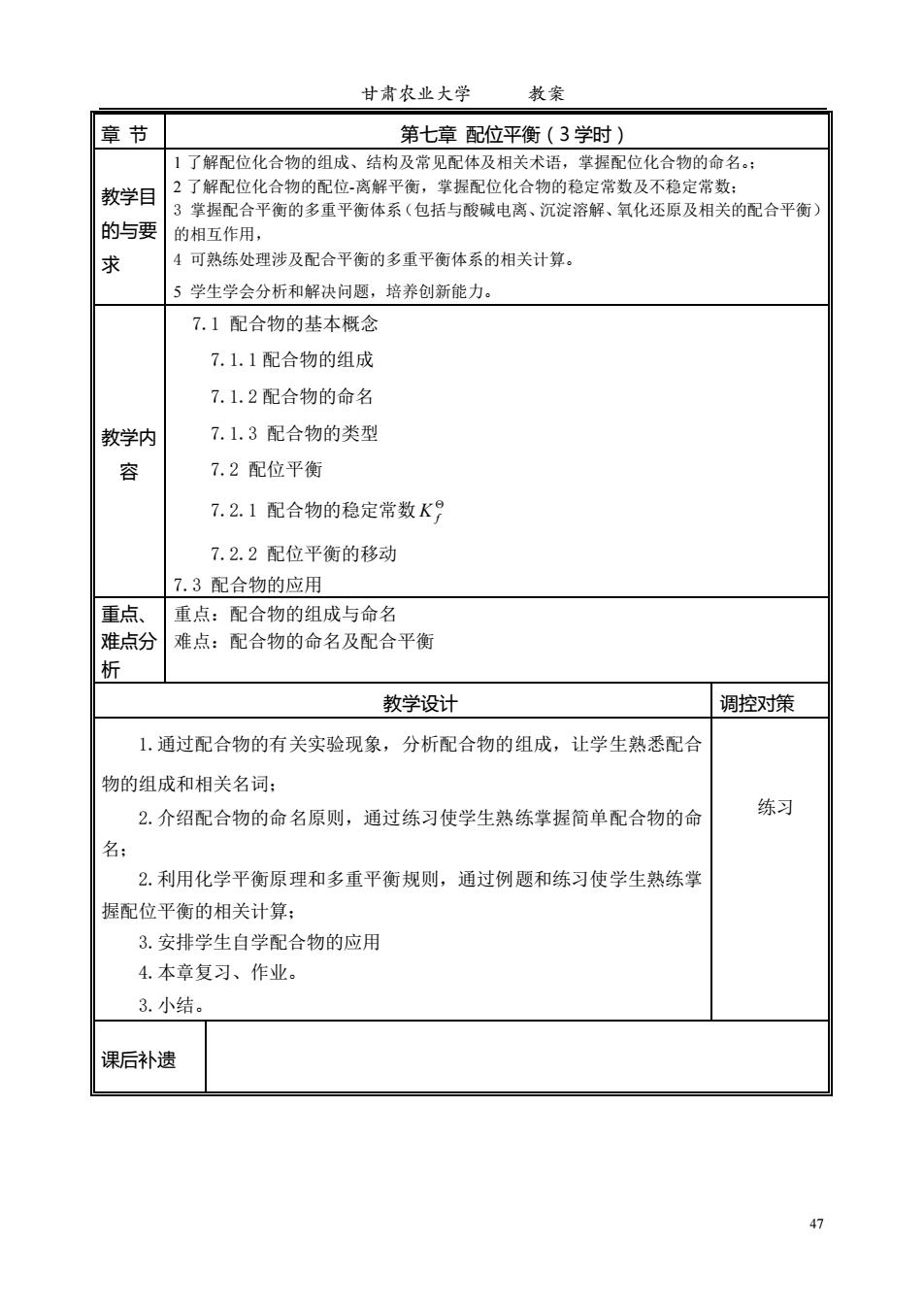
甘肃农业大学 教案 47 章 节 第七章 配位平衡(3 学时) 教学目 的与要 求 1 了解配位化合物的组成、结构及常见配体及相关术语,掌握配位化合物的命名。; 2 了解配位化合物的配位-离解平衡,掌握配位化合物的稳定常数及不稳定常数; 3 掌握配合平衡的多重平衡体系(包括与酸碱电离、沉淀溶解、氧化还原及相关的配合平衡) 的相互作用, 4 可熟练处理涉及配合平衡的多重平衡体系的相关计算。 5 学生学会分析和解决问题,培养创新能力。 教学内 容 7.1 配合物的基本概念 7.1.1 配合物的组成 7.1.2 配合物的命名 7.1.3 配合物的类型 7.2 配位平衡 7.2.1 配合物的稳定常数 K f 7.2.2 配位平衡的移动 7.3 配合物的应用 重点、 难点分 析 重点:配合物的组成与命名 难点:配合物的命名及配合平衡 教学设计 调控对策 1.通过配合物的有关实验现象,分析配合物的组成,让学生熟悉配合 物的组成和相关名词; 2.介绍配合物的命名原则,通过练习使学生熟练掌握简单配合物的命 名; 2.利用化学平衡原理和多重平衡规则,通过例题和练习使学生熟练掌 握配位平衡的相关计算; 3.安排学生自学配合物的应用 4.本章复习、作业。 3.小结。 练习 课后补遗

甘肃农业大学 教案 教学过程 批注 导入新课(5分钟) 通过介绍日常生产生活中的一些现象提出问题和高中学过的Cu(NH)S0,而导入新 一导入 课。 二讲授新课 第七章配位平衡 一一板书 7.1配位化合物的基本概念 7.1.1配位化合物的组成 一一介绍概念 配位化合物一般是由一个金属离子(或原子)和围绕在它周围的几个阴离子或分子 之前简单介绍 所组成的。这个金属离子叫中心离子。按一定的空间位置排列在中心离子周围的其它离 配位化合物的 子或分子叫配体。中心离子和若干个配体所构成的单位叫配合单元,在化学式上用方括 发展史 号括起来,表示配位化合物的内界。 (1)内界与外界:配位化合物中配合单元用方括号括起来称作内界,其余部分称为外 界。 一提问,然后 配位化合物也可单独由内界构成。如[Co(NH),Cl]、[Fe(C0)]等。 解释 (2)复盐和配位化合物 共同点:均是两种物质的加合产物。 区别:复盐均体现原物质的性质,而配位化合物有所改变 一一板书 解释:复盐是不稳定的配位化合物。如LiCuCly 一一举例说明, 中心离子(原子)及配体的特点 强调配位原子 1中心离子(或原子) 和配位数的概 2配体及配位原子 还 3配位数与配体数 一一结合实例 4配离子的电荷 详细讲解命名 7.1.2配位化合物的命名 规则,强调一些 1配合单元的命名 容易混淆的配 2配位化合物的命名 体的名称 7.1.3配位化合物的类型 一一板书 (1)简单配合物 (2)螯合物 7.2配位平衡 一一板书 7.2.1配位化合物的稳定常数 1.配位化合物的稳定常数 依据化学平衡的一般原理,其平衡常数表达式为: 一一让学生根 M+nL MLn 据平衡常数的 书写方法写出 K叫稳定常数。以M表示金属离子(原子),L表示配体,n表示配体数,配合反应可 写成: Ko=- c[MLn]/c0 c(M)/co.[c(L)/co]" K越大,说明生成配离子的倾向越大,而离解的倾向就越小,即配离子越稳定。 48
甘肃农业大学 教案 教 学 过 程 批 注 48 一 导入新课(5 分钟) 通过介绍日常生产生活中的一些现象提出问题和高中学过的 Cu(NH3)4SO4 而导入新 课。 二 讲授新课 第七章 配位平衡 7.1 配位化合物的基本概念 7.1.1 配位化合物的组成 配位化合物一般是由一个金属离子(或原子)和围绕在它周围的几个阴离子或分子 所组成的。这个金属离子叫中心离子。按一定的空间位置排列在中心离子周围的其它离 子或分子叫配体。中心离子和若干个配体所构成的单位叫配合单元,在化学式上用方括 号括起来,表示配位化合物的内界。 (1)内界与外界:配位化合物中配合单元用方括号括起来称作内界,其余部分称为外 界。 配位化合物也可单独由内界构成。如 [Co(NH3)3Cl3]、 [Fe(CO)5]等。 (2)复盐和配位化合物 共同点:均是两种物质的加合产物。 区别:复盐均体现原物质的性质,而配位化合物有所改变 解释:复盐是不稳定的配位化合物。如 LiCuCl3 中心离子(原子)及配体的特点 1 中心离子(或原子) 2 配体及配位原子 3 配位数与配体数 4 配离子的电荷 7.1.2 配位化合物的命名 1 配合单元的命名 2 配位化合物的命名 7.1.3 配位化合物的类型 (1)简单配合物 (2)螯合物 7.2 配位平衡 7.2.1 配位化合物的稳定常数 1. 配位化合物的稳定常数 依据化学平衡的一般原理,其平衡常数表达式为: M +nL MLn K θ f 叫稳定常数。以 M 表示金属离子(原子),L 表示配体,n 表示配体数,配合反应可 写成: n c c c c c K c(M)/ [ (L)/ ] [MLn]/ θ θ θ θ f = K θ f 越大,说明生成配离子的倾向越大,而离解的倾向就越小,即配离子越稳定。 ――导入 ――板书 ――介绍概念 之前简单介绍 配位化合物的 发展史 ――提问,然后 解释 ――板书 ――举例说明, 强调配位原子 和配位数的概 念 ――结合实例 详细讲解命名 规则,强调一些 容易混淆的配 体的名称 ――板书 ――板书 ――让学生根 据平衡常数的 书写方法写出

甘肃农业大学 教案 教学过程 批注 有时也用稳定常数的倒数来表示配位化合物的稳定性,叫不稳定常数,用K日表示。 一一结合同离 京 子效应介绍 2.逐级稳定常数配离子的生成一般是分步进行的,因此溶液中存在着一系列的配合 平衡,对于这些平衡每一步都有相应的逐级稳定常数。总稳定常数是逐级稳定常数的乘 积,K9=K9XKXK8XK4 一一举例介绍, 然后总结解题 稳定常数的应用 注意事项 利用配位化合物的稳定常数,可以解决的问题主要有: 1判断配合反应的方向 2计算配位化合物溶液中某一离子的浓度 7.2.2配位平衡移动 1配位平衡与酸碱平衡 一一板书 对配体的影响 一一举例 对中心离子的影响 2配位一沉淀平衡 配位剂使难溶盐溶解,或沉淀剂使中心离子成难溶盐。 (1)沉淀的生成 一一举例,重点 (2)沉淀的溶解 总结解题方法 3氧化还原一配位平衡 中心离子是氧化还原电对的构成者,当形成配位物时,由于氧化态或还原态浓度(或 一一举例,推导 二者同时)改变造成电对电极电势及电动势的改变,而影响反应的方向。 络离子形成后 构成电极的电 4配位一配位平衡即配位物的转化 极电势 当向一个配位体系中加入其它的配位剂时,形成两个配位平衡间的竞争,其结果通 常是形成更稳定的配位物。 ·一从平衡的 角度简要介绍 7.3配位平衡在生产和科研实践中的应用 (1)控制离子浓度 (2)化学分离(萃取) 一一简单介绍 (3)掩蔽作用 (4)生命科学中的应用 三小结:(3分钟) (1)配位化合物的组成和命名: (2)配合平衡的计算: (3)四大平衡的交叉: (4)氧化还原与配位,沉淀与配位 四布置作业 49
甘肃农业大学 教案 教 学 过 程 批 注 49 有时也用稳定常数的倒数来表示配位化合物的稳定性,叫不稳定常数,用 K θ d 表示。 θ f θ d K K 1 = 2. 逐级稳定常数 配离子的生成一般是分步进行的,因此溶液中存在着一系列的配合 平衡,对于这些平衡每一步都有相应的逐级稳定常数。总稳定常数是逐级稳定常数的乘 积,K θ f = K θ f1 ×K θ f2 ×K θ f3 ×K θ f4 稳定常数的应用 利用配位化合物的稳定常数,可以解决的问题主要有: 1 判断配合反应的方向 2 计算配位化合物溶液中某一离子的浓度 7.2.2 配位平衡移动 1 配位平衡与酸碱平衡 对配体的影响 对中心离子的影响 2 配位-沉淀平衡 配位剂使难溶盐溶解,或沉淀剂使中心离子成难溶盐。 (1)沉淀的生成 (2)沉淀的溶解 3 氧化还原-配位平衡 中心离子是氧化还原电对的构成者,当形成配位物时,由于氧化态或还原态浓度(或 二者同时)改变造成电对电极电势及电动势的改变,而影响反应的方向。 4 配位-配位平衡即配位物的转化 当向一个配位体系中加入其它的配位剂时,形成两个配位平衡间的竞争,其结果通 常是形成更稳定的配位物。 7.3 配位平衡在生产和科研实践中的应用 (1)控制离子浓度 (2)化学分离(萃取) (3)掩蔽作用 (4)生命科学中的应用 三 小结:(3 分钟) (1)配位化合物的组成和命名; (2)配合平衡的计算; (3)四大平衡的交叉; (4)氧化还原与配位,沉淀与配位 四 布置作业 ――结合同离 子效应介绍 ――举例介绍, 然后总结解题 注意事项 ――板书 ――举例 ――举例,重点 总结解题方法 ――举例,推导 络离子形成后 构成电极的电 极电势 ――从平衡的 角度简要介绍 ――简单介绍

甘肃农业大学 教案 教学过程 批注 板书设计 主板 副板 第七章配位平衡 7.1配位化合物的基本概念 7.1.1配位化合物的组成 举例 (1)内界与外界 (2)复盐和配位化合物 中心离子(原子)及配体的特点 7.1.2配位化合物的命名 1配合单元的命名 2配位化合物的命名 7.1.3配位化合物的类型 7.2配位平衡 7.2.1配位化合物的稳定常数 1. 配位化合物的稳定常数 2.逐级稳定常数 7.2.2配位平衡移动 1配位平衡与酸碱平衡 例题 2配位一沉淀平衡 3氧化还原一配位平衡 7.3配位平衡在生产和科研实践中的应用 4配位一配位平衡即配位物的转化 50
甘肃农业大学 教案 教 学 过 程 批 注 50 板书设计 主板 副板 第七章 配位平衡 7.1 配位化合物的基本概念 7.1.1 配位化合物的组成 举例 (1)内界与外界 (2)复盐和配位化合物 中心离子(原子)及配体的特点 7.1.2 配位化合物的命名 1 配合单元的命名 2 配位化合物的命名 7.1.3 配位化合物的类型 7.2 配位平衡 7.2.1 配位化合物的稳定常数 1. 配位化合物的稳定常数 2. 逐级稳定常数 7.2.2 配位平衡移动 1 配位平衡与酸碱平衡 例题 2 配位-沉淀平衡 3 氧化还原-配位平衡 7.3 配位平衡在生产和科研实践中的应用 4 配位-配位平衡即配位物的转化