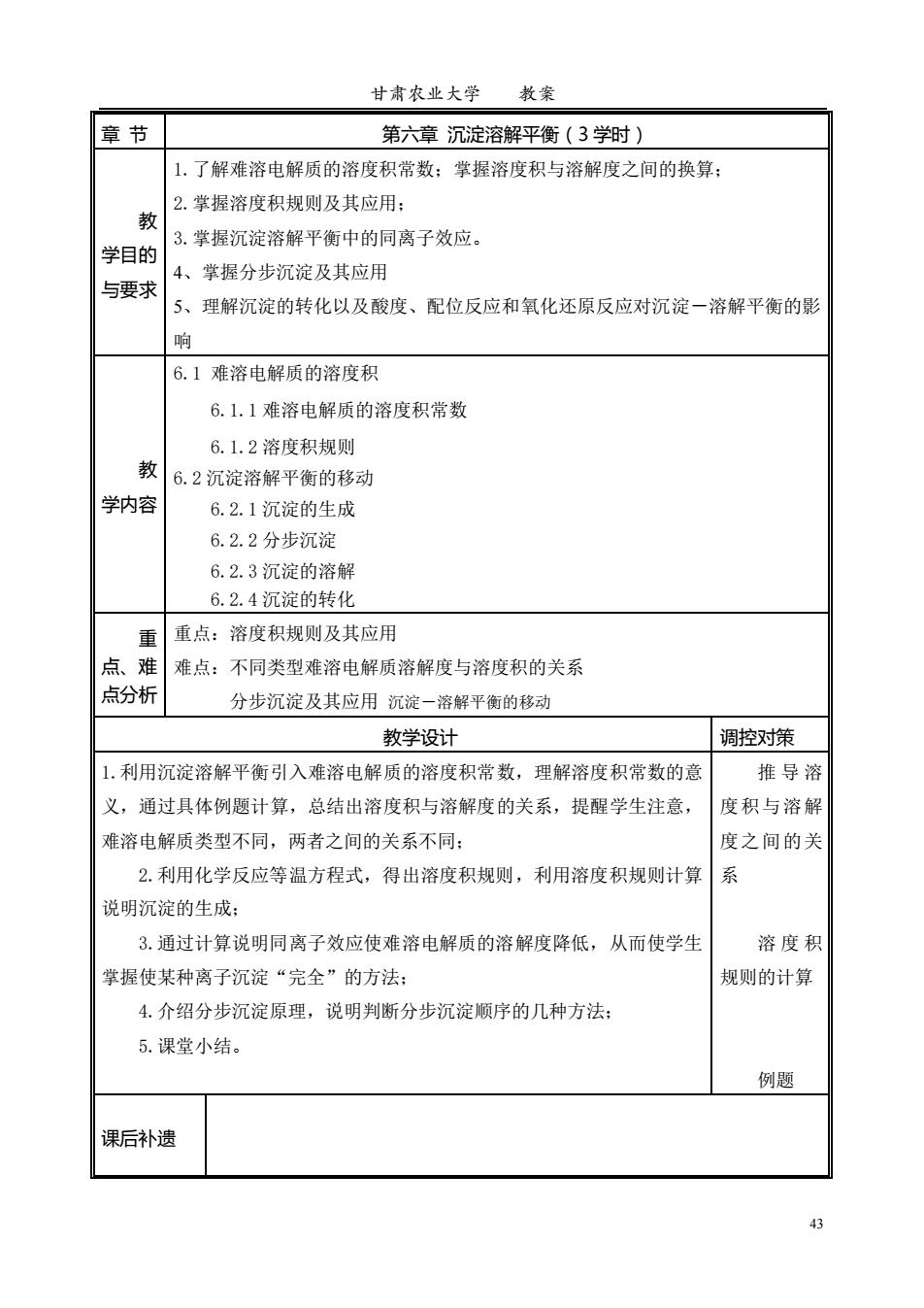
甘肃农业大学 教案 章节 第六章沉淀溶解平衡(3学时) 1.了解难溶电解质的溶度积常数:掌握溶度积与溶解度之间的换算: 2.掌握溶度积规则及其应用: 教 3.掌握沉淀溶解平衡中的同离子效应。 学目的 4、掌握分步沉淀及其应用 与要求 5、理解沉淀的转化以及酸度、配位反应和氧化还原反应对沉淀一溶解平衡的影 响 6.1难溶电解质的溶度积 6.1.1难溶电解质的溶度积常数 6.1.2溶度积规则 教 6.2沉淀溶解平衡的移动 学内容 6.2.1沉淀的生成 6.2.2分步沉淀 6.2.3沉淀的溶解 6.2.4沉淀的转化 重 重点:溶度积规则及其应用 点、难 难点:不同类型难溶电解质溶解度与溶度积的关系 点分析 分步沉淀及其应用沉淀一溶解平衡的移动 教学设计 调控对策 1.利用沉淀溶解平衡引入难溶电解质的溶度积常数,理解溶度积常数的意 推导溶 义,通过具体例题计算,总结出溶度积与溶解度的关系,提醒学生注意, 度积与溶解 难溶电解质类型不同,两者之间的关系不同: 度之间的关 2.利用化学反应等温方程式,得出溶度积规则,利用溶度积规则计算 系 说明沉淀的生成: 3.通过计算说明同离子效应使难溶电解质的溶解度降低,从而使学生 溶度积 掌握使某种离子沉淀“完全”的方法; 规则的计算 4.介绍分步沉淀原理,说明判断分步沉淀顺序的几种方法: 5.课堂小结。 例题 课后补遗 43
甘肃农业大学 教案 43 章 节 第六章 沉淀溶解平衡(3 学时) 教 学目的 与要求 1.了解难溶电解质的溶度积常数;掌握溶度积与溶解度之间的换算; 2.掌握溶度积规则及其应用; 3.掌握沉淀溶解平衡中的同离子效应。 4、掌握分步沉淀及其应用 5、理解沉淀的转化以及酸度、配位反应和氧化还原反应对沉淀-溶解平衡的影 响 教 学内容 6.1 难溶电解质的溶度积 6.1.1 难溶电解质的溶度积常数 6.1.2 溶度积规则 6.2 沉淀溶解平衡的移动 6.2.1 沉淀的生成 6.2.2 分步沉淀 6.2.3 沉淀的溶解 6.2.4 沉淀的转化 重 点、难 点分析 重点:溶度积规则及其应用 难点:不同类型难溶电解质溶解度与溶度积的关系 分步沉淀及其应用 沉淀-溶解平衡的移动 教学设计 调控对策 1.利用沉淀溶解平衡引入难溶电解质的溶度积常数,理解溶度积常数的意 义,通过具体例题计算,总结出溶度积与溶解度的关系,提醒学生注意, 难溶电解质类型不同,两者之间的关系不同; 2.利用化学反应等温方程式,得出溶度积规则,利用溶度积规则计算 说明沉淀的生成; 3.通过计算说明同离子效应使难溶电解质的溶解度降低,从而使学生 掌握使某种离子沉淀“完全”的方法; 4.介绍分步沉淀原理,说明判断分步沉淀顺序的几种方法; 5.课堂小结。 推导溶 度积与溶解 度之间的关 系 溶度积 规则的计算 例题 课后补遗

甘肃农业大学 教案 教学过程 批注 一复习导入新课(5分钟) 总结前几节所学内容,提问:如果反应中有沉淀形成如何计算体系中各组分的浓度 一一设疑引出 而引出所讲新内容。 二讲授新内容 第六章沉淀溶解平衡 一一板书 6.1难溶电解质的溶度积 所谓难溶电解质只是指溶解度很小而己。在一定温度下,当沉淀速率和溶解速率相 一一叙述内容 一一板书 等时,就达到了沉淀溶解平衡。K。是难溶电解质沉淀溶解平衡常数,称为溶度积常数, 简称溶度积。它表明在一定温度下,不论各有关离子浓度如何变化,其乘积是一个常数。 举例 。的大小表示难溶电解质自身的溶解趋势,而与沉淀的量及离子的浓度变化无关。 溶度积也和其它化学平衡常数一样,随温度的升高而增大,但温度的影响并不显著。 溶度积和溶解度s可以互相换算,换算时必须注意浓度单位,要把溶解度的单位换 算成物质的量浓度单位(即moldm-3)。 一一板书 AB型难溶电解质 s/=Ke 一一板书 AB型或AB2型难溶电解质 s/co= 一一同理,让学 AB型或AB型难溶电解质 生自己推出 AB2型或AB,型难溶电解质 一一举例说明 注意:这些关系式只适合于难溶电解质溶于水后的阴、阳离子在水中不发生任何副反应。 用应用条件 根据有关热力学公式,沉淀溶解反应的标准自由能变与标准溶度积常数的关系可表示 为: 一板书 △.68--Rmn9=-2.3031gMe 一一板书 6.1.2溶度积规则 根据化学反应等温式 一一板书,引导 △.G=RTln 0 同学们应用该 式判断方程进 行的方向,进而 式中:¢[c(A)/c][c(B)/c]”,Q表示难溶电解质溶液中离子浓度以其计量 总结出溶度积 系数为乘幂的乘积,也称离子积。 规则 利用离子积Q与平衡常数的相互关系,就能够判断反应进行的方向。 44
甘肃农业大学 教案 教 学 过 程 批 注 44 一 复习导入新课(5 分钟) 总结前几节所学内容,提问:如果反应中有沉淀形成如何计算体系中各组分的浓度 而引出所讲新内容。 二 讲授新内容 第六章 沉淀溶解平衡 6.1 难溶电解质的溶度积 所谓难溶电解质只是指溶解度很小而已。在一定温度下,当沉淀速率和溶解速率相 等时,就达到了沉淀溶解平衡。K θ sp 是难溶电解质沉淀溶解平衡常数,称为溶度积常数, 简称溶度积。它表明在一定温度下,不论各有关离子浓度如何变化,其乘积是一个常数。 K θ sp 的大小表示难溶电解质自身的溶解趋势,而与沉淀的量及离子的浓度变化无关。 溶度积也和其它化学平衡常数一样,随温度的升高而增大,但温度的影响并不显著。 溶度积和溶解度 s 可以互相换算,换算时必须注意浓度单位,要把溶解度的单位换 算成物质的量浓度单位(即 mol∙dm-3 )。 AB 型难溶电解质 s/ c Ө = θ Ksp A2B 型或 AB2 型难溶电解质 s/ c Ө = 3 4 θ Ksp A3B 型或 AB3 型难溶电解质 s/ c Ө = 4 27 θ Ksp A3B2 型或 A2B3 型难溶电解质 s/ c Ө = 5 108 θ Ksp 注意:这些关系式只适合于难溶电解质溶于水后的阴、阳离子在水中不发生任何副反应。 根据有关热力学公式,沉淀溶解反应的标准自由能变与标准溶度积常数的关系可表示 为: △rG θ m = -RTln K θ sp =-2.303lg K θ sp 6.1.2 溶度积规则 根据化学反应等温式 △rGm = θ sp ln K Q RT 式中: Q= [c (An+)/ c Ө ] m [c (Bn- ) / c Ө ] n ,Q 表示难溶电解质溶液中离子浓度以其计量 系数为乘幂的乘积,也称离子积。 利用离子积 Q 与平衡常数 K θ sp 的相互关系,就能够判断反应进行的方向。 ――设疑引出 ――板书 ――叙述内容 ――板书 举例 ――板书 ――板书 ――同理,让学 生自己推出 ― ― 举例 说 明 用应用条件 ――板书 ――板书 ――板书,引导 同 学 们应 用 该 式 判 断方 程 进 行的方向,进而 总 结 出溶 度 积 规则

甘肃农业大学 教案 教学过程 批注 当Q=。△.G=0,沉淀溶解处于平衡状态,体系为饱和溶液, 一板书 Q0,过饱和溶液,反应向生成沉淀的方向进行,直至达到饱和状态。 以上结论称为溶度积规则,掌握和应用这个规则,就可以判断沉淀的生成和溶解的 一一通过举例, 可能性,从而创造条件,控制反应的方向,达到预期的目的。 要求熟练掌握 6.2沉淀溶解平衡的移动 6.2.1沉淀的生成 如果加入与难溶电解质有相同离子的强电解质时,则难溶电解质的溶解度降低,这 一一根据平衡 种现象也称为同离子效应。应用同离子效应,适当地增加沉淀剂的用量,可以有效降低 的特点启发同 被沉淀离子的残留浓度,使被沉淀离子沉淀“完全”。所谓沉淀“完全”是指沉淀反应 学正确理解“完 全”沉淀的意义 完成之后,被沉淀离子的浓度≤1.0×105 mol-dm3。 在实际应用中,为了使沉淀尽可能完全,都要加入过量的沉淀剂。一般沉淀剂过量 一一板书 10%~20%为宜,沉淀剂过量太多,会由于盐效应或配位效应(形成络离子而溶解)而 一一通过举例, 使沉淀的溶解度增大。 采用对比的方 6.2.2分步沉淀 法 如果溶液中含有两种或两种以上的离子,加入某种沉淀剂后,这些离子都能和沉淀 剂反应生成沉淀,这些离子并非同时沉淀,而是按一定的顺序分先后依次析出沉淀。这 一一溶度积规 种先后析出沉淀的现象叫分步沉淀。开始沉淀时需要的沉淀剂的量小,先沉淀。 则的应用 6.2.3沉淀的溶解 根据溶度积规则,要使沉淀溶解,就必须使<。,因此,只要创造一定的条件, 一一举例说明 并反复强调,总 降低难溶电解质饱和溶液中离子的浓度,就能够达到沉淀溶解的目的。通常采用以下几 结出解该类题 种方法。 的方法 1生成弱电解质或气体使沉淀溶解 一一板书 2.通过发生氧化还原反应使沉淀溶解 3.生成络合物使沉淀溶解 一一举例 5.6.5沉淀的转化 这种由一种沉淀转化成另一种沉淀的过程称为沉淀的转化。沉淀转化的难易程度取 决于这两种沉淀的溶解度,一般情况下,溶解度大的比较容易转化成溶解度小的,而且 两者的溶解度相差越大,转化过程越容易。 三.小结:(3分钟) (1)溶度积的意义,溶度积与溶解度的换算: (2)沉淀生成与溶解的条件: (3)分步沉淀及其应用: 四.布置作业: 板书设计 主板 副板 第六节难溶电解质的沉淀溶解平衡 5.6.1难溶电解质的溶度积 方程 45
甘肃农业大学 教案 教 学 过 程 批 注 45 当 Q=K θ sp △rGm=0,沉淀溶解处于平衡状态,体系为饱和溶液, Q<K θ sp △rGm<0,未饱和溶液,反应向沉淀溶解的方向进行,直至达到饱和状态。 Q>K θ sp △rGm>0,过饱和溶液,反应向生成沉淀的方向进行,直至达到饱和状态。 以上结论称为溶度积规则,掌握和应用这个规则,就可以判断沉淀的生成和溶解的 可能性,从而创造条件,控制反应的方向,达到预期的目的。 6.2 沉淀溶解平衡的移动 6.2.1 沉淀的生成 如果加入与难溶电解质有相同离子的强电解质时,则难溶电解质的溶解度降低,这 种现象也称为同离子效应。应用同离子效应,适当地增加沉淀剂的用量,可以有效降低 被沉淀离子的残留浓度,使被沉淀离子沉淀“完全”。所谓沉淀“完全”是指沉淀反应 完成之后,被沉淀离子的浓度≤1.0×10-5 mol∙dm-3。 在实际应用中,为了使沉淀尽可能完全,都要加入过量的沉淀剂。一般沉淀剂过量 10%~20%为宜,沉淀剂过量太多,会由于盐效应或配位效应(形成络离子而溶解)而 使沉淀的溶解度增大。 6.2.2 分步沉淀 如果溶液中含有两种或两种以上的离子,加入某种沉淀剂后,这些离子都能和沉淀 剂反应生成沉淀,这些离子并非同时沉淀,而是按一定的顺序分先后依次析出沉淀。这 种先后析出沉淀的现象叫分步沉淀。开始沉淀时需要的沉淀剂的量小,先沉淀。 6.2.3 沉淀的溶解 根据溶度积规则,要使沉淀溶解,就必须使 Q<K θ sp ,因此,只要创造一定的条件, 降低难溶电解质饱和溶液中离子的浓度,就能够达到沉淀溶解的目的。通常采用以下几 种方法。 1 生成弱电解质或气体使沉淀溶解 2.通过发生氧化还原反应使沉淀溶解 3.生成络合物使沉淀溶解 5.6.5 沉淀的转化 这种由一种沉淀转化成另一种沉淀的过程称为沉淀的转化。沉淀转化的难易程度取 决于这两种沉淀的溶解度,一般情况下,溶解度大的比较容易转化成溶解度小的,而且 两者的溶解度相差越大,转化过程越容易。 三.小结:(3 分钟) (1)溶度积的意义,溶度积与溶解度的换算; (2)沉淀生成与溶解的条件; (3)分步沉淀及其应用; 四.布置作业: 板书设计 主板 副板 第六节 难溶电解质的沉淀溶解平衡 5.6.1 难溶电解质的溶度积 方程 ――板书 ――通过举例, 要求熟练掌握 ― ― 根据 平 衡 的 特 点启 发 同 学正确理解“完 全”沉淀的意义 ――板书 ――通过举例, 采 用 对比 的 方 法 ― ― 溶度 积 规 则的应用 - - 举例 说 明 并反复强调,总 结 出 解该 类 题 的方法 ――板书 ――举例

甘肃农业大学 教案 教学过程 批注 5.6.2沉淀的生成 例题 5.6.3分步沉淀 例题 5.6.4沉淀的溶解 例题 5.6.5沉淀的转化 46
甘肃农业大学 教案 教 学 过 程 批 注 46 5.6.2 沉淀的生成 例题 5.6.3 分步沉淀 例题 5.6.4 沉淀的溶解 例题 5.6.5 沉淀的转化