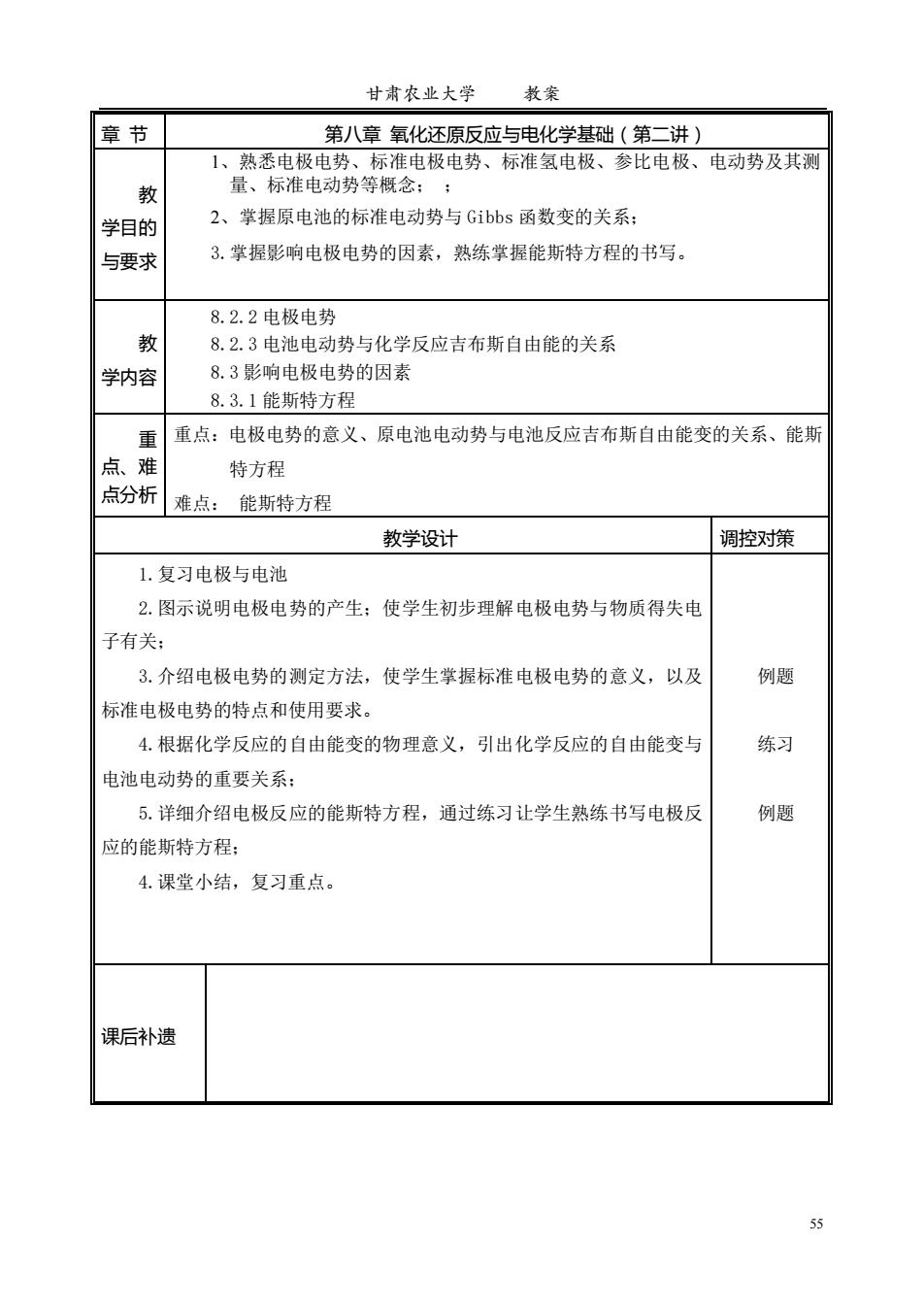
甘肃农业大学 教案 章节 第八章氧化还原反应与电化学基础(第二讲) 1、熟悉电极电势、标准电极电势、标准氢电极、参比电极、电动势及其测 教 量、标准电动势等概念;; 学目的 2、掌握原电池的标准电动势与Gibbs函数变的关系: 与要求 3.掌握影响电极电势的因素,熟练掌握能斯特方程的书写。 8.2.2电极电势 教 8.2.3电池电动势与化学反应吉布斯自由能的关系 学内容 8.3影响电极电势的因素 8.3.1能斯特方程 重 重点:电极电势的意义、原电池电动势与电池反应吉布斯自由能变的关系、能斯 点、难 特方程 点分析 难点: 能斯特方程 教学设计 调控对策 1.复习电极与电池 2.图示说明电极电势的产生:使学生初步理解电极电势与物质得失电 子有关: 3.介绍电极电势的测定方法,使学生掌握标准电极电势的意义,以及 例题 标准电极电势的特点和使用要求。 4.根据化学反应的自由能变的物理意义,引出化学反应的自由能变与 练习 电池电动势的重要关系 5.详细介绍电极反应的能斯特方程,通过练习让学生熟练书写电极反 例题 应的能斯特方程: 4.课堂小结,复习重点。 课后补遗 55
甘肃农业大学 教案 55 章 节 第八章 氧化还原反应与电化学基础(第二讲) 教 学目的 与要求 1、熟悉电极电势、标准电极电势、标准氢电极、参比电极、电动势及其测 量、标准电动势等概念; ; 2、掌握原电池的标准电动势与 Gibbs 函数变的关系; 3.掌握影响电极电势的因素,熟练掌握能斯特方程的书写。 教 学内容 8.2.2 电极电势 8.2.3 电池电动势与化学反应吉布斯自由能的关系 8.3 影响电极电势的因素 8.3.1 能斯特方程 重 点、难 点分析 重点:电极电势的意义、原电池电动势与电池反应吉布斯自由能变的关系、能斯 特方程 难点: 能斯特方程 教学设计 调控对策 1.复习电极与电池 2.图示说明电极电势的产生;使学生初步理解电极电势与物质得失电 子有关; 3.介绍电极电势的测定方法,使学生掌握标准电极电势的意义,以及 标准电极电势的特点和使用要求。 4.根据化学反应的自由能变的物理意义,引出化学反应的自由能变与 电池电动势的重要关系; 5.详细介绍电极反应的能斯特方程,通过练习让学生熟练书写电极反 应的能斯特方程; 4.课堂小结,复习重点。 例题 练习 例题 课后补遗

甘肃农业大学 教案 教学过程 批注 导入新课(5分钟) 复习上节课内容承上启下导入新课。 二讲授新课 8.2.2电极电势 8.2.2.1电极电势的产生 一一板书 双电层的产生使金属表面与含金属离子的溶液间产生一定的电位差,这个电位差 一一以锌电极为 称为“金属的平衡电势”,又叫作金属的“电极电势”()。它除了与金属的本质和溶 例简要介绍电极 液中金属离子的浓度有关外,还与温度等有关。当金属的活泼性越强或溶液中金属离子 电势的产生 的浓度较小时,溶解的趋势越大,平衡时电极电势越低。金属越不活泼或溶液中金属离 一一要同学掌握 子的浓度较大时,沉积的趋势越大,平衡时电极电势越高。 离子浓度金属活 由于原电池的两极间存在电势差,电路联通后电子由电势低的负极流向电势高的正 泼性与电极电势 极。原电池两极间的电势差称为“电池电动势(ε)”,并规定: 的关系 ε=0w-9(-) 一板书 8.2.2.2标准电极电势 一一介绍标准 1标准氢电极(SHE)E9(H/H)=0.000V 氢电极的组成 2饱和甘汞电极(SCE)Ee(Hg2Cl2/Hg)=0.2415V 3标准电极电势表 在表中按电极电势由小到大排列。电对E值的大小决定了电对氧化还原能力的相 一一举例 对强弱,E值越大,电对中氧化态的氧化能力越强,还原态的还原能力越弱:相反E© 值越小,还原态的还原能力越强,氧化态的氧化能力越弱。 在使用电极电势表时要注意以下几点: (1)在应用E时,注意它只适用于在标准状态下水溶液中进行的反应。对固相或 一一举例并反 气相中进行的氧化还原反应,不能判断氧化还原能力的相对强弱。 复强调注意事 (2)因反应与溶液的介质有关,所以电极电势表分为酸介质表EA,碱介质表E项 B,使用时应注意反应的介质。若电极反应中有H或不受介质影响的电极反应的电极 电势,则查EA表,相反若电极反应中有OH,则查EB表。 (3)电极电势的负值,表明当该电极与标准氢电极相连时,做为负极。正值表明 该电极与标准氢电极相连时,做为正极。这里的正与负是相对于标准氢电极而言。 (4)表中的电极反应以还原反应表示,即:a氧化态+心三b还原型,电对 符号为氧化态/还原态,相应的电极电势称还原电势,但不表明电极反应进行的方向。 (5)E是强度性质,与反应方程式的书写无关。 8.2.3原电池的电动势与原电池反应的自由能变化 W电=Q·c 一一板书 W电=nFe 一一举例 式中,F=96500Cmo1,称为法拉第常数,物理意义是1mol电子所带电量为96500 库仑(C)。 原电池放电后,体系的自由能降低。根据化学热力学原理,在等温等压条件下原电 池体系自由能的降低值等于其能对外所做之最大电功。故等温等压条件下原电池反应完 成lmol时: △G(原电池)=-W电=-nFe 一一举例 若原电池中各物质都处于标准态下,即反应物浓度均为1modm3,各气体分压均 为1.013×10Pa,则: 56
甘肃农业大学 教案 教 学 过 程 批 注 56 一 导入新课(5 分钟) 复习上节课内容承上启下导入新课。 二 讲授新课 8.2.2 电极电势 8.2.2.1 电极电势的产生 双电层的产生使金属表面与含金属离子的溶液间产生一定的电位差φ,这个电位差 称为“金属的平衡电势”,又叫作金属的“电极电势”(φ)。它除了与金属的本质和溶 液中金属离子的浓度有关外,还与温度等有关。当金属的活泼性越强或溶液中金属离子 的浓度较小时,溶解的趋势越大,平衡时电极电势越低。金属越不活泼或溶液中金属离 子的浓度较大时,沉积的趋势越大,平衡时电极电势越高。 由于原电池的两极间存在电势差,电路联通后电子由电势低的负极流向电势高的正 极。原电池两极间的电势差称为“电池电动势(ε)”,并规定: ε =φ(+)-φ(-) 8.2.2.2 标准电极电势 1 标准氢电极(SHE) E θ(H+ /H2)=0.000 V 2 饱和甘汞电极(SCE)E θ(Hg2Cl2/Hg)=0.2415 V 3 标准电极电势表 在表中按电极电势由小到大排列。电对 E θ值的大小决定了电对氧化还原能力的相 对强弱,E θ值越大,电对中氧化态的氧化能力越强,还原态的还原能力越弱;相反 E θ 值越小,还原态的还原能力越强,氧化态的氧化能力越弱。 在使用电极电势表时要注意以下几点: (1)在应用 E θ时,注意它只适用于在标准状态下水溶液中进行的反应。对固相或 气相中进行的氧化还原反应,不能判断氧化还原能力的相对强弱。 (2)因反应与溶液的介质有关,所以电极电势表分为酸介质表 E θ A,碱介质表 E θ B,使用时应注意反应的介质。若电极反应中有 H+或不受介质影响的电极反应的电极 电势,则查 E θ A 表,相反若电极反应中有 OH - ,则查 E θ B表。 (3)电极电势的负值,表明当该电极与标准氢电极相连时,做为负极。正值表明 该电极与标准氢电极相连时,做为正极。这里的正与负是相对于标准氢电极而言。 (4)表中的电极反应以还原反应表示,即:a 氧化态 + ne - b 还原型,电对 符号为氧化态/还原态,相应的电极电势称还原电势,但不表明电极反应进行的方向。 (5) E θ是强度性质,与反应方程式的书写无关。 8.2.3 原电池的电动势与原电池反应的自由能变化 W 电 = Q·ε W 电 = nFε 式中,F = 96500C∙mol-1,称为法拉第常数,物理意义是 1 mol 电子所带电量为 96500 库仑(C)。 原电池放电后,体系的自由能降低。根据化学热力学原理,在等温等压条件下原电 池体系自由能的降低值等于其能对外所做之最大电功。故等温等压条件下原电池反应完 成 lmol 时: ∆G(原电池) = -W 电= -nFε 若原电池中各物质都处于标准态下,即反应物浓度均为 1 mol∙dm-3 , 各气体分压均 为 1.013×105Pa,则: ――板书 ――以锌电极为 例简要介绍电极 电势的产生 ――要同学掌握 离子浓度金属活 泼性与电极电势 的关系 --板书 ― ― 介绍 标 准 氢电极的组成 ――举例 ― ― 举例 并 反 复 强 调注 意 事 项 ――板书 ――举例 ――举例

甘肃农业大学 教案 教学过程 批注 △G(原电池)=-nFe9 8.3影响电极电势的因素 8.3.1能斯特方程 能斯特方程描述了非标准状态下电极电势与电基本型、系统浓度、酸度和温度之间 一一多举例 的定量关系。 练习 三.小结:(3分钟) (1)电极电势的产生: (2)标准电极电势: (3)标准电极电势的应用。 4能斯特方程 四.布置作业: 板书设计 主板 副板 8.2.2电极电势与电池电动势 8.2.2.1电极电势的产生 8.2.2.2标准电极电势 1标准氢电极(SHE)E(HH)= 0.000V 2饱和甘汞电极(SCE)Ee(Hg2C1/Hg) =0.2415V (a) (b) 3标准电极电势表 图6-2金属的电极电势(双电层示意) 8.2.3原电池的电动势与原电池反应的自由能变化 △G9(原电池)=-nFe9 8.3影响电极电势的因素 8.3.1能斯特方程 57
甘肃农业大学 教案 教 学 过 程 批 注 57 (a) (b) 图 6-2 金属的电极电势 (双电层示意) ∆G θ(原电池) = -nFε θ 8.3 影响电极电势的因素 8.3.1 能斯特方程 能斯特方程描述了非标准状态下电极电势与电基本型、系统浓度、酸度和温度之间 的定量关系。 三.小结:(3 分钟) (1)电极电势的产生; (2)标准电极电势; (3)标准电极电势的应用。 4 能斯特方程 四.布置作业: 板书设计 主板 副板 8.2.2 电极电势与电池电动势 8.2.2.1 电极电势的产生 8.2.2.2 标准电极电势 1 标准氢电极(SHE) E θ(H+ /H2)= 0.000 V 2 饱和甘汞电极(SCE)E θ(Hg2Cl2/Hg) =0.2415 V 3 标准电极电势表 8.2.3 原电池的电动势与原电池反应的自由能变化 ∆G θ(原电池) = -nFε θ 8.3 影响电极电势的因素 8.3.1 能斯特方程 ――多举例 练 习