
高等学校食品专业教学参考资料 《食 品 化 学》 实 验 指 导 书 (第二版) 武汉工业学院食品科学与工程学院 食品化学课程组 二 00 五年九月 前 言 本讲义是食品化学和食品品质分析的实验指导书。食品化学实验和食品品质分析是检测 和评价粮油食品品质的一门学科,是食品专业的一门主干课程。此讲义内容主要包括:物理 检验、化学成分分析、粮食分析、油脂分析、食用品质及理化特性测定。所有的实验对深入 理解食品化学得基础理论,对从事食品行业的生产,管理和科学研究均有重要得意义。 本实验指导书根据大纲的要求,在第一版得基础上,增加和减少了部分实验内容。本指 导书由胡小泓高级实验师主编,黄泽元教授审定。 由于时间和编写者水平的关系,不妥之处,请读者给予批评指正。 编 者 2005 年 6 月
高等学校食品专业教学参考资料 《食 品 化 学》 实 验 指 导 书 (第二版) 武汉工业学院食品科学与工程学院 食品化学课程组 二 00 五年九月 前 言 本讲义是食品化学和食品品质分析的实验指导书。食品化学实验和食品品质分析是检测 和评价粮油食品品质的一门学科,是食品专业的一门主干课程。此讲义内容主要包括:物理 检验、化学成分分析、粮食分析、油脂分析、食用品质及理化特性测定。所有的实验对深入 理解食品化学得基础理论,对从事食品行业的生产,管理和科学研究均有重要得意义。 本实验指导书根据大纲的要求,在第一版得基础上,增加和减少了部分实验内容。本指 导书由胡小泓高级实验师主编,黄泽元教授审定。 由于时间和编写者水平的关系,不妥之处,请读者给予批评指正。 编 者 2005 年 6 月

目 录 实验一 水分含量的测定.3 实验二 水分活度值的测定.7 实验三 食品中还原糖的测定. 11 实验四 食品中蔗糖的测定. 14 实验五 食品淀粉的测定. 18 实验六 方便食品中淀粉 α-化程度的测定. 21 实验七 淀粉糊化度、老化度的测定. 23 实验八 粗纤维素的测定. 26 实验九 食物中不溶性膳食纤维的测定. 28 实验十 脂肪酸值的测定. 31 实验十一 面包酸度的测定. 33 实验十二 挂面酸值的测定. 34 实验十三 固态食品比容的测定. 35 实验十四 油脂透明度的检验. 37 实验十五 油脂色泽的检验. 37 实验十六 油脂气味、滋味检验. 40 实验十七 油脂的比重测定. 41 实验十八 油脂折光指数的测定. 45 实验十九 油脂熔点的测定. 47 实验二十 脂肪酸凝固点的测定. 48 实验二十一 油脂粘度的测定. 49 实验二十二 油脂水份及挥发物的测定. 51 实验二十三 油脂杂质含量的测定. 53 实验二十四 油脂酸价的测定. 55 实验二十五 油脂加热试验. 57 实验二十六 油脂碘价的测定. 58 实验二十七 油脂皂化价的测定. 61 实验二十八 油脂不皂化物的测定. 62 实验二十九 油脂含皂量的测定. 64 实验三十 油脂过氧化值的测定. 65 实验三十一 油脂磷脂含量的测定. 67 实验三十二 油脂酸败定性试验. 71 实验三十三 氨基酸总量的测定(甲醛法). 71 实验三十四 食品中蛋白质的测定. 73 实验三十五 粗脂肪含量的测定. 77 实验三十六 多酚类物质总量测定. 80 实验三十七 维生素 C 含量的测定. 81 实验三十八 食品中灰分的测定. 83 实验三十九 铁的测定. 86 实验四十 淀粉酶活力的测定. 88 实验四十一 蛋白酶活力的测定. 93 实验四十二 果胶酶活力的测定. 96 实验四十三 酶制剂在食品加工中的应用研究试验. 98 实验四十四 食品酶促褐变的控制. 99 实验四十五 单宁含量的测定(滴定法). 100 实验四十六 叶绿素含量的测定(比色法). 101 实验四十七 总胡萝卜素的测定(比色法). 102 实验四十八 软饮料中可溶性固形物的测定(折光计法) 104 实验四十九 绿色蔬菜的护绿试验. 108
目 录 实验一 水分含量的测定.3 实验二 水分活度值的测定.7 实验三 食品中还原糖的测定. 11 实验四 食品中蔗糖的测定. 14 实验五 食品淀粉的测定. 18 实验六 方便食品中淀粉 α-化程度的测定. 21 实验七 淀粉糊化度、老化度的测定. 23 实验八 粗纤维素的测定. 26 实验九 食物中不溶性膳食纤维的测定. 28 实验十 脂肪酸值的测定. 31 实验十一 面包酸度的测定. 33 实验十二 挂面酸值的测定. 34 实验十三 固态食品比容的测定. 35 实验十四 油脂透明度的检验. 37 实验十五 油脂色泽的检验. 37 实验十六 油脂气味、滋味检验. 40 实验十七 油脂的比重测定. 41 实验十八 油脂折光指数的测定. 45 实验十九 油脂熔点的测定. 47 实验二十 脂肪酸凝固点的测定. 48 实验二十一 油脂粘度的测定. 49 实验二十二 油脂水份及挥发物的测定. 51 实验二十三 油脂杂质含量的测定. 53 实验二十四 油脂酸价的测定. 55 实验二十五 油脂加热试验. 57 实验二十六 油脂碘价的测定. 58 实验二十七 油脂皂化价的测定. 61 实验二十八 油脂不皂化物的测定. 62 实验二十九 油脂含皂量的测定. 64 实验三十 油脂过氧化值的测定. 65 实验三十一 油脂磷脂含量的测定. 67 实验三十二 油脂酸败定性试验. 71 实验三十三 氨基酸总量的测定(甲醛法). 71 实验三十四 食品中蛋白质的测定. 73 实验三十五 粗脂肪含量的测定. 77 实验三十六 多酚类物质总量测定. 80 实验三十七 维生素 C 含量的测定. 81 实验三十八 食品中灰分的测定. 83 实验三十九 铁的测定. 86 实验四十 淀粉酶活力的测定. 88 实验四十一 蛋白酶活力的测定. 93 实验四十二 果胶酶活力的测定. 96 实验四十三 酶制剂在食品加工中的应用研究试验. 98 实验四十四 食品酶促褐变的控制. 99 实验四十五 单宁含量的测定(滴定法). 100 实验四十六 叶绿素含量的测定(比色法). 101 实验四十七 总胡萝卜素的测定(比色法). 102 实验四十八 软饮料中可溶性固形物的测定(折光计法) 104 实验四十九 绿色蔬菜的护绿试验. 108

实验五十 维生素 P(黄酮类)含量的测定. 109 实验五十一 食品中总酸的测定.110 实验五十二 香肠中亚硝酸盐含量的测定.115 实验五十三 酱油中氨基酸态氮含量的测定.117 实验五十四 综合及创新实验.118 第一法 常压干燥法 实验一 水分含量的测定 一、实验原理 试样经磨碎、混匀后,在常压 103℃±2℃的恒温干燥箱内加热至恒重。加热前后的质 量差即为水分含量。此法适用于谷物及其制品、淀粉及其制品、调味品、水产品、豆制品、 乳制品、肉制品、发酵制品和酱腌菜等食品中水分的测定。 二、仪器与设备 分析天平(感量 0.1mg)、组织捣碎机、研钵、具盖铝皿(内径 75~80mm,高 30~35mm)、 铰肉机(蓖孔径不超过 4mm)、电热鼓风干燥箱(温控 103℃±2℃)、干燥器(内盛有效干 燥剂)、多用切碎机。 三、操作步骤 1.试样的制备 (1) 固体样品:取有代表性的样品至少 200g,用研钵捣碎、研细,混合均匀,置于密 闭玻璃容器内;不易捣碎、研细的样品,用切碎机切成细粒、置于密闭玻璃容器内。 (2) 粉状样品:取有代表性的样品至少 200g(如粉粒较大也应用研钵研细),混合均 匀,置于密闭玻璃容器内。 (3) 糊状样品:取有代表性的样品至少 200g,混合均匀,置于密闭玻璃容器内。 (4) 固液体样品:按固、液体比例,取有代表性的样品至 200g,用组织捣碎机捣碎, 混合均匀,置于密闭玻璃容器内。 (5) 肉制品:取去除去不可食部分、具有代表性的样品至少 200g,用铰肉机至少铰两 次,混合均匀,置于密闭玻璃容器内。 2.测定 将洁净的铝皿连同皿盖置于 103℃±2℃鼓风电热恒温干燥箱内,加热 1h,如盖取出, 置于干燥器内冷却至室温,称量(精确至 0.001g)。 称取约 5g 试样,精确至 0.001g,于上述巳知恒重的铝皿中,置于 103℃±2℃的鼓风电 热恒温干燥箱内(皿盖斜放在皿边),加热 2~4h,加盖取出。在干燥器内冷却 0.5h,称量。 再烘 1h,称量,直至连续两次称量差不超过 0.002g,即为恒重。以最小称量为准。 含水量大于 20%的试样,称取试样后先置于 70~85℃的鼓风电热恒温干燥箱内,加热 2~4h,然后升温至 103℃±2℃,按上述步骤操作。 四、结果计算 其测定结果按下式计算: m1-m2 水分(%)= ×100 m 式中:m1 试样和铝皿烘烤前的质量,g; m2 试样和铝皿烘烤后的质量,g; m 试样的质量,g; 计算结果精确至小数点后第一位。同一样品的两次测定值之差,每 100g 试样不得超过 0.2g。 五、注意事项 1.水果、蔬菜样品,应先洗去泥沙后,再用蒸馏水冲洗一次,然后用洁净纱布吸干表 面的水分
实验五十 维生素 P(黄酮类)含量的测定. 109 实验五十一 食品中总酸的测定.110 实验五十二 香肠中亚硝酸盐含量的测定.115 实验五十三 酱油中氨基酸态氮含量的测定.117 实验五十四 综合及创新实验.118 第一法 常压干燥法 实验一 水分含量的测定 一、实验原理 试样经磨碎、混匀后,在常压 103℃±2℃的恒温干燥箱内加热至恒重。加热前后的质 量差即为水分含量。此法适用于谷物及其制品、淀粉及其制品、调味品、水产品、豆制品、 乳制品、肉制品、发酵制品和酱腌菜等食品中水分的测定。 二、仪器与设备 分析天平(感量 0.1mg)、组织捣碎机、研钵、具盖铝皿(内径 75~80mm,高 30~35mm)、 铰肉机(蓖孔径不超过 4mm)、电热鼓风干燥箱(温控 103℃±2℃)、干燥器(内盛有效干 燥剂)、多用切碎机。 三、操作步骤 1.试样的制备 (1) 固体样品:取有代表性的样品至少 200g,用研钵捣碎、研细,混合均匀,置于密 闭玻璃容器内;不易捣碎、研细的样品,用切碎机切成细粒、置于密闭玻璃容器内。 (2) 粉状样品:取有代表性的样品至少 200g(如粉粒较大也应用研钵研细),混合均 匀,置于密闭玻璃容器内。 (3) 糊状样品:取有代表性的样品至少 200g,混合均匀,置于密闭玻璃容器内。 (4) 固液体样品:按固、液体比例,取有代表性的样品至 200g,用组织捣碎机捣碎, 混合均匀,置于密闭玻璃容器内。 (5) 肉制品:取去除去不可食部分、具有代表性的样品至少 200g,用铰肉机至少铰两 次,混合均匀,置于密闭玻璃容器内。 2.测定 将洁净的铝皿连同皿盖置于 103℃±2℃鼓风电热恒温干燥箱内,加热 1h,如盖取出, 置于干燥器内冷却至室温,称量(精确至 0.001g)。 称取约 5g 试样,精确至 0.001g,于上述巳知恒重的铝皿中,置于 103℃±2℃的鼓风电 热恒温干燥箱内(皿盖斜放在皿边),加热 2~4h,加盖取出。在干燥器内冷却 0.5h,称量。 再烘 1h,称量,直至连续两次称量差不超过 0.002g,即为恒重。以最小称量为准。 含水量大于 20%的试样,称取试样后先置于 70~85℃的鼓风电热恒温干燥箱内,加热 2~4h,然后升温至 103℃±2℃,按上述步骤操作。 四、结果计算 其测定结果按下式计算: m1-m2 水分(%)= ×100 m 式中:m1 试样和铝皿烘烤前的质量,g; m2 试样和铝皿烘烤后的质量,g; m 试样的质量,g; 计算结果精确至小数点后第一位。同一样品的两次测定值之差,每 100g 试样不得超过 0.2g。 五、注意事项 1.水果、蔬菜样品,应先洗去泥沙后,再用蒸馏水冲洗一次,然后用洁净纱布吸干表 面的水分

2.在测定过程中,称量皿从烘箱中取出后,应迅速放入干燥器中进行冷却,否则,不 易达到恒重。 3.干燥器内一般用硅胶作干燥剂,硅胶吸湿后效能会减低,故当硅胶蓝色减褪或变红 时,需及时换出,置 135℃左右烘 2~3 小时使其再生后再用。硅胶若吸附油脂等后,去湿能 力也会大大减低。 4.果糖含量较高的样品,如水果制品、蜂蜜等,在高温下(>70℃)长时间加热,其 果糖会发生氧化分解作用而导致明显误差: CH2OH ︱ C=O CH2OH ︱ [O] ︱ (CHOH)3 CH2OH + (CHOH)2 ︱ △ ︱ ︱ CH2OH COOH COOH 故宜采用真空干燥法测定水分含量。 5.含有较多氨基酸、蛋白质及羰基化合物的样品,长时间加热则会发生羰氨反应析出 水分而导致误差: H ︱ CH2N—H OH △ CH2—NH O=C C=O O=C C=O+2H2O H OH—NCH2 NH—CH2 ︱ H 对此类样品宜用其他方法测定水分含量。 6.在水分测定中,恒重的标准一般定为 1~3 mg,依食品种类和测定要求而定。 7.对于含挥发性组分较多的样品,如香料油、低醇饮料等宜采用蒸馏法测定水分含量。 8.测定水分后的样品,可供测脂肪、灰分含量用。 第二法 真空干燥法 一、实验原理 样品经磨碎,混匀后,在减压低温(80±2℃)的真空干燥箱内加热至恒重,加热前后 的质量差即为水分含量。减压加热干燥法适用于食糖、糖果、巧克力、糕点等食品中水分的 测定。 二、仪器与设备 真空干燥箱及减压加热装置(温控 60~110±2℃),分析天平(感量 0.1mg)、组织捣碎 机、研钵、铝皿(具盖,内径 75~80mm,高 30~35mm),铰肉机(蓖孔不超过 4mm)、干燥器 (内盛有效干燥剂),多用切碎机。 三、操作步骤 试样的制备及铝皿的烘烤同常压加热干燥法中的一样。 称取充分混匀的试样约 2.5g,精确至 0.001g,于已知恒重的铝皿中,置于真空干燥箱内 (皿盖斜放在皿边)。连接真空泵,抽空至 0.09mPa 以上,升温至 80±1℃。关闭真空泵上 的活塞,使真空干燥箱内的温度和真空温度保持恒定(80±1℃,0.09mPa 以上)。4h 后打开 活塞,使空气经干燥装置通入真空干燥箱内。待干燥箱内恢复到常压时,取出铝皿(取出前 先盖好盖),放入干燥器内冷却至室温(约 0.5h),称量。再置于真空干燥箱内,按上述温度 和真空度加热1h,加盖取出,于干燥器内冷却 0.5h,称量。重复加热 1h 操作,直至连续两 次称量差不超过 0.002g,即为恒重。以最小称量为准。 其测定结果的计算,要求及误差均同常压加热干燥法的一样。 四、注意事项 1.真空烘箱内各部位温度要求均匀一致,若干燥时间短时,更应严格控制
2.在测定过程中,称量皿从烘箱中取出后,应迅速放入干燥器中进行冷却,否则,不 易达到恒重。 3.干燥器内一般用硅胶作干燥剂,硅胶吸湿后效能会减低,故当硅胶蓝色减褪或变红 时,需及时换出,置 135℃左右烘 2~3 小时使其再生后再用。硅胶若吸附油脂等后,去湿能 力也会大大减低。 4.果糖含量较高的样品,如水果制品、蜂蜜等,在高温下(>70℃)长时间加热,其 果糖会发生氧化分解作用而导致明显误差: CH2OH ︱ C=O CH2OH ︱ [O] ︱ (CHOH)3 CH2OH + (CHOH)2 ︱ △ ︱ ︱ CH2OH COOH COOH 故宜采用真空干燥法测定水分含量。 5.含有较多氨基酸、蛋白质及羰基化合物的样品,长时间加热则会发生羰氨反应析出 水分而导致误差: H ︱ CH2N—H OH △ CH2—NH O=C C=O O=C C=O+2H2O H OH—NCH2 NH—CH2 ︱ H 对此类样品宜用其他方法测定水分含量。 6.在水分测定中,恒重的标准一般定为 1~3 mg,依食品种类和测定要求而定。 7.对于含挥发性组分较多的样品,如香料油、低醇饮料等宜采用蒸馏法测定水分含量。 8.测定水分后的样品,可供测脂肪、灰分含量用。 第二法 真空干燥法 一、实验原理 样品经磨碎,混匀后,在减压低温(80±2℃)的真空干燥箱内加热至恒重,加热前后 的质量差即为水分含量。减压加热干燥法适用于食糖、糖果、巧克力、糕点等食品中水分的 测定。 二、仪器与设备 真空干燥箱及减压加热装置(温控 60~110±2℃),分析天平(感量 0.1mg)、组织捣碎 机、研钵、铝皿(具盖,内径 75~80mm,高 30~35mm),铰肉机(蓖孔不超过 4mm)、干燥器 (内盛有效干燥剂),多用切碎机。 三、操作步骤 试样的制备及铝皿的烘烤同常压加热干燥法中的一样。 称取充分混匀的试样约 2.5g,精确至 0.001g,于已知恒重的铝皿中,置于真空干燥箱内 (皿盖斜放在皿边)。连接真空泵,抽空至 0.09mPa 以上,升温至 80±1℃。关闭真空泵上 的活塞,使真空干燥箱内的温度和真空温度保持恒定(80±1℃,0.09mPa 以上)。4h 后打开 活塞,使空气经干燥装置通入真空干燥箱内。待干燥箱内恢复到常压时,取出铝皿(取出前 先盖好盖),放入干燥器内冷却至室温(约 0.5h),称量。再置于真空干燥箱内,按上述温度 和真空度加热1h,加盖取出,于干燥器内冷却 0.5h,称量。重复加热 1h 操作,直至连续两 次称量差不超过 0.002g,即为恒重。以最小称量为准。 其测定结果的计算,要求及误差均同常压加热干燥法的一样。 四、注意事项 1.真空烘箱内各部位温度要求均匀一致,若干燥时间短时,更应严格控制
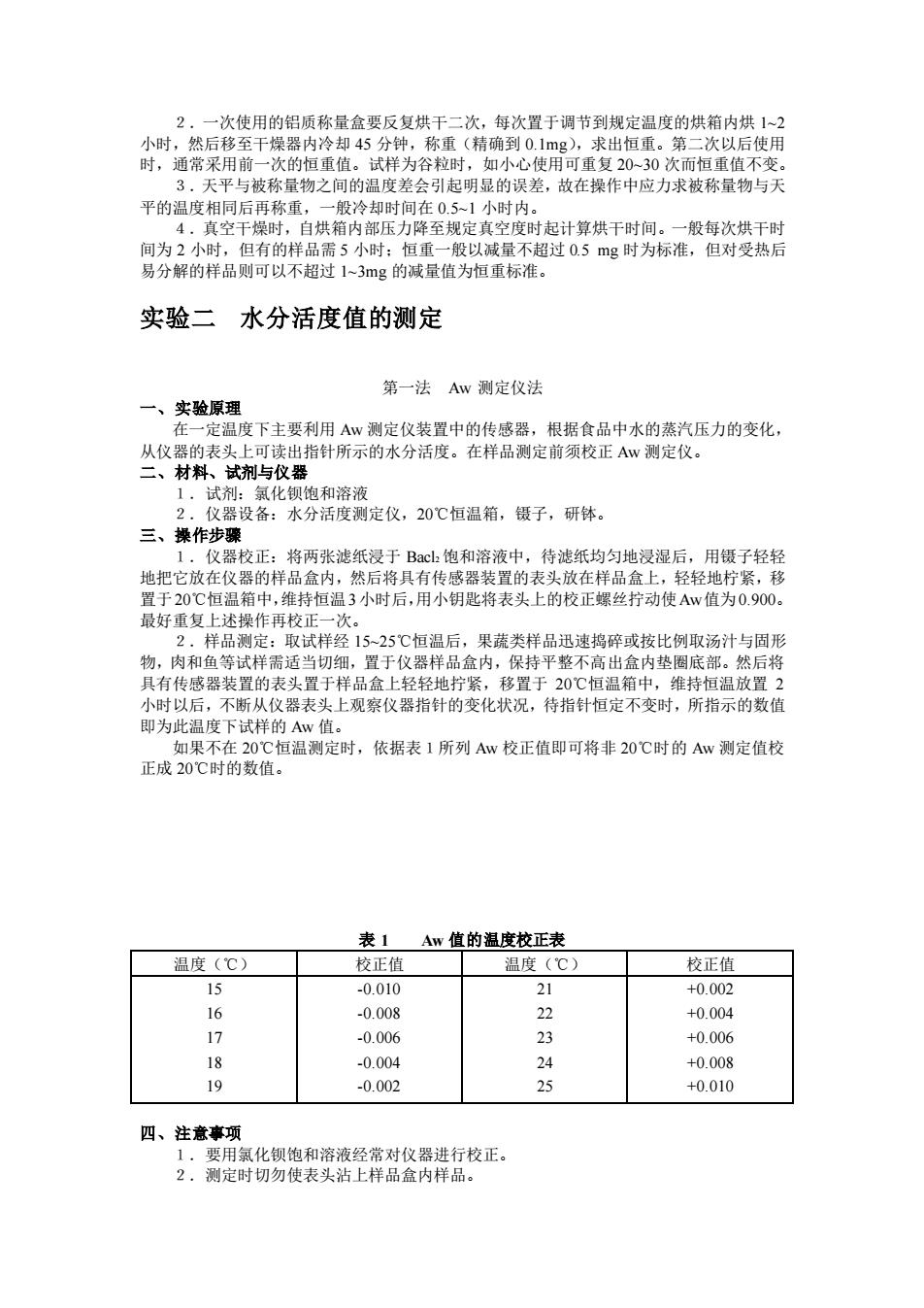
2.一次使用的铝质称量盒要反复烘干二次,每次置于调节到规定温度的烘箱内烘 1~2 小时,然后移至干燥器内冷却 45 分钟,称重(精确到 0.1mg),求出恒重。第二次以后使用 时,通常采用前一次的恒重值。试样为谷粒时,如小心使用可重复 20~30 次而恒重值不变。 3.天平与被称量物之间的温度差会引起明显的误差,故在操作中应力求被称量物与天 平的温度相同后再称重,一般冷却时间在 0.5~1 小时内。 4.真空干燥时,自烘箱内部压力降至规定真空度时起计算烘干时间。一般每次烘干时 间为 2 小时,但有的样品需 5 小时;恒重一般以减量不超过 0.5 mg 时为标准,但对受热后 易分解的样品则可以不超过 1~3mg 的减量值为恒重标准。 实验二 水分活度值的测定 第一法 Aw 测定仪法 一、实验原理 在一定温度下主要利用 Aw 测定仪装置中的传感器,根据食品中水的蒸汽压力的变化, 从仪器的表头上可读出指针所示的水分活度。在样品测定前须校正 Aw 测定仪。 二、材料、试剂与仪器 1.试剂:氯化钡饱和溶液 2.仪器设备:水分活度测定仪,20℃恒温箱,镊子,研钵。 三、操作步骤 1.仪器校正:将两张滤纸浸于 Bacl2 饱和溶液中,待滤纸均匀地浸湿后,用镊子轻轻 地把它放在仪器的样品盒内,然后将具有传感器装置的表头放在样品盒上,轻轻地柠紧,移 置于20℃恒温箱中,维持恒温3小时后,用小钥匙将表头上的校正螺丝拧动使Aw值为0.900。 最好重复上述操作再校正一次。 2.样品测定:取试样经 15~25℃恒温后,果蔬类样品迅速捣碎或按比例取汤汁与固形 物,肉和鱼等试样需适当切细,置于仪器样品盒内,保持平整不高出盒内垫圈底部。然后将 具有传感器装置的表头置于样品盒上轻轻地拧紧,移置于 20℃恒温箱中,维持恒温放置 2 小时以后,不断从仪器表头上观察仪器指针的变化状况,待指针恒定不变时,所指示的数值 即为此温度下试样的 Aw 值。 如果不在 20℃恒温测定时,依据表1所列 Aw 校正值即可将非 20℃时的 Aw 测定值校 正成 20℃时的数值。 表 1 Aw 值的温度校正表 温度(℃) 校正值 温度(℃) 校正值 15 16 17 18 19 -0.010 -0.008 -0.006 -0.004 -0.002 21 22 23 24 25 +0.002 +0.004 +0.006 +0.008 +0.010 四、注意事项 1.要用氯化钡饱和溶液经常对仪器进行校正。 2.测定时切勿使表头沾上样品盒内样品
2.一次使用的铝质称量盒要反复烘干二次,每次置于调节到规定温度的烘箱内烘 1~2 小时,然后移至干燥器内冷却 45 分钟,称重(精确到 0.1mg),求出恒重。第二次以后使用 时,通常采用前一次的恒重值。试样为谷粒时,如小心使用可重复 20~30 次而恒重值不变。 3.天平与被称量物之间的温度差会引起明显的误差,故在操作中应力求被称量物与天 平的温度相同后再称重,一般冷却时间在 0.5~1 小时内。 4.真空干燥时,自烘箱内部压力降至规定真空度时起计算烘干时间。一般每次烘干时 间为 2 小时,但有的样品需 5 小时;恒重一般以减量不超过 0.5 mg 时为标准,但对受热后 易分解的样品则可以不超过 1~3mg 的减量值为恒重标准。 实验二 水分活度值的测定 第一法 Aw 测定仪法 一、实验原理 在一定温度下主要利用 Aw 测定仪装置中的传感器,根据食品中水的蒸汽压力的变化, 从仪器的表头上可读出指针所示的水分活度。在样品测定前须校正 Aw 测定仪。 二、材料、试剂与仪器 1.试剂:氯化钡饱和溶液 2.仪器设备:水分活度测定仪,20℃恒温箱,镊子,研钵。 三、操作步骤 1.仪器校正:将两张滤纸浸于 Bacl2 饱和溶液中,待滤纸均匀地浸湿后,用镊子轻轻 地把它放在仪器的样品盒内,然后将具有传感器装置的表头放在样品盒上,轻轻地柠紧,移 置于20℃恒温箱中,维持恒温3小时后,用小钥匙将表头上的校正螺丝拧动使Aw值为0.900。 最好重复上述操作再校正一次。 2.样品测定:取试样经 15~25℃恒温后,果蔬类样品迅速捣碎或按比例取汤汁与固形 物,肉和鱼等试样需适当切细,置于仪器样品盒内,保持平整不高出盒内垫圈底部。然后将 具有传感器装置的表头置于样品盒上轻轻地拧紧,移置于 20℃恒温箱中,维持恒温放置 2 小时以后,不断从仪器表头上观察仪器指针的变化状况,待指针恒定不变时,所指示的数值 即为此温度下试样的 Aw 值。 如果不在 20℃恒温测定时,依据表1所列 Aw 校正值即可将非 20℃时的 Aw 测定值校 正成 20℃时的数值。 表 1 Aw 值的温度校正表 温度(℃) 校正值 温度(℃) 校正值 15 16 17 18 19 -0.010 -0.008 -0.006 -0.004 -0.002 21 22 23 24 25 +0.002 +0.004 +0.006 +0.008 +0.010 四、注意事项 1.要用氯化钡饱和溶液经常对仪器进行校正。 2.测定时切勿使表头沾上样品盒内样品
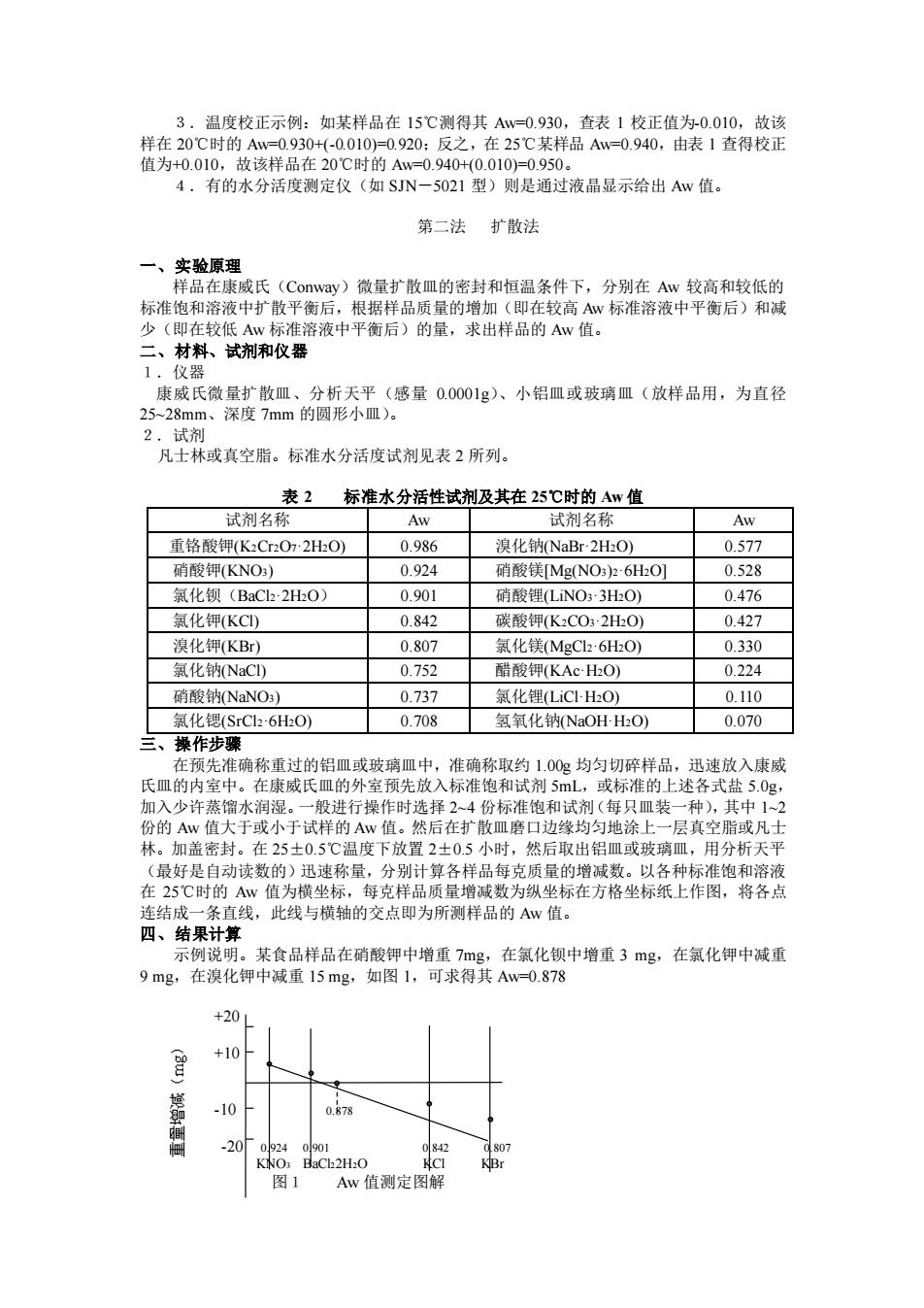
3.温度校正示例:如某样品在 15℃测得其 Aw=0.930,查表 1 校正值为-0.010,故该 样在 20℃时的 Aw=0.930+(-0.010)=0.920;反之,在 25℃某样品 Aw=0.940,由表 1 查得校正 值为+0.010,故该样品在 20℃时的 Aw=0.940+(0.010)=0.950。 4.有的水分活度测定仪(如 SJN-5021 型)则是通过液晶显示给出 Aw 值。 第二法 扩散法 一、实验原理 样品在康威氏(Conway)微量扩散皿的密封和恒温条件下,分别在 Aw 较高和较低的 标准饱和溶液中扩散平衡后,根据样品质量的增加(即在较高 Aw 标准溶液中平衡后)和减 少(即在较低 Aw 标准溶液中平衡后)的量,求出样品的 Aw 值。 二、材料、试剂和仪器 1.仪器 康威氏微量扩散皿、分析天平(感量 0.0001g)、小铝皿或玻璃皿(放样品用,为直径 25~28mm、深度 7mm 的圆形小皿)。 2.试剂 凡士林或真空脂。标准水分活度试剂见表 2 所列。 表 2 标准水分活性试剂及其在 25℃时的 Aw 值 试剂名称 Aw 试剂名称 Aw 重铬酸钾(K2Cr2O7·2H2O) 0.986 溴化钠(NaBr·2H2O) 0.577 硝酸钾(KNO3) 0.924 硝酸镁[Mg(NO3)2·6H2O] 0.528 氯化钡(BaCl2·2H2O) 0.901 硝酸锂(LiNO3·3H2O) 0.476 氯化钾(KCl) 0.842 碳酸钾(K2CO3·2H2O) 0.427 溴化钾(KBr) 0.807 氯化镁(MgCl2·6H2O) 0.330 氯化钠(NaCl) 0.752 醋酸钾(KAc·H2O) 0.224 硝酸钠(NaNO3) 0.737 氯化锂(LiCl·H2O) 0.110 氯化锶(SrCl2·6H2O) 0.708 氢氧化钠(NaOH·H2O) 0.070 三、操作步骤 在预先准确称重过的铝皿或玻璃皿中,准确称取约 1.00g 均匀切碎样品,迅速放入康威 氏皿的内室中。在康威氏皿的外室预先放入标准饱和试剂 5mL,或标准的上述各式盐 5.0g, 加入少许蒸馏水润湿。一般进行操作时选择 2~4 份标准饱和试剂(每只皿装一种),其中 1~2 份的 Aw 值大于或小于试样的 Aw 值。然后在扩散皿磨口边缘均匀地涂上一层真空脂或凡士 林。加盖密封。在 25±0.5℃温度下放置 2±0.5 小时,然后取出铝皿或玻璃皿,用分析天平 (最好是自动读数的)迅速称量,分别计算各样品每克质量的增减数。以各种标准饱和溶液 在 25℃时的 Aw 值为横坐标,每克样品质量增减数为纵坐标在方格坐标纸上作图,将各点 连结成一条直线,此线与横轴的交点即为所测样品的 Aw 值。 四、结果计算 示例说明。某食品样品在硝酸钾中增重 7mg,在氯化钡中增重 3 mg,在氯化钾中减重 9 mg,在溴化钾中减重 15 mg,如图 1,可求得其 Aw=0.878 +20 +10 -10 0.878 -20 0.924 0.901 0.842 0.807 KNO3 BaCl22H2O KCl KBr 图1 Aw 值测定图解
3.温度校正示例:如某样品在 15℃测得其 Aw=0.930,查表 1 校正值为-0.010,故该 样在 20℃时的 Aw=0.930+(-0.010)=0.920;反之,在 25℃某样品 Aw=0.940,由表 1 查得校正 值为+0.010,故该样品在 20℃时的 Aw=0.940+(0.010)=0.950。 4.有的水分活度测定仪(如 SJN-5021 型)则是通过液晶显示给出 Aw 值。 第二法 扩散法 一、实验原理 样品在康威氏(Conway)微量扩散皿的密封和恒温条件下,分别在 Aw 较高和较低的 标准饱和溶液中扩散平衡后,根据样品质量的增加(即在较高 Aw 标准溶液中平衡后)和减 少(即在较低 Aw 标准溶液中平衡后)的量,求出样品的 Aw 值。 二、材料、试剂和仪器 1.仪器 康威氏微量扩散皿、分析天平(感量 0.0001g)、小铝皿或玻璃皿(放样品用,为直径 25~28mm、深度 7mm 的圆形小皿)。 2.试剂 凡士林或真空脂。标准水分活度试剂见表 2 所列。 表 2 标准水分活性试剂及其在 25℃时的 Aw 值 试剂名称 Aw 试剂名称 Aw 重铬酸钾(K2Cr2O7·2H2O) 0.986 溴化钠(NaBr·2H2O) 0.577 硝酸钾(KNO3) 0.924 硝酸镁[Mg(NO3)2·6H2O] 0.528 氯化钡(BaCl2·2H2O) 0.901 硝酸锂(LiNO3·3H2O) 0.476 氯化钾(KCl) 0.842 碳酸钾(K2CO3·2H2O) 0.427 溴化钾(KBr) 0.807 氯化镁(MgCl2·6H2O) 0.330 氯化钠(NaCl) 0.752 醋酸钾(KAc·H2O) 0.224 硝酸钠(NaNO3) 0.737 氯化锂(LiCl·H2O) 0.110 氯化锶(SrCl2·6H2O) 0.708 氢氧化钠(NaOH·H2O) 0.070 三、操作步骤 在预先准确称重过的铝皿或玻璃皿中,准确称取约 1.00g 均匀切碎样品,迅速放入康威 氏皿的内室中。在康威氏皿的外室预先放入标准饱和试剂 5mL,或标准的上述各式盐 5.0g, 加入少许蒸馏水润湿。一般进行操作时选择 2~4 份标准饱和试剂(每只皿装一种),其中 1~2 份的 Aw 值大于或小于试样的 Aw 值。然后在扩散皿磨口边缘均匀地涂上一层真空脂或凡士 林。加盖密封。在 25±0.5℃温度下放置 2±0.5 小时,然后取出铝皿或玻璃皿,用分析天平 (最好是自动读数的)迅速称量,分别计算各样品每克质量的增减数。以各种标准饱和溶液 在 25℃时的 Aw 值为横坐标,每克样品质量增减数为纵坐标在方格坐标纸上作图,将各点 连结成一条直线,此线与横轴的交点即为所测样品的 Aw 值。 四、结果计算 示例说明。某食品样品在硝酸钾中增重 7mg,在氯化钡中增重 3 mg,在氯化钾中减重 9 mg,在溴化钾中减重 15 mg,如图 1,可求得其 Aw=0.878 +20 +10 -10 0.878 -20 0.924 0.901 0.842 0.807 KNO3 BaCl22H2O KCl KBr 图1 Aw 值测定图解

五、注意事项 1.每个样品测定时应作平行试验。其测定值的平行误差不得超过 0.02。 2.取样要在同一条件下进行,操作要迅速。 3.试样的大小和形状对测定结果影响不大。 4.康威氏微量扩散皿密封性要好。 5.取食品的固体或液体部分,样品平衡后其结果没有差异。 6.绝大多数样品可在 2 小时后测得 Aw 值,但米饭类、油脂类、油浸烟熏鱼类则需 4 天左右时间才能测定。因此,需加入样品量 0.2%的山梨酸防腐,并以山梨酸的水溶液作 空白。 实验三 食品中还原糖的测定 一、实验原理 样品经除去蛋白质后,在加热条件下,直接滴定标定过的碱性酒石酸铜液,以次甲基蓝 作指示剂,根据样品液消耗体积,计算还原糖量。 二、材料、试剂与仪器 ⒈ 碱性酒石酸铜甲液:称取 15g 硫酸铜(CuSO4·5H2O)及 0.05g 次甲基蓝,溶于水中 并稀释至 1000mL。 ⒉ 碱性酒石酸铜乙液:称取 50g 酒石酸钾钠及 75g 氢氧化钠,溶于水中,再加入 4g 亚铁氰化钾,完全溶解后,用水稀释至 1000mL,贮存于橡胶塞玻璃瓶内。 ⒊ 乙酸锌溶液:称取 21.9g 乙酸锌,加 3mL 冰乙酸,加水溶解并稀释至 100mL。 ⒋ 10.6%亚铁氰化钾溶液。 ⒌ 盐酸。 ⒍ 葡萄糖标准溶液:精密称取 1.00g 经过 98—100°C 干燥至恒量的纯葡萄糖,加水 溶解后加入 5mL 盐酸,并以水稀释至 1000mL。此溶液每毫升相当于 1mg 葡萄糖。 三、操作步骤 ⒈ 样品处理: (1) 乳类、乳制品及含蛋白质的冷食类:称取约 2.5-5g 固体样品(吸取 25-50mL 液体 样品),置于 250mL 容量瓶中,加 50mL 水,摇匀后慢慢加入 5mL 乙酸锌溶液及 5mL10.6%亚 铁氰化钾溶液,加水至刻度,混匀。静置 30min,用干燥滤纸过滤,弃去初滤液,滤液备用。 (2) 酒精性饮料:吸取 100mL 样品,置于蒸发皿中,用 1N 氢氧化钠溶液中和至中性, 在水浴上蒸发至原体积的 1/4 后,移入 250mL 容量瓶中。加 50mL 水,混匀。以下按⑴自“慢 慢加入 5mL 乙酸锌溶液及 5mL10.6%亚铁氰化钾溶液”起依法操作。 (3) 含多量淀粉的食品:称取 10-20g 样品,置于 250mL 容量瓶中,加 200mL 水,在 45℃ 水浴中加热 1h,并不时振摇。冷后加水至刻度,混匀,静置。吸取 200mL 上清液于另一 250mL 容量瓶中,以下按⑴自“慢慢加入 5mL 乙酸锌溶液及 5mL10.6%亚铁氰化钾溶液”起依法操 作。 (4) 汽水等含有二氧化碳的饮料:吸取 100mL 样品置于蒸发皿中,在水浴上除去二氧 化碳后,移入 250mL 容量瓶中,-并用水洗涤蒸发皿,洗液并入容量瓶中,再加水至刻度, 混匀后,备用。 ⒉ 标定碱性酒石酸铜溶液:吸取 5.0mL 碱性酒石酸铜甲液及 5.0mL 乙液,置于 150mL 锥形瓶中,加水 10mL,加入玻璃珠 2 粒,从滴定管滴加约 9mL 葡萄糖标准溶液,控制在 2min 内加热至沸,趁沸以每两秒 1 滴的速度继续滴加葡萄糖标准溶液,直至溶液蓝色刚好褪去为 终点,记录消耗葡萄糖标准溶的总体积,同时平行操作三份,取其平均值,计算每 10mL(甲、 乙液各 5mL)碱性酒石酸铜溶液相当于葡萄糖的质量(mg)。 ⒊ 样品溶液预测:吸取 5.0mL 碱性酒石酸铜甲液及 5.0 mL 乙液,置于 150 mL 锥形瓶
五、注意事项 1.每个样品测定时应作平行试验。其测定值的平行误差不得超过 0.02。 2.取样要在同一条件下进行,操作要迅速。 3.试样的大小和形状对测定结果影响不大。 4.康威氏微量扩散皿密封性要好。 5.取食品的固体或液体部分,样品平衡后其结果没有差异。 6.绝大多数样品可在 2 小时后测得 Aw 值,但米饭类、油脂类、油浸烟熏鱼类则需 4 天左右时间才能测定。因此,需加入样品量 0.2%的山梨酸防腐,并以山梨酸的水溶液作 空白。 实验三 食品中还原糖的测定 一、实验原理 样品经除去蛋白质后,在加热条件下,直接滴定标定过的碱性酒石酸铜液,以次甲基蓝 作指示剂,根据样品液消耗体积,计算还原糖量。 二、材料、试剂与仪器 ⒈ 碱性酒石酸铜甲液:称取 15g 硫酸铜(CuSO4·5H2O)及 0.05g 次甲基蓝,溶于水中 并稀释至 1000mL。 ⒉ 碱性酒石酸铜乙液:称取 50g 酒石酸钾钠及 75g 氢氧化钠,溶于水中,再加入 4g 亚铁氰化钾,完全溶解后,用水稀释至 1000mL,贮存于橡胶塞玻璃瓶内。 ⒊ 乙酸锌溶液:称取 21.9g 乙酸锌,加 3mL 冰乙酸,加水溶解并稀释至 100mL。 ⒋ 10.6%亚铁氰化钾溶液。 ⒌ 盐酸。 ⒍ 葡萄糖标准溶液:精密称取 1.00g 经过 98—100°C 干燥至恒量的纯葡萄糖,加水 溶解后加入 5mL 盐酸,并以水稀释至 1000mL。此溶液每毫升相当于 1mg 葡萄糖。 三、操作步骤 ⒈ 样品处理: (1) 乳类、乳制品及含蛋白质的冷食类:称取约 2.5-5g 固体样品(吸取 25-50mL 液体 样品),置于 250mL 容量瓶中,加 50mL 水,摇匀后慢慢加入 5mL 乙酸锌溶液及 5mL10.6%亚 铁氰化钾溶液,加水至刻度,混匀。静置 30min,用干燥滤纸过滤,弃去初滤液,滤液备用。 (2) 酒精性饮料:吸取 100mL 样品,置于蒸发皿中,用 1N 氢氧化钠溶液中和至中性, 在水浴上蒸发至原体积的 1/4 后,移入 250mL 容量瓶中。加 50mL 水,混匀。以下按⑴自“慢 慢加入 5mL 乙酸锌溶液及 5mL10.6%亚铁氰化钾溶液”起依法操作。 (3) 含多量淀粉的食品:称取 10-20g 样品,置于 250mL 容量瓶中,加 200mL 水,在 45℃ 水浴中加热 1h,并不时振摇。冷后加水至刻度,混匀,静置。吸取 200mL 上清液于另一 250mL 容量瓶中,以下按⑴自“慢慢加入 5mL 乙酸锌溶液及 5mL10.6%亚铁氰化钾溶液”起依法操 作。 (4) 汽水等含有二氧化碳的饮料:吸取 100mL 样品置于蒸发皿中,在水浴上除去二氧 化碳后,移入 250mL 容量瓶中,-并用水洗涤蒸发皿,洗液并入容量瓶中,再加水至刻度, 混匀后,备用。 ⒉ 标定碱性酒石酸铜溶液:吸取 5.0mL 碱性酒石酸铜甲液及 5.0mL 乙液,置于 150mL 锥形瓶中,加水 10mL,加入玻璃珠 2 粒,从滴定管滴加约 9mL 葡萄糖标准溶液,控制在 2min 内加热至沸,趁沸以每两秒 1 滴的速度继续滴加葡萄糖标准溶液,直至溶液蓝色刚好褪去为 终点,记录消耗葡萄糖标准溶的总体积,同时平行操作三份,取其平均值,计算每 10mL(甲、 乙液各 5mL)碱性酒石酸铜溶液相当于葡萄糖的质量(mg)。 ⒊ 样品溶液预测:吸取 5.0mL 碱性酒石酸铜甲液及 5.0 mL 乙液,置于 150 mL 锥形瓶

中,加水 10 mL,加入玻璃珠 2 粒,控制在 2min 内加热及沸,趁沸以先快后慢的速度,从 滴定管中滴加样品溶液,并保持溶液沸腾状态,待溶液颜色变浅时,以每两秒 1 滴的速度滴 定,直至溶液蓝色刚好褪去为终点,记录样液消耗体积。 ⒋ 样品溶液测定:吸取 5.0 mL 碱性酒石酸铜甲液及 5.0 mL 乙液,置于 150 mL 锥形瓶 中,加水 10 mL,加入玻璃珠 2 粒,从滴定管滴加比预测体积少 1 mL 的样品溶液,使在 2min 内加热至沸,趁沸继续以每两秒 1 滴的速度滴定,直至蓝色刚好褪去为终点,记录样液消耗 体积,同法平行操作三份,得出平均消耗体积。 四、结果计算 m3 X3= ×100 V2 m4× ×1000 250 式中:X3——样品中还原糖的含量(以葡萄糖计),%; m3——10mL 碱性酒石酸铜溶液(甲、乙液各 5 mL)相当于还原糖(以葡萄计)的质 量,mg; m4-样品质量或体积,g 或 mL; V2——测定时平均消耗样品溶液体积,mL; 250 为样品溶液总体积, mL。 五﹑注意事项 1.此法有称快速法,适合于各类食品中还原糖的测定,是国家标准分析法。 2.此实验应严格遵守操作步骤及条件的准确一致性(如加热时间,滴定时的条件与速度 等),以减少操作中产生的误差。 实验四 食品中蔗糖的测定 一、实验原理 样品经除去蛋白质后,其中蔗糖经盐酸水解转化为还原糖,再按还原糖测定。水解前后 还原糖的差值为蔗糖含量。 二、材料、试剂与仪器 ⒈ 试剂 (1)6mol/L 盐酸: 量取 50 mL 盐酸加水稀释至 100 mL; (2)甲基红指标液: 0.1%乙醇溶液; (3)20%氢氧化钠溶液; 其余试剂同前面食品中还原糖的测定中的试剂。 2. 仪器 同食品中还原糖的测定中的仪器 三、操作步骤 吸取 2 份 50 mL 按测定还原糖方法中制备样品处理液,置于 100 mL 容量瓶中,一份加 5mL6mol/L 盐酸,在 68—70℃水浴中加热 15min,冷后加 2 滴甲基红指标液,用 20%氢氧化 钠溶液中和至中性,加水至刻度,混匀。另一份直接加水稀释至 100 mL,按测定还原糖的 方法分别测定还原糖。 四、结果计算 X=(R2—R1)×0.95 式中:X——样品中蔗糖含量,%; R2——水解处理后还原糖含量,%; R1——不经水解处理还原糖含量,%;
中,加水 10 mL,加入玻璃珠 2 粒,控制在 2min 内加热及沸,趁沸以先快后慢的速度,从 滴定管中滴加样品溶液,并保持溶液沸腾状态,待溶液颜色变浅时,以每两秒 1 滴的速度滴 定,直至溶液蓝色刚好褪去为终点,记录样液消耗体积。 ⒋ 样品溶液测定:吸取 5.0 mL 碱性酒石酸铜甲液及 5.0 mL 乙液,置于 150 mL 锥形瓶 中,加水 10 mL,加入玻璃珠 2 粒,从滴定管滴加比预测体积少 1 mL 的样品溶液,使在 2min 内加热至沸,趁沸继续以每两秒 1 滴的速度滴定,直至蓝色刚好褪去为终点,记录样液消耗 体积,同法平行操作三份,得出平均消耗体积。 四、结果计算 m3 X3= ×100 V2 m4× ×1000 250 式中:X3——样品中还原糖的含量(以葡萄糖计),%; m3——10mL 碱性酒石酸铜溶液(甲、乙液各 5 mL)相当于还原糖(以葡萄计)的质 量,mg; m4-样品质量或体积,g 或 mL; V2——测定时平均消耗样品溶液体积,mL; 250 为样品溶液总体积, mL。 五﹑注意事项 1.此法有称快速法,适合于各类食品中还原糖的测定,是国家标准分析法。 2.此实验应严格遵守操作步骤及条件的准确一致性(如加热时间,滴定时的条件与速度 等),以减少操作中产生的误差。 实验四 食品中蔗糖的测定 一、实验原理 样品经除去蛋白质后,其中蔗糖经盐酸水解转化为还原糖,再按还原糖测定。水解前后 还原糖的差值为蔗糖含量。 二、材料、试剂与仪器 ⒈ 试剂 (1)6mol/L 盐酸: 量取 50 mL 盐酸加水稀释至 100 mL; (2)甲基红指标液: 0.1%乙醇溶液; (3)20%氢氧化钠溶液; 其余试剂同前面食品中还原糖的测定中的试剂。 2. 仪器 同食品中还原糖的测定中的仪器 三、操作步骤 吸取 2 份 50 mL 按测定还原糖方法中制备样品处理液,置于 100 mL 容量瓶中,一份加 5mL6mol/L 盐酸,在 68—70℃水浴中加热 15min,冷后加 2 滴甲基红指标液,用 20%氢氧化 钠溶液中和至中性,加水至刻度,混匀。另一份直接加水稀释至 100 mL,按测定还原糖的 方法分别测定还原糖。 四、结果计算 X=(R2—R1)×0.95 式中:X——样品中蔗糖含量,%; R2——水解处理后还原糖含量,%; R1——不经水解处理还原糖含量,%;

0.95——还原糖(以葡萄糖计)换算为蔗糖的系数。 第一法 酶水解法 一、实验原理 样品经除去脂肪及可溶性糖类后,其中淀粉用淀粉酶水解成双糖,再用盐酸将双糖水解 成单糖,最后按还原糖测定,并折算成淀粉。 二、材料 试剂与仪器 ⒈ 0.5%淀粉酶溶液:称取淀粉酶 0.5g,加 100mL 水溶解,加入数滴甲苯或三氯甲烷, 防止长霉,贮于冰箱中。 ⒉ 碘溶液:称取 3.6g 碘化钾溶于 20 mL 水中,加入 1.3g 碘,溶解后加水稀释至 100mL。 ⒊ 乙醚 ⒋ 85%乙醇。 其余试剂同食品中蔗糖的测定中试剂。 三、操作步骤 ⒈ 样品处理 称取 2~5 样品,置于放有折叠滤纸的漏斗内,先用 50 mL 乙醚分别次洗除脂肪,再用 约 100mL85%乙醇洗去可溶性糖类,将残留物移入 250mL 烧杯内,并用 50mL 水洗滤纸及漏斗, 洗液并入烧杯内,将烧杯置沸水浴上加热 15min,使淀粉糊化,放冷至 60℃以下,加 20 mL 淀粉酶溶液,在 55~60℃保温 1h,并时时搅拌。然后取 1 滴此液加 1 滴碘溶液,应不显现 蓝色,若显蓝色,再加热糊化并加 20mL 淀粉酶溶液,继续保温,直至加碘不显蓝色为止。 加热至沸,冷后移入 250mL 容量瓶中,并加水至刻度,温匀,过滤,弃去初滤液。取 50 mL 滤液,置于 250 mL 锥形瓶中,加 5 mL6N 盐酸,装上回流冷凝器,在沸水浴中回流 1h,冷 后加 2 滴甲基红指示液,用 20%氢氧化钠溶液中和至中性,溶液转入 100 mL 容量瓶中,洗 剂锥形瓶,洗液并入 100 mL 容量瓶中,加水至刻度,混匀备用。 ⒉ 测定 按食品中还原糖的测定方法操作。同时量取 50 mL 水及与样品处理时相同量的淀粉酶溶 液,按同一方法做试剂空白试验。 四、结果计算 (A1-A2)×0.9 X1= ×100 50 V1 m1× × × 1000 250 100 式中:X1——样品中淀粉的含量,%; A1——测定用样品中还原糖的含量,mg; A2——试剂空白中还原糖的含量,mg; 0.9——还原糖(以葡萄糖计)换算成淀粉的换算系数; m1——称取样品质量,g; V1——测定用样品处理液的体积,mL。 第二法 酸水解法 一、实验原理 样品经除去脂肪及可溶性糖类后,其中淀粉用酸水解成具有还原性的单糖,然后按还原 糖测定,并折算成淀粉。 二、材料、试剂与仪器 ⒈ 试剂 ⑴乙醚 ⑵85%乙醇溶液。 ⑶6mol/L 盐酸溶液。 ⑷40%氢氧化钠溶液
0.95——还原糖(以葡萄糖计)换算为蔗糖的系数。 第一法 酶水解法 一、实验原理 样品经除去脂肪及可溶性糖类后,其中淀粉用淀粉酶水解成双糖,再用盐酸将双糖水解 成单糖,最后按还原糖测定,并折算成淀粉。 二、材料 试剂与仪器 ⒈ 0.5%淀粉酶溶液:称取淀粉酶 0.5g,加 100mL 水溶解,加入数滴甲苯或三氯甲烷, 防止长霉,贮于冰箱中。 ⒉ 碘溶液:称取 3.6g 碘化钾溶于 20 mL 水中,加入 1.3g 碘,溶解后加水稀释至 100mL。 ⒊ 乙醚 ⒋ 85%乙醇。 其余试剂同食品中蔗糖的测定中试剂。 三、操作步骤 ⒈ 样品处理 称取 2~5 样品,置于放有折叠滤纸的漏斗内,先用 50 mL 乙醚分别次洗除脂肪,再用 约 100mL85%乙醇洗去可溶性糖类,将残留物移入 250mL 烧杯内,并用 50mL 水洗滤纸及漏斗, 洗液并入烧杯内,将烧杯置沸水浴上加热 15min,使淀粉糊化,放冷至 60℃以下,加 20 mL 淀粉酶溶液,在 55~60℃保温 1h,并时时搅拌。然后取 1 滴此液加 1 滴碘溶液,应不显现 蓝色,若显蓝色,再加热糊化并加 20mL 淀粉酶溶液,继续保温,直至加碘不显蓝色为止。 加热至沸,冷后移入 250mL 容量瓶中,并加水至刻度,温匀,过滤,弃去初滤液。取 50 mL 滤液,置于 250 mL 锥形瓶中,加 5 mL6N 盐酸,装上回流冷凝器,在沸水浴中回流 1h,冷 后加 2 滴甲基红指示液,用 20%氢氧化钠溶液中和至中性,溶液转入 100 mL 容量瓶中,洗 剂锥形瓶,洗液并入 100 mL 容量瓶中,加水至刻度,混匀备用。 ⒉ 测定 按食品中还原糖的测定方法操作。同时量取 50 mL 水及与样品处理时相同量的淀粉酶溶 液,按同一方法做试剂空白试验。 四、结果计算 (A1-A2)×0.9 X1= ×100 50 V1 m1× × × 1000 250 100 式中:X1——样品中淀粉的含量,%; A1——测定用样品中还原糖的含量,mg; A2——试剂空白中还原糖的含量,mg; 0.9——还原糖(以葡萄糖计)换算成淀粉的换算系数; m1——称取样品质量,g; V1——测定用样品处理液的体积,mL。 第二法 酸水解法 一、实验原理 样品经除去脂肪及可溶性糖类后,其中淀粉用酸水解成具有还原性的单糖,然后按还原 糖测定,并折算成淀粉。 二、材料、试剂与仪器 ⒈ 试剂 ⑴乙醚 ⑵85%乙醇溶液。 ⑶6mol/L 盐酸溶液。 ⑷40%氢氧化钠溶液

⑸10%氢氧化钠溶液。 ⑹甲基红指示液:0.2%乙醇溶液。 ⑺精密 PH 试纸。 ⑻20%乙酸铅溶液。 ⑼10%硫酸钠溶液。 其余试剂同还原糖测定试剂。 ⒉ 仪器 水浴锅;1200r/min 高速组织捣碎机;皂化装置并附 250 mL 锥形瓶。 三、操作步骤 1 样品处理 (1) 粮食、豆类、糕点、饼干等较干燥的样品:称取 2.0—5.0g 磨碎过 40 目筛的样品, 置于放有慢速滤纸的漏斗中,用 30 mL 乙醚分三次洗去样品中脂肪,弃去乙醚。再用 150 mL85% 乙醇溶液分数次洗涤残渣,除去可溶性糖类物质。并滤干乙醇溶液,以 100 mL 水洗涤漏斗 中残渣并转移至 250 mL 锥形瓶中,加入 30 mL6mol/L 盐酸,接好冷凝管,置沸水浴中回流 2h。回流完毕后,立即置流水中冷却。待样品水解液冷却后,加入 2 滴甲基红指示液,先以 40%氢氧化钠溶液调至黄色,再以 6mol/L 盐酸校正至水解液刚变成红色为宜。若水解液颜色 较深,可用精密 PH 试纸测试,使样品水解液的 PH 约为 7。然后加 20 mL20%乙酸铅溶液,摇 匀,放置 10min。再加 20 mL10%硫酸钠溶液,以除去过多的铅。摇匀后将全部溶液及残渣转 入 500 mL 容量瓶中,用水洗涤锥形瓶,洗液合并于容量瓶中,加水稀释至刻度。过滤,弃 去初滤液 20 mL,滤液供测定用。 (2) 蔬菜、水果、各种粮豆含水熟食制品:按 1:1 加水在组织捣碎机中捣成匀浆(蔬 菜、水果需先洗净、晾干,取可食部分)。称取 5~10g 匀浆(液体样品可直接量取),于 250 mL 锥形瓶中,加 30 mL 乙醚振摇提取(除去样品中脂肪),用滤纸过滤除去乙醚,再用 30 mL 乙醚淋洗两次,弃去乙醚。以下按⑴自“再用 15 0mL85%乙醇溶液”起依法操作。 2 测定 按测定还原糖的方法操作。 四、结果计算 (A3-A4) × 0.9 X2= × 100 V2 m2× × 1000 500 式中:X2——样品中淀粉含量,%; A3——测定用样品中水解液中还原糖含量,mg; A4——试剂空白中还原糖的含量,mg; m2——样品质量,g; V2——测定用样品水解液体积,mL; 500——样品液总体积; 0.9——还原糖折算成淀粉的换算系数。 实验五 食品淀粉的测定 酶比色法 一、原理 淀粉在淀粉葡萄糖苷酶(AGS)催化下,最终水解为葡萄糖。葡萄糖氧化酶(GOD)在有
⑸10%氢氧化钠溶液。 ⑹甲基红指示液:0.2%乙醇溶液。 ⑺精密 PH 试纸。 ⑻20%乙酸铅溶液。 ⑼10%硫酸钠溶液。 其余试剂同还原糖测定试剂。 ⒉ 仪器 水浴锅;1200r/min 高速组织捣碎机;皂化装置并附 250 mL 锥形瓶。 三、操作步骤 1 样品处理 (1) 粮食、豆类、糕点、饼干等较干燥的样品:称取 2.0—5.0g 磨碎过 40 目筛的样品, 置于放有慢速滤纸的漏斗中,用 30 mL 乙醚分三次洗去样品中脂肪,弃去乙醚。再用 150 mL85% 乙醇溶液分数次洗涤残渣,除去可溶性糖类物质。并滤干乙醇溶液,以 100 mL 水洗涤漏斗 中残渣并转移至 250 mL 锥形瓶中,加入 30 mL6mol/L 盐酸,接好冷凝管,置沸水浴中回流 2h。回流完毕后,立即置流水中冷却。待样品水解液冷却后,加入 2 滴甲基红指示液,先以 40%氢氧化钠溶液调至黄色,再以 6mol/L 盐酸校正至水解液刚变成红色为宜。若水解液颜色 较深,可用精密 PH 试纸测试,使样品水解液的 PH 约为 7。然后加 20 mL20%乙酸铅溶液,摇 匀,放置 10min。再加 20 mL10%硫酸钠溶液,以除去过多的铅。摇匀后将全部溶液及残渣转 入 500 mL 容量瓶中,用水洗涤锥形瓶,洗液合并于容量瓶中,加水稀释至刻度。过滤,弃 去初滤液 20 mL,滤液供测定用。 (2) 蔬菜、水果、各种粮豆含水熟食制品:按 1:1 加水在组织捣碎机中捣成匀浆(蔬 菜、水果需先洗净、晾干,取可食部分)。称取 5~10g 匀浆(液体样品可直接量取),于 250 mL 锥形瓶中,加 30 mL 乙醚振摇提取(除去样品中脂肪),用滤纸过滤除去乙醚,再用 30 mL 乙醚淋洗两次,弃去乙醚。以下按⑴自“再用 15 0mL85%乙醇溶液”起依法操作。 2 测定 按测定还原糖的方法操作。 四、结果计算 (A3-A4) × 0.9 X2= × 100 V2 m2× × 1000 500 式中:X2——样品中淀粉含量,%; A3——测定用样品中水解液中还原糖含量,mg; A4——试剂空白中还原糖的含量,mg; m2——样品质量,g; V2——测定用样品水解液体积,mL; 500——样品液总体积; 0.9——还原糖折算成淀粉的换算系数。 实验五 食品淀粉的测定 酶比色法 一、原理 淀粉在淀粉葡萄糖苷酶(AGS)催化下,最终水解为葡萄糖。葡萄糖氧化酶(GOD)在有