
蛋白质结构
蛋白质结构

(二)蛋白质的空间结构(三维结构) 1. 蛋白质空间结构的研究方法 (1) X-射线衍射法(X-ray diffraction method) (2) 核磁共振(NMR) (3) 光谱法(红外光谱、紫外差光谱、荧光光谱) (4) 旋光色散法(optical rotatory dispersion, ORD) (5) 园二色性(circular dichroism, CD) (6) 氢同位素交换法
(二)蛋白质的空间结构(三维结构) 1. 蛋白质空间结构的研究方法 (1) X-射线衍射法(X-ray diffraction method) (2) 核磁共振(NMR) (3) 光谱法(红外光谱、紫外差光谱、荧光光谱) (4) 旋光色散法(optical rotatory dispersion, ORD) (5) 园二色性(circular dichroism, CD) (6) 氢同位素交换法
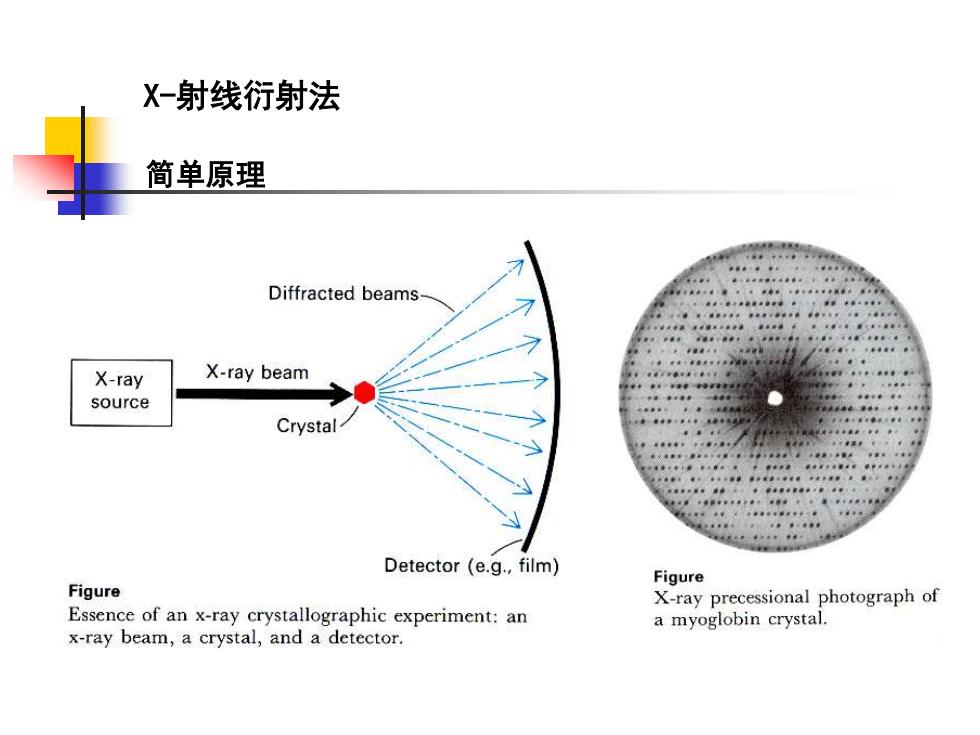
X-射线衍射法 简单原理
X-射线衍射法 简单原理

2.蛋白质的二级结构 蛋白质的二级结构是指多 肽链本身的折叠和盘绕方式。 酰胺平面和两面角
2.蛋白质的二级结构 蛋白质的二级结构是指多 肽链本身的折叠和盘绕方式。 酰胺平面和两面角

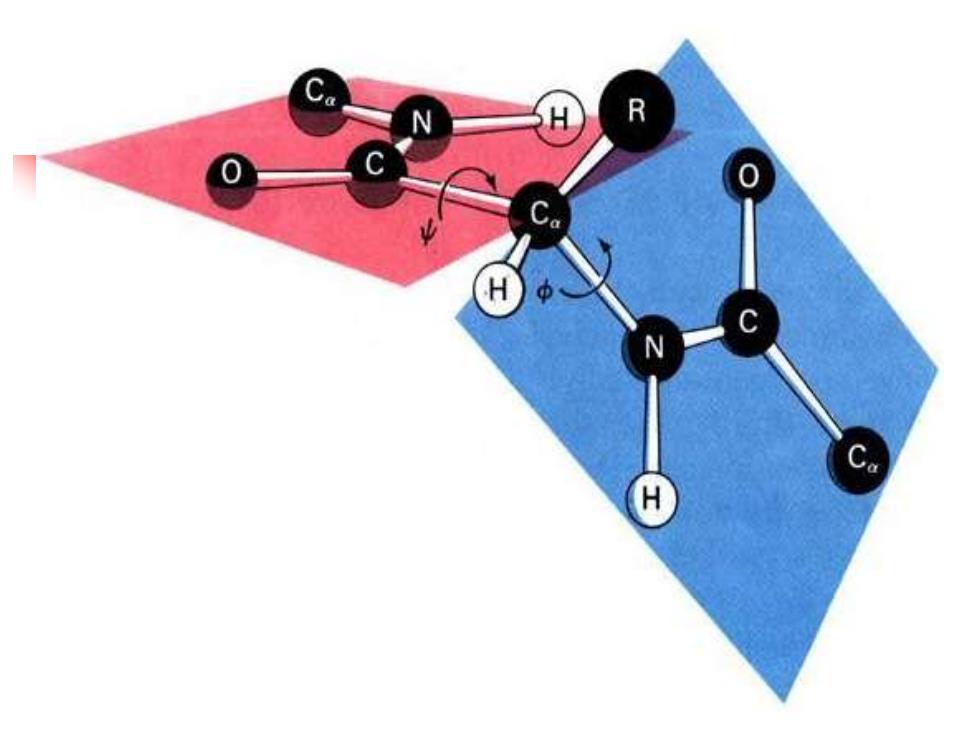
早在20世纪30年代,Pauling和Corey就开始有X-射 线衍射方法研究了氨基酸和肽的结构,他们得到了重要的 结论: (1) 肽键的键长介于C-N单键和双键之间,具有部分双键的性质, 不能自由旋转。 (2) 肽键中的四个原子和它相邻的两个α-碳原子处于同一平面,形 成了酰胺平面,也称肽键平面。 (3) 在酰胺平面中C=0与N-H呈反式
早在20世纪30年代,Pauling和Corey就开始有X-射 线衍射方法研究了氨基酸和肽的结构,他们得到了重要的 结论: (1) 肽键的键长介于C-N单键和双键之间,具有部分双键的性质, 不能自由旋转。 (2) 肽键中的四个原子和它相邻的两个α-碳原子处于同一平面,形 成了酰胺平面,也称肽键平面。 (3) 在酰胺平面中C=0与N-H呈反式
R H
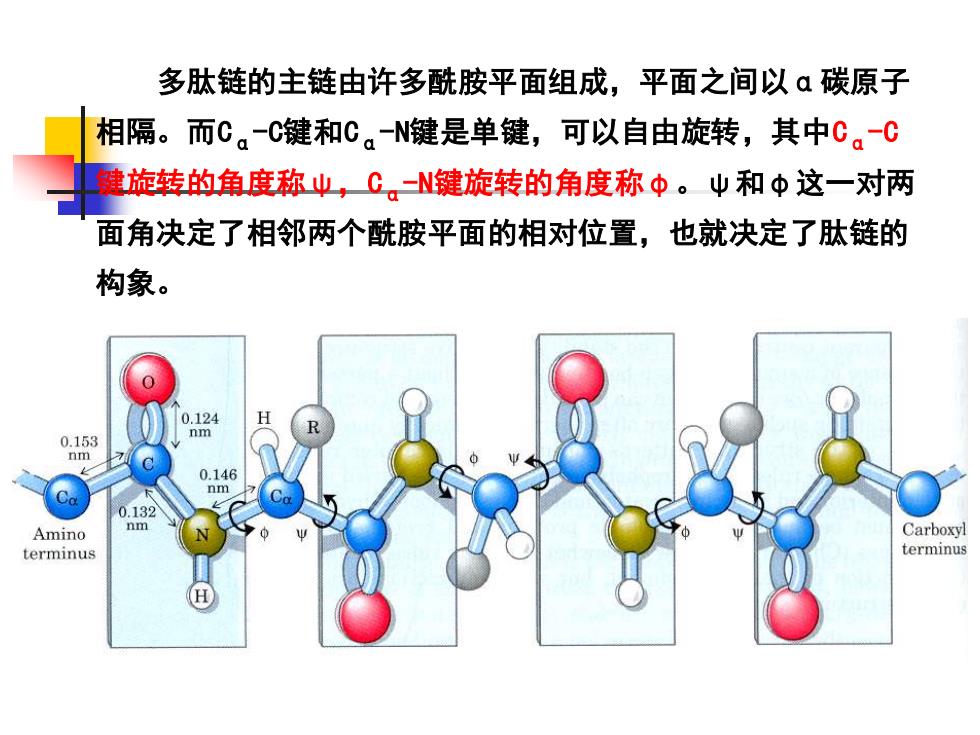
多肽链的主链由许多酰胺平面组成,平面之间以α碳原子 相隔。而Cα-C键和Cα-N键是单键,可以自由旋转,其中Cα-C 键旋转的角度称ψ,Cα-N键旋转的角度称φ。ψ和φ这一对两 面角决定了相邻两个酰胺平面的相对位置,也就决定了肽链的 构象
多肽链的主链由许多酰胺平面组成,平面之间以α碳原子 相隔。而Cα-C键和Cα-N键是单键,可以自由旋转,其中Cα-C 键旋转的角度称ψ,Cα-N键旋转的角度称φ。ψ和φ这一对两 面角决定了相邻两个酰胺平面的相对位置,也就决定了肽链的 构象
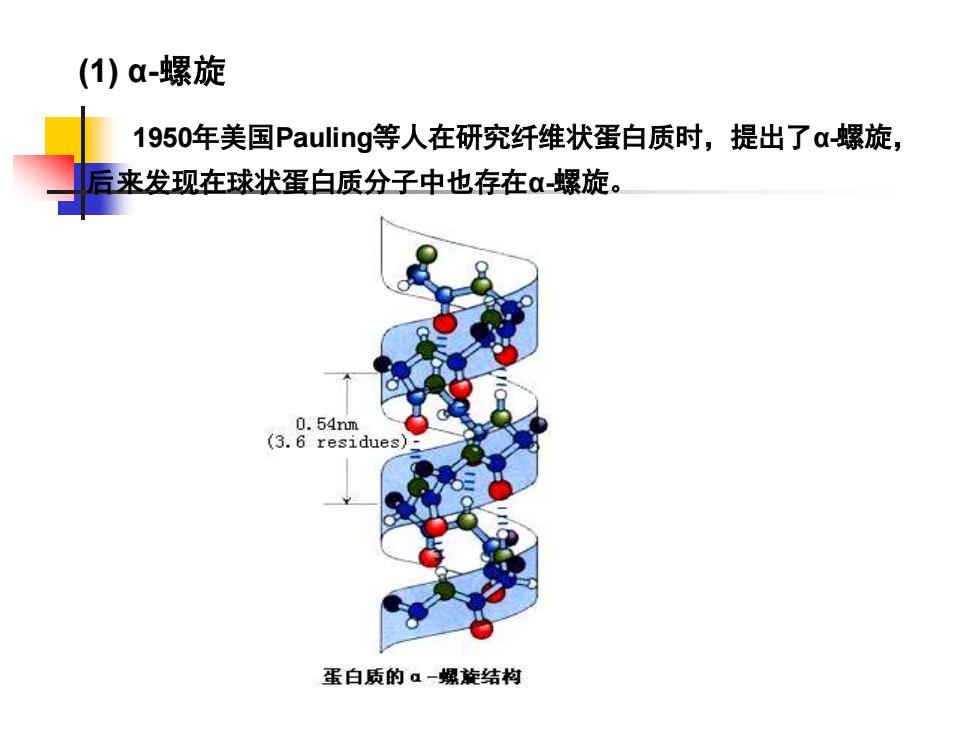
(1) α-螺旋 1950年美国Pauling等人在研究纤维状蛋白质时,提出了α-螺旋, 后来发现在球状蛋白质分子中也存在α-螺旋
(1) α-螺旋 1950年美国Pauling等人在研究纤维状蛋白质时,提出了α-螺旋, 后来发现在球状蛋白质分子中也存在α-螺旋

① 蛋白质多肽链像螺旋一样盘曲上升,每3.6个氨基酸残基螺旋上升 一圈,每圈螺旋的高度为0.54nm,每个氨基酸残基沿轴上升0.15nm, 螺旋上升时,每个残基沿轴旋转100º 。 ② 在同一肽链内相邻的螺圈之间形成氢链。 ③ α-螺旋有右手螺旋和左手螺旋之分,天然蛋白质绝大部分是右 手螺旋,到目前为止仅在嗜热菌蛋白酶中发现了一段左手螺旋。 α-螺旋结构的要点如下: α-螺旋的稳定性主要靠氢键来维持
① 蛋白质多肽链像螺旋一样盘曲上升,每3.6个氨基酸残基螺旋上升 一圈,每圈螺旋的高度为0.54nm,每个氨基酸残基沿轴上升0.15nm, 螺旋上升时,每个残基沿轴旋转100º 。 ② 在同一肽链内相邻的螺圈之间形成氢链。 ③ α-螺旋有右手螺旋和左手螺旋之分,天然蛋白质绝大部分是右 手螺旋,到目前为止仅在嗜热菌蛋白酶中发现了一段左手螺旋。 α-螺旋结构的要点如下: α-螺旋的稳定性主要靠氢键来维持

除了上面这种典型的α-螺旋外,还有一些不典型的α-螺 旋,所以规定了有关螺旋的写法,用“nS ”来表示,n为螺旋 上升一圈氨基酸的残基数。S为氢键封闭环内的原子数,典 型的α-螺旋用3.613表示,非典型的α-螺旋有3.010, 4.416(π 螺旋)等
除了上面这种典型的α-螺旋外,还有一些不典型的α-螺 旋,所以规定了有关螺旋的写法,用“nS ”来表示,n为螺旋 上升一圈氨基酸的残基数。S为氢键封闭环内的原子数,典 型的α-螺旋用3.613表示,非典型的α-螺旋有3.010, 4.416(π 螺旋)等