
第二章 水 在人体内,水不仅是构成机体的主要成分,而且是维持生命活动、调节代谢过程不可缺 少的重要物质。例如,水使人体体温保持稳定,因为水的热容量大,一旦人体内热量增多或 减少也不致引起体温出现大的波动。水的蒸发潜热大,蒸发少量汗水即可散发大量热能,通 过血液流动使全身体温平衡。水是一种溶剂,能够作为体内营养素运输、吸收和废弃物排泄 的载体,可作为化学和生物化学反应物或反应介质,也可作为一种天然的润滑剂和增塑剂, 同时又是生物大分子化合物构象的稳定剂,以及包括酶催化在内的大分子动力学行为的促进 剂。此外,水也是植物进行光合作用过程中合成碳水化合物所必需的物质。可以清楚地看到, 生物体的生存是如此显著的依赖于水这个无机小分子。 水是食品中非常重要的一种成分,也是构成大多数食品的主要组分,各种食品都有能显 示其品质特性的含水量(表 2-1)。水的含量、分布和取向不仅对食品的结构、外观、质地、 风味、新鲜程度和腐败变质的敏感性产生极大的影响,而且对生物组织的生命过程也起着至 关重要的作用。水在食品贮藏加工过程中作为化学和生物化学反应的介质,又是水解过程的 反应物。通过干燥或增加食盐、糖的浓度,可使食品中的水分除去或被结合,从而有效地抑 制很多反应的发生和微生物的生长,以延长食品的货架期。水与蛋白质、多糖和脂类通过物 理相互作用影响食品的质构,在大多数新鲜食品中,水是最主要的成分,若希望长期贮藏这 类食品,只要采取有效的贮藏方法 控制水分就能够延长保藏期,无论采用普通方法脱水或 是低温冷冻干燥脱水,食品和生物材料的固有特性都会发生很大的变化,然而任何企图使脱 水食品恢复到它原来的状态(复水和解冻)的尝试都未获得成功。下面我们将讨论水和冰的一 些特性,以控制水在食品加工贮藏过程中的变化和影响。 第一节 水和冰的物理特性 水与元素周期表中邻近氧的某些元素的氢化物,例如 CH4、NH3、HF、H2S、H2Se 和 H2Te 等的物理性质比较,除了粘度外,其他性质均有显著差异。水的熔点、沸点比这些氢 化物要高得多,介电常数、表面张力、热容和相变热(熔融热、蒸发热和升华热)等物理常数 也都异常高,但密度较低。此外,水结冰时体积增大,表现出异常的膨胀特性。水的热导值 大于其他液态物质,冰的热导值略大于非金属固体。0℃时冰的热导值约为同一温度下水的 4 倍,这说明冰的热能传导速率比生物组织中非流动的水快得多。从水和冰的热扩散值可看出 水的固态和液态的温度变化速率,冰的热扩散速率为水的 9 倍;在一定的环境条件下,冰 的温度变化速率比水大得多。水和冰无论是热传导或热扩散值都存在着相当大的差异,因而
第二章 水 在人体内,水不仅是构成机体的主要成分,而且是维持生命活动、调节代谢过程不可缺 少的重要物质。例如,水使人体体温保持稳定,因为水的热容量大,一旦人体内热量增多或 减少也不致引起体温出现大的波动。水的蒸发潜热大,蒸发少量汗水即可散发大量热能,通 过血液流动使全身体温平衡。水是一种溶剂,能够作为体内营养素运输、吸收和废弃物排泄 的载体,可作为化学和生物化学反应物或反应介质,也可作为一种天然的润滑剂和增塑剂, 同时又是生物大分子化合物构象的稳定剂,以及包括酶催化在内的大分子动力学行为的促进 剂。此外,水也是植物进行光合作用过程中合成碳水化合物所必需的物质。可以清楚地看到, 生物体的生存是如此显著的依赖于水这个无机小分子。 水是食品中非常重要的一种成分,也是构成大多数食品的主要组分,各种食品都有能显 示其品质特性的含水量(表 2-1)。水的含量、分布和取向不仅对食品的结构、外观、质地、 风味、新鲜程度和腐败变质的敏感性产生极大的影响,而且对生物组织的生命过程也起着至 关重要的作用。水在食品贮藏加工过程中作为化学和生物化学反应的介质,又是水解过程的 反应物。通过干燥或增加食盐、糖的浓度,可使食品中的水分除去或被结合,从而有效地抑 制很多反应的发生和微生物的生长,以延长食品的货架期。水与蛋白质、多糖和脂类通过物 理相互作用影响食品的质构,在大多数新鲜食品中,水是最主要的成分,若希望长期贮藏这 类食品,只要采取有效的贮藏方法 控制水分就能够延长保藏期,无论采用普通方法脱水或 是低温冷冻干燥脱水,食品和生物材料的固有特性都会发生很大的变化,然而任何企图使脱 水食品恢复到它原来的状态(复水和解冻)的尝试都未获得成功。下面我们将讨论水和冰的一 些特性,以控制水在食品加工贮藏过程中的变化和影响。 第一节 水和冰的物理特性 水与元素周期表中邻近氧的某些元素的氢化物,例如 CH4、NH3、HF、H2S、H2Se 和 H2Te 等的物理性质比较,除了粘度外,其他性质均有显著差异。水的熔点、沸点比这些氢 化物要高得多,介电常数、表面张力、热容和相变热(熔融热、蒸发热和升华热)等物理常数 也都异常高,但密度较低。此外,水结冰时体积增大,表现出异常的膨胀特性。水的热导值 大于其他液态物质,冰的热导值略大于非金属固体。0℃时冰的热导值约为同一温度下水的 4 倍,这说明冰的热能传导速率比生物组织中非流动的水快得多。从水和冰的热扩散值可看出 水的固态和液态的温度变化速率,冰的热扩散速率为水的 9 倍;在一定的环境条件下,冰 的温度变化速率比水大得多。水和冰无论是热传导或热扩散值都存在着相当大的差异,因而

可以解释在温差相等的情况下,为什么生物组织的冷冻速度比解冻速度更快。 第二节 水和冰的结构
可以解释在温差相等的情况下,为什么生物组织的冷冻速度比解冻速度更快。 第二节 水和冰的结构

一、 水分子 1. 水分子的结构 水的物理性质表明,水分子之间存在着很强的吸引力,水和冰在三维空间中通过强氢键 缔合形成网络结构。为了解释这些特性,首先从研究单个水分子的性质开始,然后再讨论一 小簇水分子。从分子结构来看,水分子中氧的 6 个价电子参与杂化,形成 4 个 SP3 杂化 轨道,两个氢原子接近氧的两个 SP3 成键轨道 (ф8′,ф4′)结合成两个σ共价键(具有 40%离子特性),即形成一个水分子,每个键的离解能为 4.614×102KJ/mol(110.2kcal/mol), 氧的两个定域分子轨道对称地定向在原来轨道轴的周围,因此,它保持近似四面体的结构。 图 2-1(a)和(b)分别表示水分子的轨道模型和范德华半径。 单个水分子(气态)的键角由于受到了氧的未成键电子对的排斥作用,压缩为 104.5°,接 近正四面体的角度 109°28′,O-H 核间距 0.96Å,氢和氧的范德华半径分别为 1.2 Å 和 1.4 Å。 以上对水的一些描述显得过于简单化,主要是为了便于理解。在纯净的水中除含普通的 水分子外,还存在许多其他微量成分,如由 16O 和 1H 的同位素 17O、18O、2H 和 3H 所构成 的水分子,共有 18 种水分子的同位素变体;此外,水中还有离子微粒如氢离子(以 H3O+ 存在)和氢氧根离子,以及它们的同位素变体,因此,实际上水中总共有 33 种以上 HOH 的 化学变体。同位素变体仅少量存在于水中,因此,在大多数情况下可以忽略不计。 2. 水分子的缔合作用 水分子中的氢、氢原子呈 V 字形排序,O—H 键具有极性,所以分子中的电荷是非对 称分布的。纯水在蒸汽状态下,分子的偶极矩为 1.84D(德拜),这种极性使分子间产生吸 引力,因此,水分子能以相当大的强度缔合。但是只根据水分子有大的偶极矩还不能充分解 释分子间为什么存在着非常大的吸引力,因为偶极矩并不能表示电荷暴露的程度和分子的几
一、 水分子 1. 水分子的结构 水的物理性质表明,水分子之间存在着很强的吸引力,水和冰在三维空间中通过强氢键 缔合形成网络结构。为了解释这些特性,首先从研究单个水分子的性质开始,然后再讨论一 小簇水分子。从分子结构来看,水分子中氧的 6 个价电子参与杂化,形成 4 个 SP3 杂化 轨道,两个氢原子接近氧的两个 SP3 成键轨道 (ф8′,ф4′)结合成两个σ共价键(具有 40%离子特性),即形成一个水分子,每个键的离解能为 4.614×102KJ/mol(110.2kcal/mol), 氧的两个定域分子轨道对称地定向在原来轨道轴的周围,因此,它保持近似四面体的结构。 图 2-1(a)和(b)分别表示水分子的轨道模型和范德华半径。 单个水分子(气态)的键角由于受到了氧的未成键电子对的排斥作用,压缩为 104.5°,接 近正四面体的角度 109°28′,O-H 核间距 0.96Å,氢和氧的范德华半径分别为 1.2 Å 和 1.4 Å。 以上对水的一些描述显得过于简单化,主要是为了便于理解。在纯净的水中除含普通的 水分子外,还存在许多其他微量成分,如由 16O 和 1H 的同位素 17O、18O、2H 和 3H 所构成 的水分子,共有 18 种水分子的同位素变体;此外,水中还有离子微粒如氢离子(以 H3O+ 存在)和氢氧根离子,以及它们的同位素变体,因此,实际上水中总共有 33 种以上 HOH 的 化学变体。同位素变体仅少量存在于水中,因此,在大多数情况下可以忽略不计。 2. 水分子的缔合作用 水分子中的氢、氢原子呈 V 字形排序,O—H 键具有极性,所以分子中的电荷是非对 称分布的。纯水在蒸汽状态下,分子的偶极矩为 1.84D(德拜),这种极性使分子间产生吸 引力,因此,水分子能以相当大的强度缔合。但是只根据水分子有大的偶极矩还不能充分解 释分子间为什么存在着非常大的吸引力,因为偶极矩并不能表示电荷暴露的程度和分子的几

何形状。 由于水分子在三维空间形成多重氢键键合,因而水分子间存在着很大的吸引力。氢键(键 能 2~40KJ/mol)与共价键(平均键能约 355KJ/mol)相比较,其键能很小,键较长,易发生变 化,氧和氢之间的氢键离解能约为 13~25KJ/mol。 水分子中氧原子的电负性大,O—H 键的共用电子对强烈地偏向于氧原子一方,使每个 氢原子带有部分正电荷且电子屏蔽最小,表现出裸质子的特征。氢-氧成键轨道在水分子正 四面体的两个轴上(见图 2-1a),这两个轴代表正力线(氢键给体部位),氧原子的两个孤对电 子轨道位于正四面体的另外两个轴上,它们代表负力线(氢键受体部位),每个水分子最多能 够与另外 4 个水分子通过氢键结合,得到如图 2-2 中表示的四面体排列。由于每个水分子 具有相等数目的氢键给体和受体,能够在三维空间形成氢键网络结构。因此,水分子间的吸 引力比同样靠氢键结合在一起的其他小分子要大得多(例如 NH3 和 HF)。氨分子由 3 个氢 给体和 1 个氢受体形成四面体排列,氟化氢的四面体排列只有 1 个氢给体和 3 个氢受体, 说明它们没有相同数目的氢给体和受体。因此,它们只能在二维空间形成氢键网络结构,并 且每个分子都比水分子含有较少的氢键。 图 2-2 四面体构型中水分子的氢键结合 (虚线表示氢键,大圈和小圈分别表示氧原子和氢原子) 如果还考虑同位素变体、水合氢离子和氢氧根离子,那么水分子间的缔合机理就更加复 杂了。水合氢离子因为带正电荷,它比非离子化的水有更大的氢键给体潜力,氢氧根离子带 负 电 荷 , 比 非 离 子 化 的 水 有 更 大 的 氢 键 受 体 潜 力 ( 图 2-3 和 2-4)
何形状。 由于水分子在三维空间形成多重氢键键合,因而水分子间存在着很大的吸引力。氢键(键 能 2~40KJ/mol)与共价键(平均键能约 355KJ/mol)相比较,其键能很小,键较长,易发生变 化,氧和氢之间的氢键离解能约为 13~25KJ/mol。 水分子中氧原子的电负性大,O—H 键的共用电子对强烈地偏向于氧原子一方,使每个 氢原子带有部分正电荷且电子屏蔽最小,表现出裸质子的特征。氢-氧成键轨道在水分子正 四面体的两个轴上(见图 2-1a),这两个轴代表正力线(氢键给体部位),氧原子的两个孤对电 子轨道位于正四面体的另外两个轴上,它们代表负力线(氢键受体部位),每个水分子最多能 够与另外 4 个水分子通过氢键结合,得到如图 2-2 中表示的四面体排列。由于每个水分子 具有相等数目的氢键给体和受体,能够在三维空间形成氢键网络结构。因此,水分子间的吸 引力比同样靠氢键结合在一起的其他小分子要大得多(例如 NH3 和 HF)。氨分子由 3 个氢 给体和 1 个氢受体形成四面体排列,氟化氢的四面体排列只有 1 个氢给体和 3 个氢受体, 说明它们没有相同数目的氢给体和受体。因此,它们只能在二维空间形成氢键网络结构,并 且每个分子都比水分子含有较少的氢键。 图 2-2 四面体构型中水分子的氢键结合 (虚线表示氢键,大圈和小圈分别表示氧原子和氢原子) 如果还考虑同位素变体、水合氢离子和氢氧根离子,那么水分子间的缔合机理就更加复 杂了。水合氢离子因为带正电荷,它比非离子化的水有更大的氢键给体潜力,氢氧根离子带 负 电 荷 , 比 非 离 子 化 的 水 有 更 大 的 氢 键 受 体 潜 力 ( 图 2-3 和 2-4)

根据水在三维空间形成氢键键合的能力,可以从理论上解释水的许多性质。例如,水的 热容量、熔点、沸点、表面张力和相变热都很大,这些都是因为破坏水分子间的氢键需要供 给足够的能量。水的介电常数也同样受到氢键键合的影响。虽然水分子是一个偶极子,但单 凭这一点还不能满意地解释水的介电常数的大小。水分子之间靠氢键键合而形成的水分子簇 显然会产生多分子偶极子,这将会使水的介电常数明显增大。 二、 冰的结构 事实上,我们对冰的结构比对水的结构了解得更透彻,因此我们首先讨论冰的结构,然 后再介绍水的结构。 1. 纯冰 冰是由水分子有序排列形成的结晶。水分子之间靠氢键连接在一起形成非常稀疏(低密 度)的刚性结构,这一点已通过 X-射线、中子衍射、电子衍射、红外和拉曼光谱分析研究得 到阐明(图 2-5)。最邻近的水分子的 O—O 核间距为 2.76Å,O—O—O 键角约为 109°, 十分接近理想四面体的键角 109°28'。从图 2-5 可以看出,每个水分子能够缔合另外 4 个 水分子即 1,2,3 和 W',形成四面体结构,所以配位数等于 4。 图 2-5 0℃时普通冰的晶胞(圆圈表示水分子中的氧原子) 当我们从顶部沿着 C 轴观察几个晶胞结合在一起的晶胞群时,便可看出冰的正六方形 对称结构,如图 2-6a 所示。图中 W 和最邻近的另外 4 个水分子显示出冰的四面体亚结 构,其中 W、1、2、3 四个水分子可以清楚地看见,第四个水分子正好位于 W 分子所在
根据水在三维空间形成氢键键合的能力,可以从理论上解释水的许多性质。例如,水的 热容量、熔点、沸点、表面张力和相变热都很大,这些都是因为破坏水分子间的氢键需要供 给足够的能量。水的介电常数也同样受到氢键键合的影响。虽然水分子是一个偶极子,但单 凭这一点还不能满意地解释水的介电常数的大小。水分子之间靠氢键键合而形成的水分子簇 显然会产生多分子偶极子,这将会使水的介电常数明显增大。 二、 冰的结构 事实上,我们对冰的结构比对水的结构了解得更透彻,因此我们首先讨论冰的结构,然 后再介绍水的结构。 1. 纯冰 冰是由水分子有序排列形成的结晶。水分子之间靠氢键连接在一起形成非常稀疏(低密 度)的刚性结构,这一点已通过 X-射线、中子衍射、电子衍射、红外和拉曼光谱分析研究得 到阐明(图 2-5)。最邻近的水分子的 O—O 核间距为 2.76Å,O—O—O 键角约为 109°, 十分接近理想四面体的键角 109°28'。从图 2-5 可以看出,每个水分子能够缔合另外 4 个 水分子即 1,2,3 和 W',形成四面体结构,所以配位数等于 4。 图 2-5 0℃时普通冰的晶胞(圆圈表示水分子中的氧原子) 当我们从顶部沿着 C 轴观察几个晶胞结合在一起的晶胞群时,便可看出冰的正六方形 对称结构,如图 2-6a 所示。图中 W 和最邻近的另外 4 个水分子显示出冰的四面体亚结 构,其中 W、1、2、3 四个水分子可以清楚地看见,第四个水分子正好位于 W 分子所在
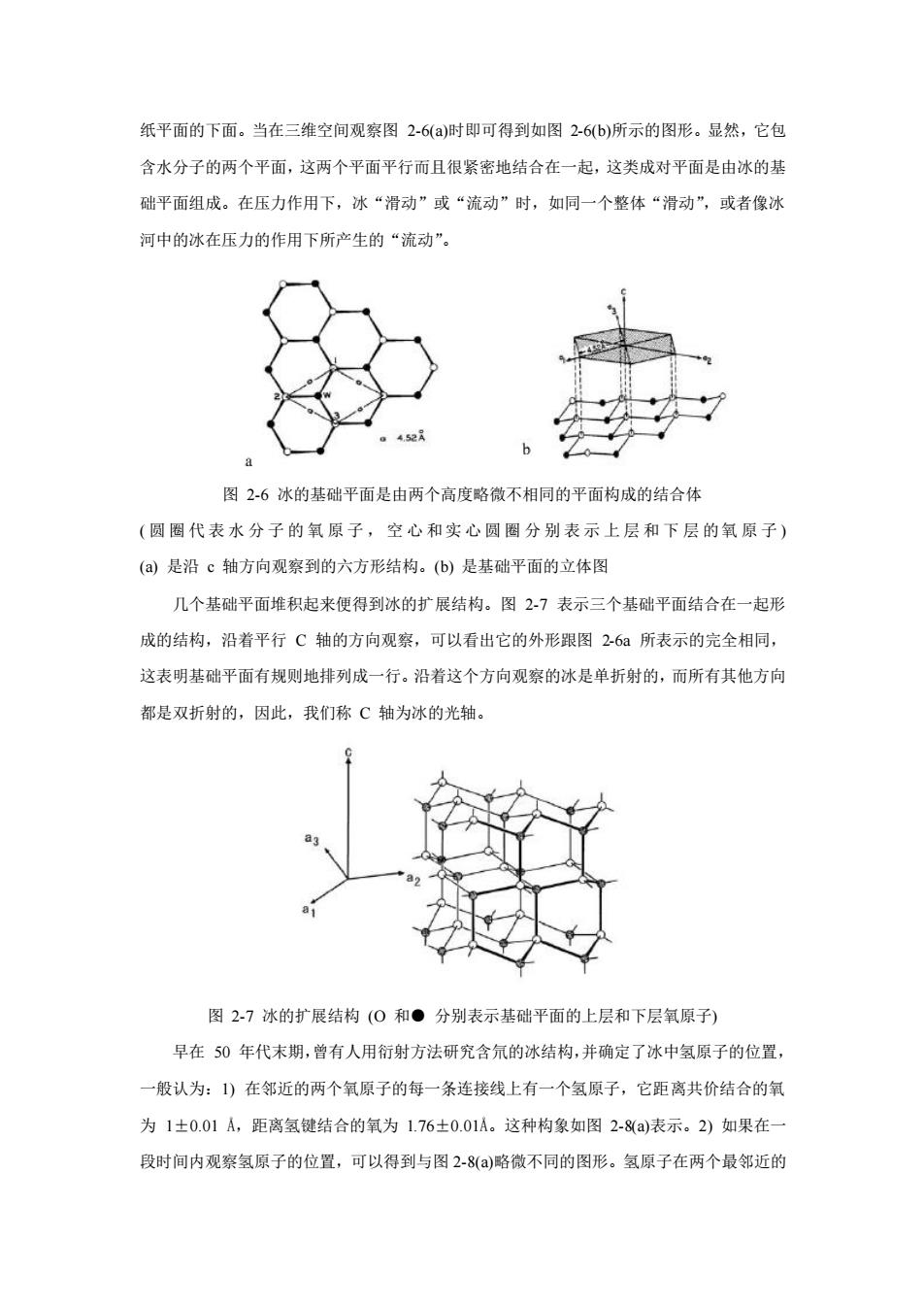
纸平面的下面。当在三维空间观察图 2-6(a)时即可得到如图 2-6(b)所示的图形。显然,它包 含水分子的两个平面,这两个平面平行而且很紧密地结合在一起,这类成对平面是由冰的基 础平面组成。在压力作用下,冰“滑动”或“流动”时,如同一个整体“滑动”,或者像冰 河中的冰在压力的作用下所产生的“流动”。 图 2-6 冰的基础平面是由两个高度略微不相同的平面构成的结合体 ( 圆圈代表水分子的氧原子,空心和实心圆圈分别表示上层和下层的氧原子 ) (a) 是沿 c 轴方向观察到的六方形结构。(b) 是基础平面的立体图 几个基础平面堆积起来便得到冰的扩展结构。图 2-7 表示三个基础平面结合在一起形 成的结构,沿着平行 C 轴的方向观察,可以看出它的外形跟图 2-6a 所表示的完全相同, 这表明基础平面有规则地排列成一行。沿着这个方向观察的冰是单折射的,而所有其他方向 都是双折射的,因此,我们称 C 轴为冰的光轴。 图 2-7 冰的扩展结构 (O 和● 分别表示基础平面的上层和下层氧原子) 早在 50 年代末期,曾有人用衍射方法研究含氘的冰结构,并确定了冰中氢原子的位置, 一般认为:1) 在邻近的两个氧原子的每一条连接线上有一个氢原子,它距离共价结合的氧 为 1±0.01 Å,距离氢键结合的氧为 1.76±0.01Å。这种构象如图 2-8(a)表示。2) 如果在一 段时间内观察氢原子的位置,可以得到与图 2-8(a)略微不同的图形。氢原子在两个最邻近的
纸平面的下面。当在三维空间观察图 2-6(a)时即可得到如图 2-6(b)所示的图形。显然,它包 含水分子的两个平面,这两个平面平行而且很紧密地结合在一起,这类成对平面是由冰的基 础平面组成。在压力作用下,冰“滑动”或“流动”时,如同一个整体“滑动”,或者像冰 河中的冰在压力的作用下所产生的“流动”。 图 2-6 冰的基础平面是由两个高度略微不相同的平面构成的结合体 ( 圆圈代表水分子的氧原子,空心和实心圆圈分别表示上层和下层的氧原子 ) (a) 是沿 c 轴方向观察到的六方形结构。(b) 是基础平面的立体图 几个基础平面堆积起来便得到冰的扩展结构。图 2-7 表示三个基础平面结合在一起形 成的结构,沿着平行 C 轴的方向观察,可以看出它的外形跟图 2-6a 所表示的完全相同, 这表明基础平面有规则地排列成一行。沿着这个方向观察的冰是单折射的,而所有其他方向 都是双折射的,因此,我们称 C 轴为冰的光轴。 图 2-7 冰的扩展结构 (O 和● 分别表示基础平面的上层和下层氧原子) 早在 50 年代末期,曾有人用衍射方法研究含氘的冰结构,并确定了冰中氢原子的位置, 一般认为:1) 在邻近的两个氧原子的每一条连接线上有一个氢原子,它距离共价结合的氧 为 1±0.01 Å,距离氢键结合的氧为 1.76±0.01Å。这种构象如图 2-8(a)表示。2) 如果在一 段时间内观察氢原子的位置,可以得到与图 2-8(a)略微不同的图形。氢原子在两个最邻近的

氧原子 X 和 Y 的连接线上,它可以处于距离 X 轴 1 Å 或距离 Y 轴 1 Å 的两个位置。 这正如鲍林所预言,后来为 Peterson 等人所证实的那样,氢原子占据这两个位置的几率相 等,即氢原子平均占据每个位置各一半的时间,这可能是因为除了在极低温度以外水分子是 可以协同旋转的(cooperative rotation)。另外,氢原子能够在两个邻近的氧原子之间“跳动”。 通常我们把这种平均结构称为半氢、鲍林或统计结构。见图 2-8(B)。 图 2-8 冰结构中氢原子( ● )的位置 (A)瞬时结构;(B)平均结构(也称半氢(● ) 鲍林或统计结构);O 为氧原子 冰有 11 种结晶类型,普通冰的结晶属于六方晶系的双六方双锥体。另外,还有 9 种 同质多晶和 1 种非结晶或玻璃态的无定型结构,在常压和温度 0℃时,这 11 种结构中只 有六方型冰结晶才是稳定的形式。 冰并不完全是由精确排列的水分子组成的静态体系,每个氢原子也不一定恰好位于一对 氧原子之间的连接线上。这是因为:1) 纯冰不仅含有普通水分子,而且还有 H+ (H3O+ )和 OH- 离子以及 HOH 的同位素变体(同位素变体的数量非常少,在大多数情况下可忽略),因此冰 不是一个均匀体系;2) 冰的结晶并不是完整的晶体,通常是有方向性或离子型缺陷的。从 图 2-9 可以看出,当一个水分子与另外 4 个水分子缔合并旋转时,即伴随着中性取向使质 子发生位错(dislocation),或者由于质子在两邻近水分子的连线上跳动,形成 H3O+和 OH- 而引起质子位错。前者属于方向型缺陷,后者是离子型缺陷。冰结晶体中由于水分子的转动 和氢原子的平动所产生的这些缺陷,可以为解释质子在冰中的淌度比在水中大得多,以及当 水结冰时其直流电导略微降低等现象提供理论上的依据
氧原子 X 和 Y 的连接线上,它可以处于距离 X 轴 1 Å 或距离 Y 轴 1 Å 的两个位置。 这正如鲍林所预言,后来为 Peterson 等人所证实的那样,氢原子占据这两个位置的几率相 等,即氢原子平均占据每个位置各一半的时间,这可能是因为除了在极低温度以外水分子是 可以协同旋转的(cooperative rotation)。另外,氢原子能够在两个邻近的氧原子之间“跳动”。 通常我们把这种平均结构称为半氢、鲍林或统计结构。见图 2-8(B)。 图 2-8 冰结构中氢原子( ● )的位置 (A)瞬时结构;(B)平均结构(也称半氢(● ) 鲍林或统计结构);O 为氧原子 冰有 11 种结晶类型,普通冰的结晶属于六方晶系的双六方双锥体。另外,还有 9 种 同质多晶和 1 种非结晶或玻璃态的无定型结构,在常压和温度 0℃时,这 11 种结构中只 有六方型冰结晶才是稳定的形式。 冰并不完全是由精确排列的水分子组成的静态体系,每个氢原子也不一定恰好位于一对 氧原子之间的连接线上。这是因为:1) 纯冰不仅含有普通水分子,而且还有 H+ (H3O+ )和 OH- 离子以及 HOH 的同位素变体(同位素变体的数量非常少,在大多数情况下可忽略),因此冰 不是一个均匀体系;2) 冰的结晶并不是完整的晶体,通常是有方向性或离子型缺陷的。从 图 2-9 可以看出,当一个水分子与另外 4 个水分子缔合并旋转时,即伴随着中性取向使质 子发生位错(dislocation),或者由于质子在两邻近水分子的连线上跳动,形成 H3O+和 OH- 而引起质子位错。前者属于方向型缺陷,后者是离子型缺陷。冰结晶体中由于水分子的转动 和氢原子的平动所产生的这些缺陷,可以为解释质子在冰中的淌度比在水中大得多,以及当 水结冰时其直流电导略微降低等现象提供理论上的依据

图 2-9 冰中质子缺陷示意图 (A) 定向作用形成的方向性缺陷 (B) 离子型缺陷 除晶体产生缺陷而引起原子的迁移外,冰还有其他“活动”形式。在温度-10℃时,冰 中的每个 HOH 分子以大约 0.4Å 均方根的振幅振动,以及冰的某些孔隙中的 HOH 分子缓 慢地扩散通过晶格。这说明冰并不是一种静态或均匀的体系。冰的 HOH 分子在温度接近 -180℃或更低时,不会发生氢键断裂,全部氢键保持原来完整的状态。随着温度上升,由于 热运动体系混乱程度增大,原来的氢键平均数将会逐渐减少。食品和生物材料在低温下贮藏 时的变质速度与冰的“活动”程度有关。 2. 溶质对冰晶结构的影响 溶质的种类和数量可以影响冰晶的数量、大小、结构、位置和取向。下面我们仅讨论溶 质对冰晶结构的影响。Luyet 等人研究了各种溶质,例如蔗糖、甘油、明胶、清蛋白、肌球 蛋白和聚乙烯吡咯烷酮(PVP)存在时生成的冰结晶体的性质。他还根据形态、对称要素 (elements of symmetry)和形成各种冰结构所需的冷却速率,对冰的结构进行分类,并观察到 如下四种主要类型:六方型;不规则树枝状;粗糙球状;易消失的球晶。此外,还存在各种 各样中间形式的结晶。 六方型是大多数冷冻食品中重要的冰结晶形式,它是一种高度有序的普通结构。样品在 最适度的低温冷却剂中缓慢冷冻,并且溶质的性质及浓度均不严重干扰水分子的迁移时,才 有可能形成六方型冰结晶。然而高浓度明胶水溶液冷冻时则形成具有较大无序性的冰结构。 Dowell 等在研究冰冻的明胶溶液时发现,随着冷冻速度增大或明胶浓度的提高,主要 形成六方型和玻璃状冰结晶。显然,像明胶这类大而复杂的亲水性分子,不仅能限制水分子 的运动,而且阻碍水形成高度有序的六方型结晶。尽管在食品和生物材料中除形成六方晶型 外,也能形成其他形式的结晶,但这些晶型一般是不常见的。 三、 水的结构
图 2-9 冰中质子缺陷示意图 (A) 定向作用形成的方向性缺陷 (B) 离子型缺陷 除晶体产生缺陷而引起原子的迁移外,冰还有其他“活动”形式。在温度-10℃时,冰 中的每个 HOH 分子以大约 0.4Å 均方根的振幅振动,以及冰的某些孔隙中的 HOH 分子缓 慢地扩散通过晶格。这说明冰并不是一种静态或均匀的体系。冰的 HOH 分子在温度接近 -180℃或更低时,不会发生氢键断裂,全部氢键保持原来完整的状态。随着温度上升,由于 热运动体系混乱程度增大,原来的氢键平均数将会逐渐减少。食品和生物材料在低温下贮藏 时的变质速度与冰的“活动”程度有关。 2. 溶质对冰晶结构的影响 溶质的种类和数量可以影响冰晶的数量、大小、结构、位置和取向。下面我们仅讨论溶 质对冰晶结构的影响。Luyet 等人研究了各种溶质,例如蔗糖、甘油、明胶、清蛋白、肌球 蛋白和聚乙烯吡咯烷酮(PVP)存在时生成的冰结晶体的性质。他还根据形态、对称要素 (elements of symmetry)和形成各种冰结构所需的冷却速率,对冰的结构进行分类,并观察到 如下四种主要类型:六方型;不规则树枝状;粗糙球状;易消失的球晶。此外,还存在各种 各样中间形式的结晶。 六方型是大多数冷冻食品中重要的冰结晶形式,它是一种高度有序的普通结构。样品在 最适度的低温冷却剂中缓慢冷冻,并且溶质的性质及浓度均不严重干扰水分子的迁移时,才 有可能形成六方型冰结晶。然而高浓度明胶水溶液冷冻时则形成具有较大无序性的冰结构。 Dowell 等在研究冰冻的明胶溶液时发现,随着冷冻速度增大或明胶浓度的提高,主要 形成六方型和玻璃状冰结晶。显然,像明胶这类大而复杂的亲水性分子,不仅能限制水分子 的运动,而且阻碍水形成高度有序的六方型结晶。尽管在食品和生物材料中除形成六方晶型 外,也能形成其他形式的结晶,但这些晶型一般是不常见的。 三、 水的结构

纯水是具有一定结构的液体,但还不足以构成长程有序的刚性结构,要阐明水的结构是 一个非常复杂的问题,人们已经发现液态水的分子排列远比气态水分子更为有序,在液态水 中,水的分子并不是以单个分子形式存在,而是由若干个分子靠氢键缔合形成大分子 (H2O)n,因此水分子的取向和运动都将受到周围其他水分子的明显影响,下面的一些事实 可以进一步证明这一点:1) 液态水是一种“稀疏”(open)液体,其密度仅相当于紧密堆积的 非结构液体的 60%。这是因为氢键键合形成了规则排列的四面体,这种结构使水的密度降 低。从冰的结构也可以解释水密度降低的原因。2) 冰的熔化热大,足以破坏水中 15%左右 的氢键。虽然在水中不一定需要保留可能存在的全部氢键的 85%(例如,可能有更多的氢键 破坏,能量变化将被同时增大的范德华相互作用力所补偿),实际上很可能仍然有相当多的 氢键存在,因而使水分子保持广泛的氢键缔合。3) 根据水的许多其他性质和 X-射线、核磁 共振、红外和拉曼光谱分析测定的结果,以及水的计算机模拟体系的研究,进一步证明水分 子具有这种缔合作用。 Stillinger 的研究结果表明,在室温或低于室温下,液态水中包含着连续的三维氢键轨 道,这种由氢键构成的网络结构为四面体形状,其中有很多变形的和断裂的键。水分子的这 种排列是动态的,它们之间的氢键可迅速断裂,同时通过彼此交换又可形成新的氢键,因此 能很快地改变各个分子氢键键合的排列方式。但在恒温时整个体系可以保持氢键键合程度不 变的完整网络。 关于水的结构目前提出了三种结构模型:即混合型结构、填隙结构和连续结构(或均匀 结构)模型。混合型结构体现了分子之间氢键的概念,由于水分子间的氢键相互作用,它们 短暂聚集成由 3、4、5 或 8 聚体等构成的庞大水分子簇。这些水分子簇与其他更紧密的分 子处于动态平衡(水分子簇的瞬间寿命约为 10-11 秒)。 连续结构模型的概念是分子间的氢键均匀地分布在整个水体系中,当冰熔化时,许多氢 键发生变形(更确切地说是断裂)。根据这个模型可以认为水分子的动态连续网络结构是存 在的。 填隙结构模型是指水保留了一个像冰或者是笼形的结构,单个水分子填满整个笼的间隙 空间。以上 3 种模型主要的结构特征是液态水以短暂的氢键缔合形成扭曲的四面体结构, 在所有这些模型中单个水分子之间的氢键是在频繁地交换,一个氢键一旦断裂则随即迅速转 变成另一个新的氢键。在恒定的温度下,从宏观观点看,整个体系的氢键缔合程度和网络结 构是保持不变的;然而从微观角度讲,各个氢键是处在一个不停的运动状态,而且氢键的破 坏和形成之间建立了一个动态平衡
纯水是具有一定结构的液体,但还不足以构成长程有序的刚性结构,要阐明水的结构是 一个非常复杂的问题,人们已经发现液态水的分子排列远比气态水分子更为有序,在液态水 中,水的分子并不是以单个分子形式存在,而是由若干个分子靠氢键缔合形成大分子 (H2O)n,因此水分子的取向和运动都将受到周围其他水分子的明显影响,下面的一些事实 可以进一步证明这一点:1) 液态水是一种“稀疏”(open)液体,其密度仅相当于紧密堆积的 非结构液体的 60%。这是因为氢键键合形成了规则排列的四面体,这种结构使水的密度降 低。从冰的结构也可以解释水密度降低的原因。2) 冰的熔化热大,足以破坏水中 15%左右 的氢键。虽然在水中不一定需要保留可能存在的全部氢键的 85%(例如,可能有更多的氢键 破坏,能量变化将被同时增大的范德华相互作用力所补偿),实际上很可能仍然有相当多的 氢键存在,因而使水分子保持广泛的氢键缔合。3) 根据水的许多其他性质和 X-射线、核磁 共振、红外和拉曼光谱分析测定的结果,以及水的计算机模拟体系的研究,进一步证明水分 子具有这种缔合作用。 Stillinger 的研究结果表明,在室温或低于室温下,液态水中包含着连续的三维氢键轨 道,这种由氢键构成的网络结构为四面体形状,其中有很多变形的和断裂的键。水分子的这 种排列是动态的,它们之间的氢键可迅速断裂,同时通过彼此交换又可形成新的氢键,因此 能很快地改变各个分子氢键键合的排列方式。但在恒温时整个体系可以保持氢键键合程度不 变的完整网络。 关于水的结构目前提出了三种结构模型:即混合型结构、填隙结构和连续结构(或均匀 结构)模型。混合型结构体现了分子之间氢键的概念,由于水分子间的氢键相互作用,它们 短暂聚集成由 3、4、5 或 8 聚体等构成的庞大水分子簇。这些水分子簇与其他更紧密的分 子处于动态平衡(水分子簇的瞬间寿命约为 10-11 秒)。 连续结构模型的概念是分子间的氢键均匀地分布在整个水体系中,当冰熔化时,许多氢 键发生变形(更确切地说是断裂)。根据这个模型可以认为水分子的动态连续网络结构是存 在的。 填隙结构模型是指水保留了一个像冰或者是笼形的结构,单个水分子填满整个笼的间隙 空间。以上 3 种模型主要的结构特征是液态水以短暂的氢键缔合形成扭曲的四面体结构, 在所有这些模型中单个水分子之间的氢键是在频繁地交换,一个氢键一旦断裂则随即迅速转 变成另一个新的氢键。在恒定的温度下,从宏观观点看,整个体系的氢键缔合程度和网络结 构是保持不变的;然而从微观角度讲,各个氢键是处在一个不停的运动状态,而且氢键的破 坏和形成之间建立了一个动态平衡

氢键的键合程度取决于温度,在 0℃时冰中水分子的配位数为 4,最邻近的水分子间的 距离为 2.76?,冰熔化时一部分氢键断裂(最邻近的水分子间的距离增大),同时,刚性结构 受到破坏,水分子自身重新排列成为更紧密的网络结构,这与大量氢键的扭曲变形和熔化潜 热的输入有关。随着温度上升,水的配位数增多。例如,0℃时冰中水分子的配位数为 4, 水在 1.5℃和 83℃时的配位数分别为 4.4 和 4.9。而邻近的水分子之间的距离则随着温度升 高而加大,从 0℃时的 2.76?增至 1.5℃时 2.9? 和 83℃时的 3.05?。显然,水的密度随着 邻近分子间距离的增大而降低,当邻近水分子平均数增多时其结果是密度增加,所以冰转变 成水时,净密度增大,当继续温和加热至 3.98℃时密度可达到最大值。随着温度继续上升 即密度开始逐渐下降。显然,在温度 0℃和 3.98℃之间水分子的配位数增多,水的密度增 大,而温度超过 3.98℃时,由于热膨胀使邻近水分子间的距离增大。 水的低粘度与结构有关,因为氢键网络是动态的,当分子在纳秒甚至皮秒这样短暂的时 间内改变它们与邻近分子之间的氢键键合关系时,会增大分子的淌度(或流动性)。 第三节 水与溶质间的相互作用 一、 一般概念 向水中添加各种不同的物质,不仅会改变被添加物质的性质,水本身的性质也会发生明 显的变化。亲水性物质靠离子-偶极或偶极-偶极相互作用同水强烈地相互作用,因而改变了 水的结构和流动性,以及亲水性物质的结构和反应性。被添加物质的疏水基团与邻近的水分 子仅产生微弱的相互作用,邻近疏水基团的水比纯水的结构更为有序。这种热力学上不利的 变化过程,是由于熵减小的原因引起的。为使这种热力学上不利的变化降低到最小的程度, 必须尽可能使疏水基团聚集,以便让它们同水分子的接触机会减小至最低限度,这种过程称 为疏水相互作用。 在讨论水与溶质相互作用的特性之前,首先介绍几个有关的术语,即水结合(water binding)、水合作用(hydration)、结合水(bound water)和持水容量(water holding capacity)。 水结合和水合作用这两个术语的含意,是说明水和亲水性物质缔合程度的强弱。水结合 或水合作用的强弱,取决于体系中非水成分的性质、盐的组成、pH 和温度等许多因素。 对于结合水曾有人下过几种定义,但在概念上不够清楚,容易混淆。现列举如下: (1) 结合水是指在某一温度和相对湿度时,生物或食品样品中的平衡水分含量。 (2) 高频时结合水对介电常数不起重要作用,这说明结合水的转动迁移率受到与水缔合 的物质的限制。 (3) 结合水在确定的某一低温(一般是-40℃或者更低)条件下不能够结冰
氢键的键合程度取决于温度,在 0℃时冰中水分子的配位数为 4,最邻近的水分子间的 距离为 2.76?,冰熔化时一部分氢键断裂(最邻近的水分子间的距离增大),同时,刚性结构 受到破坏,水分子自身重新排列成为更紧密的网络结构,这与大量氢键的扭曲变形和熔化潜 热的输入有关。随着温度上升,水的配位数增多。例如,0℃时冰中水分子的配位数为 4, 水在 1.5℃和 83℃时的配位数分别为 4.4 和 4.9。而邻近的水分子之间的距离则随着温度升 高而加大,从 0℃时的 2.76?增至 1.5℃时 2.9? 和 83℃时的 3.05?。显然,水的密度随着 邻近分子间距离的增大而降低,当邻近水分子平均数增多时其结果是密度增加,所以冰转变 成水时,净密度增大,当继续温和加热至 3.98℃时密度可达到最大值。随着温度继续上升 即密度开始逐渐下降。显然,在温度 0℃和 3.98℃之间水分子的配位数增多,水的密度增 大,而温度超过 3.98℃时,由于热膨胀使邻近水分子间的距离增大。 水的低粘度与结构有关,因为氢键网络是动态的,当分子在纳秒甚至皮秒这样短暂的时 间内改变它们与邻近分子之间的氢键键合关系时,会增大分子的淌度(或流动性)。 第三节 水与溶质间的相互作用 一、 一般概念 向水中添加各种不同的物质,不仅会改变被添加物质的性质,水本身的性质也会发生明 显的变化。亲水性物质靠离子-偶极或偶极-偶极相互作用同水强烈地相互作用,因而改变了 水的结构和流动性,以及亲水性物质的结构和反应性。被添加物质的疏水基团与邻近的水分 子仅产生微弱的相互作用,邻近疏水基团的水比纯水的结构更为有序。这种热力学上不利的 变化过程,是由于熵减小的原因引起的。为使这种热力学上不利的变化降低到最小的程度, 必须尽可能使疏水基团聚集,以便让它们同水分子的接触机会减小至最低限度,这种过程称 为疏水相互作用。 在讨论水与溶质相互作用的特性之前,首先介绍几个有关的术语,即水结合(water binding)、水合作用(hydration)、结合水(bound water)和持水容量(water holding capacity)。 水结合和水合作用这两个术语的含意,是说明水和亲水性物质缔合程度的强弱。水结合 或水合作用的强弱,取决于体系中非水成分的性质、盐的组成、pH 和温度等许多因素。 对于结合水曾有人下过几种定义,但在概念上不够清楚,容易混淆。现列举如下: (1) 结合水是指在某一温度和相对湿度时,生物或食品样品中的平衡水分含量。 (2) 高频时结合水对介电常数不起重要作用,这说明结合水的转动迁移率受到与水缔合 的物质的限制。 (3) 结合水在确定的某一低温(一般是-40℃或者更低)条件下不能够结冰