
食品化学实验指导 指导老师:张平安 河南农业大学食品科学技术学院
食品化学实验指导 指导老师:张平安 河南农业大学食品科学技术学院

目 录 实验一 水分的测定(烘重量法) 实验二 食品水分活度的测定(直接测定法) 实验三 食品水分活度(aw)的测定(水分活度仪测定法) 实验四 粗灰分的测定(干式灰化法) 实验五 总酸的测定(滴定法) 实验六 还原糖的测定 实验七 淀粉含量的测定 实验八 淀粉含量的测定(碘量法) 实验九 美拉德反应初始阶段的测定 实验十 果胶的提取和果酱的制备 实验十一 淀粉糊化及酶法制备淀粉糖浆及其葡萄糖值的测定 实验十二 豆类淀粉和薯类淀粉的老化(粉丝的制备与质量感官评价) 实验十三 粗脂肪的测定(索氏抽提法) 实验十四 脂肪氧化、过氧化值及酸价的测定(滴定法) 实验十五 大豆中油脂和蛋白质的分离 实验十六 蛋白质的盐析和透析 实验十七 蛋白质的功能性质(一) 实验十八 蛋白质的功能性质(二) 实验十九 粗蛋白质的测定(微量凯氏定氮法) 实验二十 可溶性蛋白质的测定(考马斯亮蓝 G-250 法) 实验二十一 茚三酮法测定氨基酸总量 实验二十二 维生素 C 含量的测定 (2,6-二氯酚靛酚法) 实验二十三 维生素 C 含量的测定(紫外快速测定法) 实验二十四 总抗坏血酸含量的测定(荧光法) 实验二十五 从番茄中提取番茄红素和β—胡萝卜素 实验二十六 β-胡萝卜素含量的测定(HPLC 法) 实验二十七 类黄酮含量的测定(HPLC 法) 实验二十八 绿色果蔬分离叶绿素及其含量测定 实验二十九 水果皮颜色和淀粉白度的测量(测色色差计的使用) 实验三十 食品感官质量评价
目 录 实验一 水分的测定(烘重量法) 实验二 食品水分活度的测定(直接测定法) 实验三 食品水分活度(aw)的测定(水分活度仪测定法) 实验四 粗灰分的测定(干式灰化法) 实验五 总酸的测定(滴定法) 实验六 还原糖的测定 实验七 淀粉含量的测定 实验八 淀粉含量的测定(碘量法) 实验九 美拉德反应初始阶段的测定 实验十 果胶的提取和果酱的制备 实验十一 淀粉糊化及酶法制备淀粉糖浆及其葡萄糖值的测定 实验十二 豆类淀粉和薯类淀粉的老化(粉丝的制备与质量感官评价) 实验十三 粗脂肪的测定(索氏抽提法) 实验十四 脂肪氧化、过氧化值及酸价的测定(滴定法) 实验十五 大豆中油脂和蛋白质的分离 实验十六 蛋白质的盐析和透析 实验十七 蛋白质的功能性质(一) 实验十八 蛋白质的功能性质(二) 实验十九 粗蛋白质的测定(微量凯氏定氮法) 实验二十 可溶性蛋白质的测定(考马斯亮蓝 G-250 法) 实验二十一 茚三酮法测定氨基酸总量 实验二十二 维生素 C 含量的测定 (2,6-二氯酚靛酚法) 实验二十三 维生素 C 含量的测定(紫外快速测定法) 实验二十四 总抗坏血酸含量的测定(荧光法) 实验二十五 从番茄中提取番茄红素和β—胡萝卜素 实验二十六 β-胡萝卜素含量的测定(HPLC 法) 实验二十七 类黄酮含量的测定(HPLC 法) 实验二十八 绿色果蔬分离叶绿素及其含量测定 实验二十九 水果皮颜色和淀粉白度的测量(测色色差计的使用) 实验三十 食品感官质量评价

1 实验一 水分的测定(烘重量法) 一、原理 常用的果蔬新鲜原料含水量的测定,是将称重后的果蔬置于烘箱中烘去水分,其失重为 水分重量。在烘干过程中,果蔬中的结合水,在 100℃以下不易烘干,若在 105℃以上,样 品中一些有机物质(如脂肪)是易氧化使干重增加,而果蔬中的糖分,在 100℃上下则易分 解,也可使测定产生误差,故烘干温度先为 60-70℃,至接近全干时再改用 100-105℃干燥。 二、材料、仪器与试剂 (一)材料:苹果、梨、黄瓜、番茄等。 (二)仪器:烘箱或真空干燥箱、分析天平、称量瓶、干燥器。 (三)试剂:氯化钙、变色硅胶 三、操作步骤 (一)常压干燥法:取分析样品,果实可除去果核,蔬菜可除去非食用部分,洗净切碎, 混匀待用。取称量瓶,放入烘箱中以 100-105℃烘干(至恒重),置干燥器中冷却,然后精 确称量。取分析样品 5-10g 放入称量瓶中精确称重,然后将称量瓶放入烘箱中,先在 60-70℃ 烘 2-3h 至样品变脆,再以 100-105℃烘 2h。取出后置有吸湿剂变色硅胶或干燥氯化钙的干 燥器中,冷却后称重,再一次继续烘 0.5-1h。冷却称重,直至两次重量差不超过 0.4mg 为止。 (二)减压干燥法:适用于在 100-105℃容易分解的食品,如味精类、糖类、含脂肪高的 食品类。 在已知重量的称量瓶内称取样品 5-10g,置真空干燥箱中,将真空干燥箱的温度调至 60-70℃,真空度调至 79980Pa,加热干燥样品至恒重。 四、计算 (a-b)×100 水分(%)=—————— W 式中:a——干燥前样品重+称量瓶重(g) b——干燥后样品重+称量瓶重(g) W——样品重量(g) 五、注意事项 (一)在测定干燥粘稠度大、水分也多,不容易干燥的样品,如乳制品、含糖高的糕点、 肉与肉制品等时,可将其放在内含有 10-20g 海砂和一根玻璃棒的已知恒重的蒸发皿中,在 砂浴上不断搅拌,使之干燥,然后放入 100-105℃烘箱中,烘至恒重。 (二)样品如加热至 100℃引起分解,应改为减压干燥法或干燥器内干燥至恒重
1 实验一 水分的测定(烘重量法) 一、原理 常用的果蔬新鲜原料含水量的测定,是将称重后的果蔬置于烘箱中烘去水分,其失重为 水分重量。在烘干过程中,果蔬中的结合水,在 100℃以下不易烘干,若在 105℃以上,样 品中一些有机物质(如脂肪)是易氧化使干重增加,而果蔬中的糖分,在 100℃上下则易分 解,也可使测定产生误差,故烘干温度先为 60-70℃,至接近全干时再改用 100-105℃干燥。 二、材料、仪器与试剂 (一)材料:苹果、梨、黄瓜、番茄等。 (二)仪器:烘箱或真空干燥箱、分析天平、称量瓶、干燥器。 (三)试剂:氯化钙、变色硅胶 三、操作步骤 (一)常压干燥法:取分析样品,果实可除去果核,蔬菜可除去非食用部分,洗净切碎, 混匀待用。取称量瓶,放入烘箱中以 100-105℃烘干(至恒重),置干燥器中冷却,然后精 确称量。取分析样品 5-10g 放入称量瓶中精确称重,然后将称量瓶放入烘箱中,先在 60-70℃ 烘 2-3h 至样品变脆,再以 100-105℃烘 2h。取出后置有吸湿剂变色硅胶或干燥氯化钙的干 燥器中,冷却后称重,再一次继续烘 0.5-1h。冷却称重,直至两次重量差不超过 0.4mg 为止。 (二)减压干燥法:适用于在 100-105℃容易分解的食品,如味精类、糖类、含脂肪高的 食品类。 在已知重量的称量瓶内称取样品 5-10g,置真空干燥箱中,将真空干燥箱的温度调至 60-70℃,真空度调至 79980Pa,加热干燥样品至恒重。 四、计算 (a-b)×100 水分(%)=—————— W 式中:a——干燥前样品重+称量瓶重(g) b——干燥后样品重+称量瓶重(g) W——样品重量(g) 五、注意事项 (一)在测定干燥粘稠度大、水分也多,不容易干燥的样品,如乳制品、含糖高的糕点、 肉与肉制品等时,可将其放在内含有 10-20g 海砂和一根玻璃棒的已知恒重的蒸发皿中,在 砂浴上不断搅拌,使之干燥,然后放入 100-105℃烘箱中,烘至恒重。 (二)样品如加热至 100℃引起分解,应改为减压干燥法或干燥器内干燥至恒重
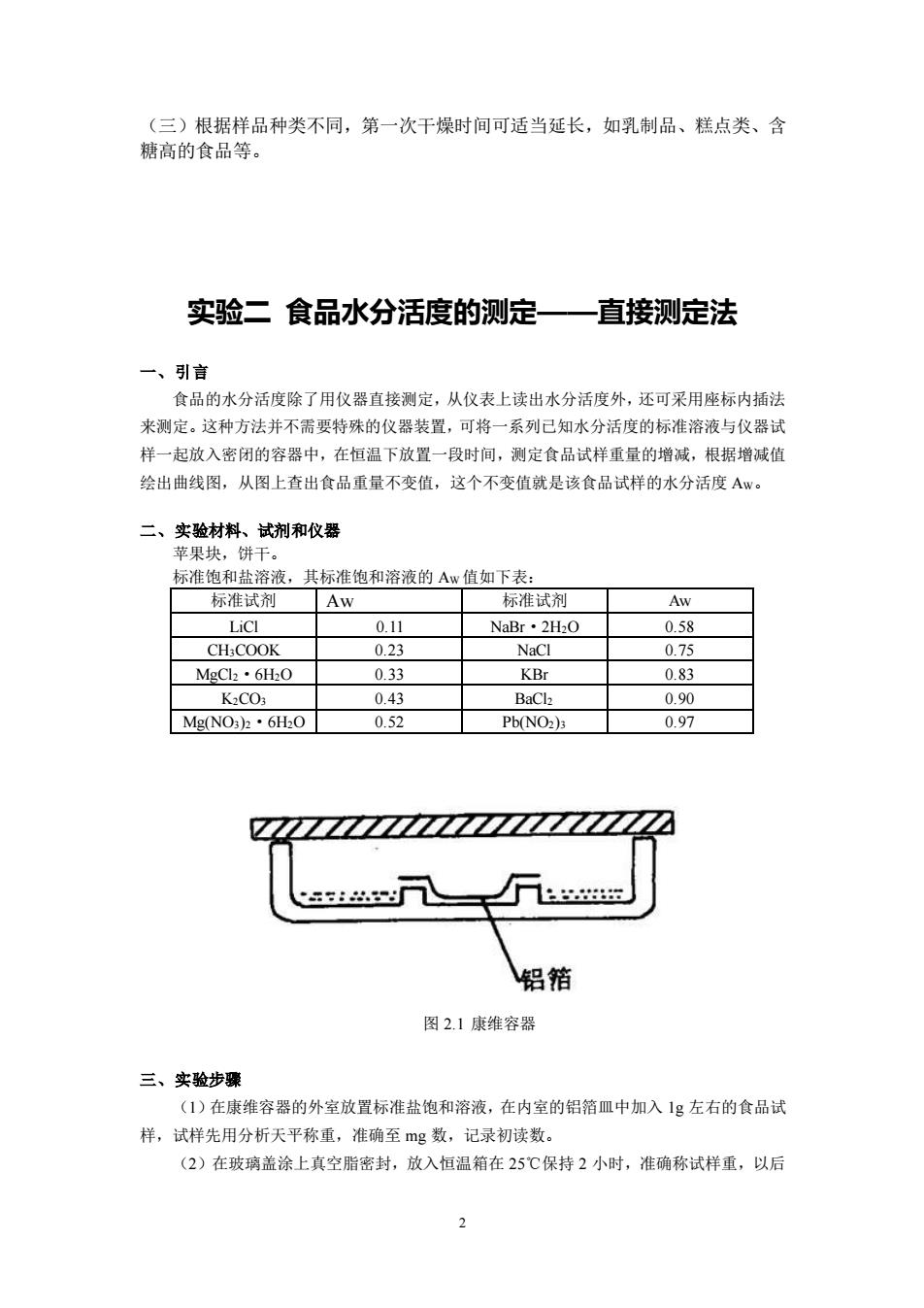
2 (三)根据样品种类不同,第一次干燥时间可适当延长,如乳制品、糕点类、含 糖高的食品等。 实验二 食品水分活度的测定——直接测定法 一、引言 食品的水分活度除了用仪器直接测定,从仪表上读出水分活度外,还可采用座标内插法 来测定。这种方法并不需要特殊的仪器装置,可将一系列已知水分活度的标准溶液与仪器试 样一起放入密闭的容器中,在恒温下放置一段时间,测定食品试样重量的增减,根据增减值 绘出曲线图,从图上查出食品重量不变值,这个不变值就是该食品试样的水分活度 AW。 二、实验材料、试剂和仪器 苹果块,饼干。 标准饱和盐溶液,其标准饱和溶液的 AW 值如下表: 标准试剂 Aw 标准试剂 Aw LiCl 0.11 NaBr·2H2O 0.58 CH3COOK 0.23 NaCl 0.75 MgCl2·6H2O 0.33 KBr 0.83 K2CO3 0.43 BaCl2 0.90 Mg(NO3)2·6H2O 0.52 Pb(NO2)3 0.97 图 2.1 康维容器 三、实验步骤 (1)在康维容器的外室放置标准盐饱和溶液,在内室的铝箔皿中加入 1g 左右的食品试 样,试样先用分析天平称重,准确至 mg 数,记录初读数。 (2)在玻璃盖涂上真空脂密封,放入恒温箱在 25℃保持 2 小时,准确称试样重,以后
2 (三)根据样品种类不同,第一次干燥时间可适当延长,如乳制品、糕点类、含 糖高的食品等。 实验二 食品水分活度的测定——直接测定法 一、引言 食品的水分活度除了用仪器直接测定,从仪表上读出水分活度外,还可采用座标内插法 来测定。这种方法并不需要特殊的仪器装置,可将一系列已知水分活度的标准溶液与仪器试 样一起放入密闭的容器中,在恒温下放置一段时间,测定食品试样重量的增减,根据增减值 绘出曲线图,从图上查出食品重量不变值,这个不变值就是该食品试样的水分活度 AW。 二、实验材料、试剂和仪器 苹果块,饼干。 标准饱和盐溶液,其标准饱和溶液的 AW 值如下表: 标准试剂 Aw 标准试剂 Aw LiCl 0.11 NaBr·2H2O 0.58 CH3COOK 0.23 NaCl 0.75 MgCl2·6H2O 0.33 KBr 0.83 K2CO3 0.43 BaCl2 0.90 Mg(NO3)2·6H2O 0.52 Pb(NO2)3 0.97 图 2.1 康维容器 三、实验步骤 (1)在康维容器的外室放置标准盐饱和溶液,在内室的铝箔皿中加入 1g 左右的食品试 样,试样先用分析天平称重,准确至 mg 数,记录初读数。 (2)在玻璃盖涂上真空脂密封,放入恒温箱在 25℃保持 2 小时,准确称试样重,以后
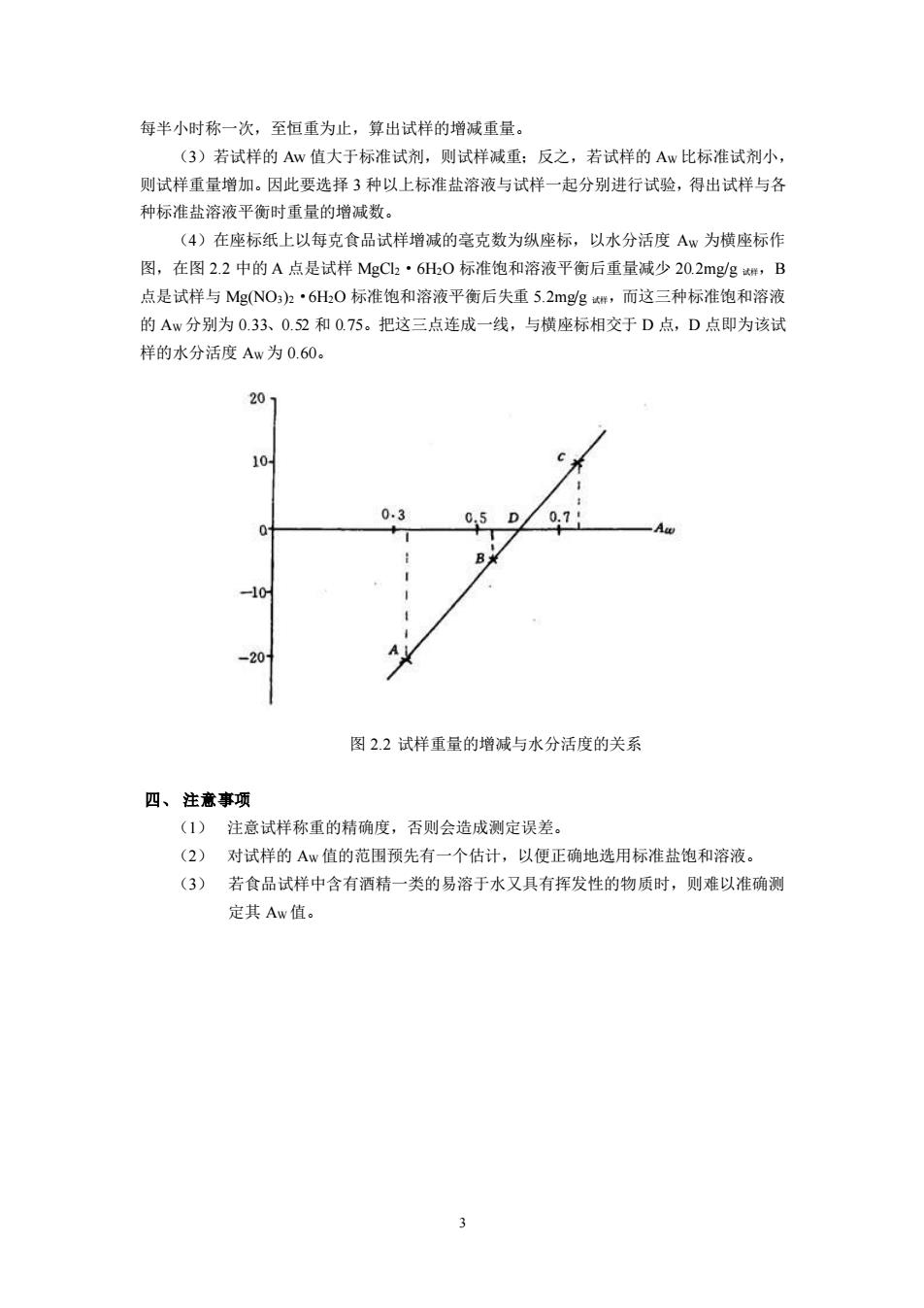
3 每半小时称一次,至恒重为止,算出试样的增减重量。 (3)若试样的 Aw 值大于标准试剂,则试样减重;反之,若试样的 AW 比标准试剂小, 则试样重量增加。因此要选择 3 种以上标准盐溶液与试样一起分别进行试验,得出试样与各 种标准盐溶液平衡时重量的增减数。 (4)在座标纸上以每克食品试样增减的毫克数为纵座标,以水分活度 AW 为横座标作 图,在图 2.2 中的 A 点是试样 MgCl2·6H2O 标准饱和溶液平衡后重量减少 20.2mg/g 试样,B 点是试样与 Mg(NO3)2·6H2O 标准饱和溶液平衡后失重 5.2mg/g 试样,而这三种标准饱和溶液 的 AW 分别为 0.33、0.52 和 0.75。把这三点连成一线,与横座标相交于 D 点,D 点即为该试 样的水分活度 AW 为 0.60。 图 2.2 试样重量的增减与水分活度的关系 四、 注意事项 (1) 注意试样称重的精确度,否则会造成测定误差。 (2) 对试样的 AW 值的范围预先有一个估计,以便正确地选用标准盐饱和溶液。 (3) 若食品试样中含有酒精一类的易溶于水又具有挥发性的物质时,则难以准确测 定其 AW 值
3 每半小时称一次,至恒重为止,算出试样的增减重量。 (3)若试样的 Aw 值大于标准试剂,则试样减重;反之,若试样的 AW 比标准试剂小, 则试样重量增加。因此要选择 3 种以上标准盐溶液与试样一起分别进行试验,得出试样与各 种标准盐溶液平衡时重量的增减数。 (4)在座标纸上以每克食品试样增减的毫克数为纵座标,以水分活度 AW 为横座标作 图,在图 2.2 中的 A 点是试样 MgCl2·6H2O 标准饱和溶液平衡后重量减少 20.2mg/g 试样,B 点是试样与 Mg(NO3)2·6H2O 标准饱和溶液平衡后失重 5.2mg/g 试样,而这三种标准饱和溶液 的 AW 分别为 0.33、0.52 和 0.75。把这三点连成一线,与横座标相交于 D 点,D 点即为该试 样的水分活度 AW 为 0.60。 图 2.2 试样重量的增减与水分活度的关系 四、 注意事项 (1) 注意试样称重的精确度,否则会造成测定误差。 (2) 对试样的 AW 值的范围预先有一个估计,以便正确地选用标准盐饱和溶液。 (3) 若食品试样中含有酒精一类的易溶于水又具有挥发性的物质时,则难以准确测 定其 AW 值

4 实验三 食品水分活度(AW)的测定—— 水分活度 仪测定法 一、引言 食品中的水是以自由态、水合态、胶体吸润态、表面吸附态等状态存在的。不同状态的 水可分为两类:由氢键结合力联系着的水称为结合水;以毛细管力系着的水称为自由水。自 由水能被微生物所利用,结合水则不能。食品中含水分量,不能说明这些水是否都能被微生 物所利用,对食品的生产和保藏均缺乏科学的指导作用;而水分活度则反映食品与水的亲和 能力大小,表示食品中所含的水分作为生物化学反应和微生物生长的可用价值。 水分活度近似地表示为在某一温度下溶液中水蒸汽分压与纯水蒸汽压之比值。拉乌尔 定德(Raoult’s Law)指出,当溶质溶于水,水分子与溶质分子变成定向关系从而减少水分 子从液相进入汽相的逸度,使溶液的蒸汽压降低,稀溶液蒸气压降低度与溶质的摩尔分数成 正比。水分活度也可用平衡时大气的相对湿度(ERH)来计算。故水分活度(AW)可用下 式表示: p no ERH AW=——=————=——— Po n1+n0 100 式中:P—样品中水的分压; Po—相同温度下纯水的蒸汽压; no—水的摩尔数; n1—溶液的摩尔数; ERH——样品周围大气的平衡相对湿度(%)。 水分活度测定仪主要是在一定温度下利用仪器装置中的湿敏元件,根据食品中水蒸汽 压力的变化,从仪器表头上读出指针所示的水分活度。本实验要求掌握利用水分活度测定仪 测定食品水分活度的方法和了解食品中水分存在的状态。 二、实验材料、试剂和仪器 苹果块,市售蜜饯,面包,饼干。 氯化钡饱和溶液。 SJN5021 型水分活度测定仪(无锡江宁机械厂)。 三、实验步骤(当所用的水分活度测定仪不同时,按照仪器说明书进行操作) (1)将等量的纯水及捣碎的样品(约 2g)迅速放入测试盒,拧紧盖子密封,并通过转 接电缆插入“纯水”及“样品”插孔。固体样品应碾碎成米粒大小,并摊平在盒底。 (2)把稳压电源输出插头插入“外接电源”插孔(如果不外接电源,则可使用直流电), 打开电源开关,预热 15 分钟,如果显示屏上出现“E”,表示溢出,按“清零”按钮。 (3)调节“校正 II”电位器,使显示为 100.00±0.05。 (4)按下“活度”开关,调节“校正 I”电位器,使显示为 1.000±0.001
4 实验三 食品水分活度(AW)的测定—— 水分活度 仪测定法 一、引言 食品中的水是以自由态、水合态、胶体吸润态、表面吸附态等状态存在的。不同状态的 水可分为两类:由氢键结合力联系着的水称为结合水;以毛细管力系着的水称为自由水。自 由水能被微生物所利用,结合水则不能。食品中含水分量,不能说明这些水是否都能被微生 物所利用,对食品的生产和保藏均缺乏科学的指导作用;而水分活度则反映食品与水的亲和 能力大小,表示食品中所含的水分作为生物化学反应和微生物生长的可用价值。 水分活度近似地表示为在某一温度下溶液中水蒸汽分压与纯水蒸汽压之比值。拉乌尔 定德(Raoult’s Law)指出,当溶质溶于水,水分子与溶质分子变成定向关系从而减少水分 子从液相进入汽相的逸度,使溶液的蒸汽压降低,稀溶液蒸气压降低度与溶质的摩尔分数成 正比。水分活度也可用平衡时大气的相对湿度(ERH)来计算。故水分活度(AW)可用下 式表示: p no ERH AW=——=————=——— Po n1+n0 100 式中:P—样品中水的分压; Po—相同温度下纯水的蒸汽压; no—水的摩尔数; n1—溶液的摩尔数; ERH——样品周围大气的平衡相对湿度(%)。 水分活度测定仪主要是在一定温度下利用仪器装置中的湿敏元件,根据食品中水蒸汽 压力的变化,从仪器表头上读出指针所示的水分活度。本实验要求掌握利用水分活度测定仪 测定食品水分活度的方法和了解食品中水分存在的状态。 二、实验材料、试剂和仪器 苹果块,市售蜜饯,面包,饼干。 氯化钡饱和溶液。 SJN5021 型水分活度测定仪(无锡江宁机械厂)。 三、实验步骤(当所用的水分活度测定仪不同时,按照仪器说明书进行操作) (1)将等量的纯水及捣碎的样品(约 2g)迅速放入测试盒,拧紧盖子密封,并通过转 接电缆插入“纯水”及“样品”插孔。固体样品应碾碎成米粒大小,并摊平在盒底。 (2)把稳压电源输出插头插入“外接电源”插孔(如果不外接电源,则可使用直流电), 打开电源开关,预热 15 分钟,如果显示屏上出现“E”,表示溢出,按“清零”按钮。 (3)调节“校正 II”电位器,使显示为 100.00±0.05。 (4)按下“活度”开关,调节“校正 I”电位器,使显示为 1.000±0.001
5 (5)等测试盒内平衡半小时后(若室温低于 25℃,则需平衡 50 分钟),按下相应的“样 品测定”开关,即可读出样品的水分活度(AW)值(读数时,取小数点后面三位数)。 (6)测量相对湿度时,将“活度”开关复位,然后按相应的“样品测定”开关,显示的数 值即为所测空间的相对湿度。 (7)关机,清洗并吹干测试盒,放入干燥剂,盖上盖子,拧紧密封。 四、注意事项 (1)在测定前,仪器一般用标准溶液进行校正。下面是几种常用盐饱和溶液在 25℃时 水分活度的理论值(如果不符,要更换湿敏元件)。 氯化钡(BaCl2·2H2O) 0.901 溴化钾(KBr) 0.842 氯化钾(KCl) 0.807 氯化钠(NaCl) 0.752 硝酸钠(NaNO3) 0.737 (2)环境不同,应对标准值进行修正。 温度℃ 校正数 温度℃ 校正数 15 -0.010 21 +0.002 16 -0.008 22 +0.004 17 -0.006 23 +0.006 18 -0.004 24 +0.008 19 -0.002 25 +0.010 20 ±0.00 (3)测定时切勿使湿敏元件沾上样品盒内样品。 (4)本仪器应避免测量含二氧化硫、氨气、酸和碱等腐蚀性样品。 (5)每次测量时间不应超过一小时
5 (5)等测试盒内平衡半小时后(若室温低于 25℃,则需平衡 50 分钟),按下相应的“样 品测定”开关,即可读出样品的水分活度(AW)值(读数时,取小数点后面三位数)。 (6)测量相对湿度时,将“活度”开关复位,然后按相应的“样品测定”开关,显示的数 值即为所测空间的相对湿度。 (7)关机,清洗并吹干测试盒,放入干燥剂,盖上盖子,拧紧密封。 四、注意事项 (1)在测定前,仪器一般用标准溶液进行校正。下面是几种常用盐饱和溶液在 25℃时 水分活度的理论值(如果不符,要更换湿敏元件)。 氯化钡(BaCl2·2H2O) 0.901 溴化钾(KBr) 0.842 氯化钾(KCl) 0.807 氯化钠(NaCl) 0.752 硝酸钠(NaNO3) 0.737 (2)环境不同,应对标准值进行修正。 温度℃ 校正数 温度℃ 校正数 15 -0.010 21 +0.002 16 -0.008 22 +0.004 17 -0.006 23 +0.006 18 -0.004 24 +0.008 19 -0.002 25 +0.010 20 ±0.00 (3)测定时切勿使湿敏元件沾上样品盒内样品。 (4)本仪器应避免测量含二氧化硫、氨气、酸和碱等腐蚀性样品。 (5)每次测量时间不应超过一小时

6 实验四 粗灰分的测定(干式灰化法) 一、原理 将食物样品灼烧,使其中的有机物氧化成 CO2,H2O 及 N,S 的氧化物挥发掉,无机盐 类转变成金属氧化物残留下来,这部分残留物就是灰分。由于有机物燃烧不完全,有残余的 碳存在,故称之为粗灰分。除去残余碳后,称之为真灰分。 通过灼烧的手段分解食品样品的方法,称为干灰化法。 二、材料与仪器 (一)材料:水果、蔬菜、其它加工食品。 (二)仪器:瓷坩埚、长柄坩埚钳、干燥器、马福炉、分析天平。 三、操作步骤 将洗净的瓷坩埚放入马福炉中,在 500-600℃灼烧 0.5h,冷却至 200℃后,用坩埚钳将 其取出,放入干燥器中冷却到室温后,精确称重 W。 取固体样品 2-5g,或液体样品 5-10g,放入坩埚中,称重 W1,然后在电炉上加热使样 品碳化至无烟。易发泡的含糖、淀粉、蛋白质等较多的样品,可预先在样品中滴加几滴纯植 物油。 液体样品先在水浴上蒸干,再放电炉上加热,直至碳化。 将坩埚移至马福炉中,在 525℃±25℃下灼烧灰化至碳微粒消失,样品呈灰白色止,冷 却至 200℃后,用坩埚钳取出坩埚,放入干燥器中冷却至室温。精确称重。再灼烧 1h,冷却、 称重,两次称重相差不超过 0.5mg 为恒重 W2。 四、计算 W2—W0 粗灰分% = —————×100% W1—W0 式中:W0——坩埚重量(g) W1——坩埚和样品重量(g) W2——坩埚和粗灰分重量(g) 五、注意事项 (一)坩埚在使用前应先用稀盐酸煮沸 1h,冼净,烘干后再使用。 (二)灼烧温度过高或升温太快,会引起钠、钾的氯化物挥发损失,而且钠、钾的磷酸 盐和硅酸盐也易熔融而把碳粒包藏起来不易烧尽
6 实验四 粗灰分的测定(干式灰化法) 一、原理 将食物样品灼烧,使其中的有机物氧化成 CO2,H2O 及 N,S 的氧化物挥发掉,无机盐 类转变成金属氧化物残留下来,这部分残留物就是灰分。由于有机物燃烧不完全,有残余的 碳存在,故称之为粗灰分。除去残余碳后,称之为真灰分。 通过灼烧的手段分解食品样品的方法,称为干灰化法。 二、材料与仪器 (一)材料:水果、蔬菜、其它加工食品。 (二)仪器:瓷坩埚、长柄坩埚钳、干燥器、马福炉、分析天平。 三、操作步骤 将洗净的瓷坩埚放入马福炉中,在 500-600℃灼烧 0.5h,冷却至 200℃后,用坩埚钳将 其取出,放入干燥器中冷却到室温后,精确称重 W。 取固体样品 2-5g,或液体样品 5-10g,放入坩埚中,称重 W1,然后在电炉上加热使样 品碳化至无烟。易发泡的含糖、淀粉、蛋白质等较多的样品,可预先在样品中滴加几滴纯植 物油。 液体样品先在水浴上蒸干,再放电炉上加热,直至碳化。 将坩埚移至马福炉中,在 525℃±25℃下灼烧灰化至碳微粒消失,样品呈灰白色止,冷 却至 200℃后,用坩埚钳取出坩埚,放入干燥器中冷却至室温。精确称重。再灼烧 1h,冷却、 称重,两次称重相差不超过 0.5mg 为恒重 W2。 四、计算 W2—W0 粗灰分% = —————×100% W1—W0 式中:W0——坩埚重量(g) W1——坩埚和样品重量(g) W2——坩埚和粗灰分重量(g) 五、注意事项 (一)坩埚在使用前应先用稀盐酸煮沸 1h,冼净,烘干后再使用。 (二)灼烧温度过高或升温太快,会引起钠、钾的氯化物挥发损失,而且钠、钾的磷酸 盐和硅酸盐也易熔融而把碳粒包藏起来不易烧尽

7 实验五 总酸的测定(滴定法) 一、原理 果汁具有酸性反应,这些反应取决于游离态的酸以及酸式盐存在的数量。总酸度包括未 解离酸的浓度和已解离酸的浓度。酸的浓度以摩尔浓度表示时,称为总酸度。含量用滴定法 测定。果蔬中含有各种有机酸,主要有苹果酸、柠檬酸、酒石酸、草酸.。果蔬种类不同, 含有机酸的种类和数量也不同,食品中酸的测定是根据酸碱中和的原理,即用标定的氢氧化 钠溶液进行滴定。 二、材料、仪器与试剂 (一)材料:桃、杏、苹果、蔬菜等 (二)仪器:碱式滴定管(20ml)、容量瓶(100ml)、移液管(10ml)、烧杯(100ml)、 研钵或组织捣碎机、天平、漏斗、滤纸等。 (三)试剂 1.0.1mol/L 氢氧化钠:称 4.0g 氢氧化钠定容至 1000ml,然后用 0.1mol/L 邻苯二甲酸 氢钾标定,若浓度太高可酌情稀释。 2.1%酚酞指示剂:称 1.0g 酚酞,加入 100ml 50%的乙醇溶解。 三、操作步骤 准确称取混合均匀磨碎的样品 10.0g(或吸 10.0ml 样品液),转移到 100ml 容量瓶中, 加蒸馏水至刻度、摇匀。用滤纸过滤,准确吸取滤液 20ml 放入 100ml 三角瓶中,加入 1% 酚酞 2 滴,用标定的氢氧化钠滴定至初显粉色在 0.5min 内不褪色为终点,记下氢氧化钠用 量,重复三次,取平均值。 四、计算 V C×N×折算系数 总酸度(%)=——×————————×100 W V1 式中:V——样品稀释总体积(ml) V1——滴定时取样液体积 C——消耗氢氧化钠标准液毫升数 N——氢氧化钠标准液摩尔浓度 W——样品重量(g) 折算系数:即不同有机酸的毫摩尔质量(g/mmol),食品中的总酸度往往根据所含酸的 不同,而取其中一种主要有机酸计量。食品中常见的有机酸以及其毫摩尔质量折算系数加下: 苹果酸——0.067(苹果、梨、桃、杏、李子、番茄、莴苣) 醋酸——0.060(蔬菜罐头)
7 实验五 总酸的测定(滴定法) 一、原理 果汁具有酸性反应,这些反应取决于游离态的酸以及酸式盐存在的数量。总酸度包括未 解离酸的浓度和已解离酸的浓度。酸的浓度以摩尔浓度表示时,称为总酸度。含量用滴定法 测定。果蔬中含有各种有机酸,主要有苹果酸、柠檬酸、酒石酸、草酸.。果蔬种类不同, 含有机酸的种类和数量也不同,食品中酸的测定是根据酸碱中和的原理,即用标定的氢氧化 钠溶液进行滴定。 二、材料、仪器与试剂 (一)材料:桃、杏、苹果、蔬菜等 (二)仪器:碱式滴定管(20ml)、容量瓶(100ml)、移液管(10ml)、烧杯(100ml)、 研钵或组织捣碎机、天平、漏斗、滤纸等。 (三)试剂 1.0.1mol/L 氢氧化钠:称 4.0g 氢氧化钠定容至 1000ml,然后用 0.1mol/L 邻苯二甲酸 氢钾标定,若浓度太高可酌情稀释。 2.1%酚酞指示剂:称 1.0g 酚酞,加入 100ml 50%的乙醇溶解。 三、操作步骤 准确称取混合均匀磨碎的样品 10.0g(或吸 10.0ml 样品液),转移到 100ml 容量瓶中, 加蒸馏水至刻度、摇匀。用滤纸过滤,准确吸取滤液 20ml 放入 100ml 三角瓶中,加入 1% 酚酞 2 滴,用标定的氢氧化钠滴定至初显粉色在 0.5min 内不褪色为终点,记下氢氧化钠用 量,重复三次,取平均值。 四、计算 V C×N×折算系数 总酸度(%)=——×————————×100 W V1 式中:V——样品稀释总体积(ml) V1——滴定时取样液体积 C——消耗氢氧化钠标准液毫升数 N——氢氧化钠标准液摩尔浓度 W——样品重量(g) 折算系数:即不同有机酸的毫摩尔质量(g/mmol),食品中的总酸度往往根据所含酸的 不同,而取其中一种主要有机酸计量。食品中常见的有机酸以及其毫摩尔质量折算系数加下: 苹果酸——0.067(苹果、梨、桃、杏、李子、番茄、莴苣) 醋酸——0.060(蔬菜罐头)

8 酒石酸——0.075(葡萄) 柠檬酸——0.070(柑橘类) 乳酸——0.090(鱼、肉罐头、牛奶) 实验六 还原糖的测定 一、引言 还原糖是指具有还原性的糖类。在糖类中,分子中含有游离醛基或酮基的单糖和含有 游离潜醛基的双糖都具有还原性。葡萄糖分子中含有游离醛基、果糖分子中含有游离酮基, 乳糖和麦芽糖分子中含有游离的潜醛基,故它们都是还原糖。其他双糖(如蔗糖)、三糖乃 至多糖(如糊精、淀粉等),其本身不具还原性,属于非还原性糖,但都可以通过水解而生 成相应的还原性单糖,测定水解液的还原糖含量就可以求得样品中相应糖类的含量。因此, 还原糖的测定是一般糖类定量的基础。 二、原理 将一定量的碱性酒石酸铜甲、乙液等量混合,立即生成天蓝色的氢氧化铜沉淀,这种 沉淀很快与酒石酸钾钠反应,生成深蓝色的可溶性酒石酸钾钠铜络合物。在加热条件下,以 次甲基蓝作为指示剂,用样液滴定,样液中的还原糖与酒石酸钾钠铜反应,生成红色的氧化 亚铜沉淀,待二价铜全部被还原后,稍过量的还原糖把次甲基蓝还原,溶液由蓝色变为无色, 即为滴定终点。根据样液消耗量可计算出还原糖含量。各步反应式(以葡萄糖为例)如下: (1)CuSO4+2NaOH===2Cu(OH)2↓+Na2SO4
8 酒石酸——0.075(葡萄) 柠檬酸——0.070(柑橘类) 乳酸——0.090(鱼、肉罐头、牛奶) 实验六 还原糖的测定 一、引言 还原糖是指具有还原性的糖类。在糖类中,分子中含有游离醛基或酮基的单糖和含有 游离潜醛基的双糖都具有还原性。葡萄糖分子中含有游离醛基、果糖分子中含有游离酮基, 乳糖和麦芽糖分子中含有游离的潜醛基,故它们都是还原糖。其他双糖(如蔗糖)、三糖乃 至多糖(如糊精、淀粉等),其本身不具还原性,属于非还原性糖,但都可以通过水解而生 成相应的还原性单糖,测定水解液的还原糖含量就可以求得样品中相应糖类的含量。因此, 还原糖的测定是一般糖类定量的基础。 二、原理 将一定量的碱性酒石酸铜甲、乙液等量混合,立即生成天蓝色的氢氧化铜沉淀,这种 沉淀很快与酒石酸钾钠反应,生成深蓝色的可溶性酒石酸钾钠铜络合物。在加热条件下,以 次甲基蓝作为指示剂,用样液滴定,样液中的还原糖与酒石酸钾钠铜反应,生成红色的氧化 亚铜沉淀,待二价铜全部被还原后,稍过量的还原糖把次甲基蓝还原,溶液由蓝色变为无色, 即为滴定终点。根据样液消耗量可计算出还原糖含量。各步反应式(以葡萄糖为例)如下: (1)CuSO4+2NaOH===2Cu(OH)2↓+Na2SO4