
2 第九章 羧酸及其衍生物和取代酸 第一节 羧酸 一 羧酸的物理性质 二 羧酸的化学性质 (一)化学性质一览表 (二)羧酸的酸性 (三)羧酸衍生物的生成 (四)还原反应 (五)脱羧反应 (六)α- 氢原子的反应
2 第九章 羧酸及其衍生物和取代酸 第一节 羧酸 一 羧酸的物理性质 二 羧酸的化学性质 (一)化学性质一览表 (二)羧酸的酸性 (三)羧酸衍生物的生成 (四)还原反应 (五)脱羧反应 (六)α- 氢原子的反应

3 第二节 羧酸衍生物 一 羧酸衍生物的物理性质 二 羧酸衍生物的化学性质 (一)水解、醇解和氨解 (二)还原反应 (三)酰胺氮原子上的反应 三 互变异构现象
3 第二节 羧酸衍生物 一 羧酸衍生物的物理性质 二 羧酸衍生物的化学性质 (一)水解、醇解和氨解 (二)还原反应 (三)酰胺氮原子上的反应 三 互变异构现象

4 【本章重点】 1. 羧酸的酸性及诱导效应。 2. 羧酸及其衍生物的化学性质,羧酸衍生物的加成 – 消去反应历程。 【必须掌握的内容】 1. 羧酸及其衍生物的物理性质。 2. 羧酸的化学性质——结构与酸性、羧酸衍生物的生 成、脱羧反应及α-H卤代反应等。 第九章 羧酸及其衍生物和取代酸
4 【本章重点】 1. 羧酸的酸性及诱导效应。 2. 羧酸及其衍生物的化学性质,羧酸衍生物的加成 – 消去反应历程。 【必须掌握的内容】 1. 羧酸及其衍生物的物理性质。 2. 羧酸的化学性质——结构与酸性、羧酸衍生物的生 成、脱羧反应及α-H卤代反应等。 第九章 羧酸及其衍生物和取代酸
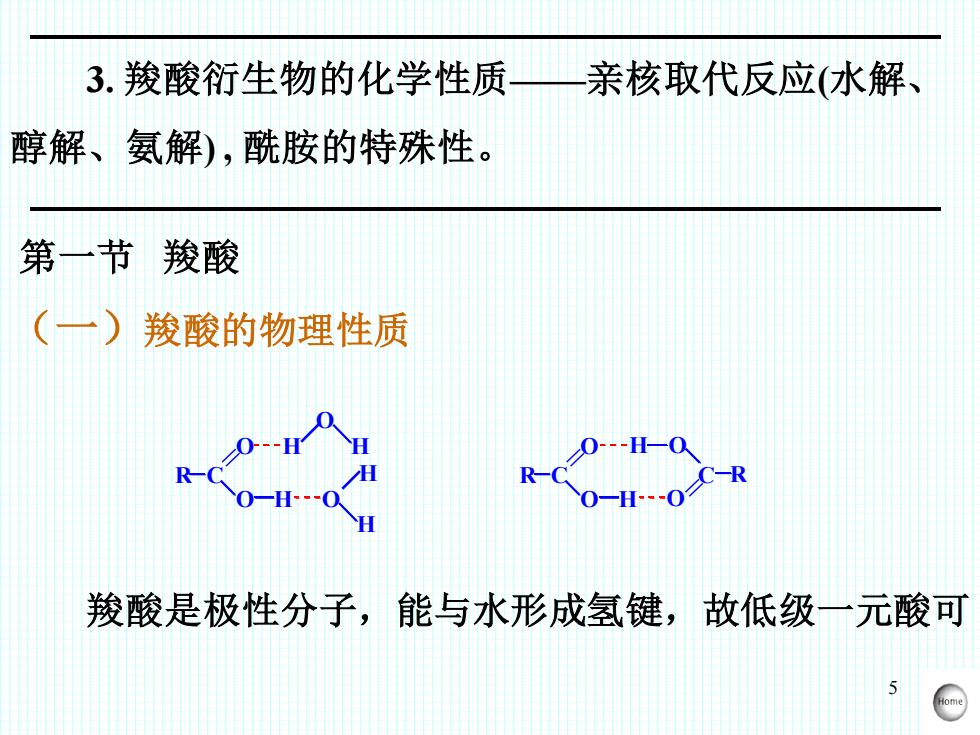
5 3. 羧酸衍生物的化学性质——亲核取代反应(水解、 醇解、氨解) , 酰胺的特殊性。 第一节 羧酸 (一)羧酸的物理性质 R C = O O H H O H H O H R C = O O H C O = H O R 羧酸是极性分子,能与水形成氢键,故低级一元酸可
5 3. 羧酸衍生物的化学性质——亲核取代反应(水解、 醇解、氨解) , 酰胺的特殊性。 第一节 羧酸 (一)羧酸的物理性质 R C = O O H H O H H O H R C = O O H C O = H O R 羧酸是极性分子,能与水形成氢键,故低级一元酸可
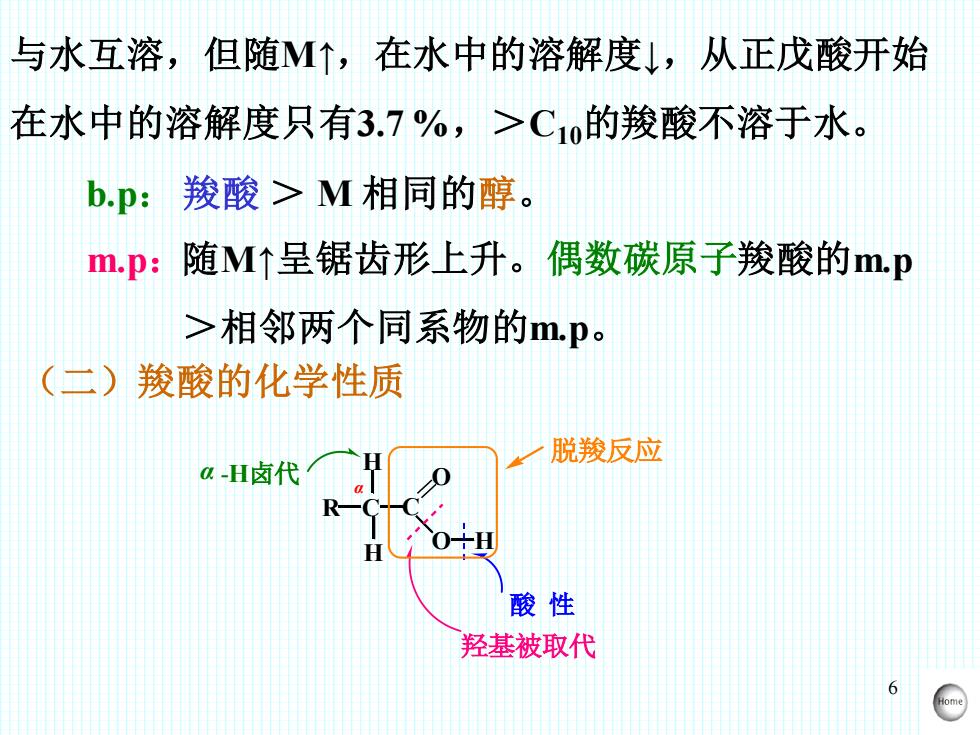
6 与水互溶,但随M↑,在水中的溶解度↓,从正戊酸开始 在水中的溶解度只有3.7 %,>C10的羧酸不溶于水。 b.p: 羧酸 > M 相同的醇。 m.p:随M↑呈锯齿形上升。偶数碳原子羧酸的m.p >相邻两个同系物的m.p。 (二)羧酸的化学性质 R C C = O O H H H 酸 性 羟基被取代 脱羧反应 α α -H卤代
6 与水互溶,但随M↑,在水中的溶解度↓,从正戊酸开始 在水中的溶解度只有3.7 %,>C10的羧酸不溶于水。 b.p: 羧酸 > M 相同的醇。 m.p:随M↑呈锯齿形上升。偶数碳原子羧酸的m.p >相邻两个同系物的m.p。 (二)羧酸的化学性质 R C C = O O H H H 酸 性 羟基被取代 脱羧反应 α α -H卤代
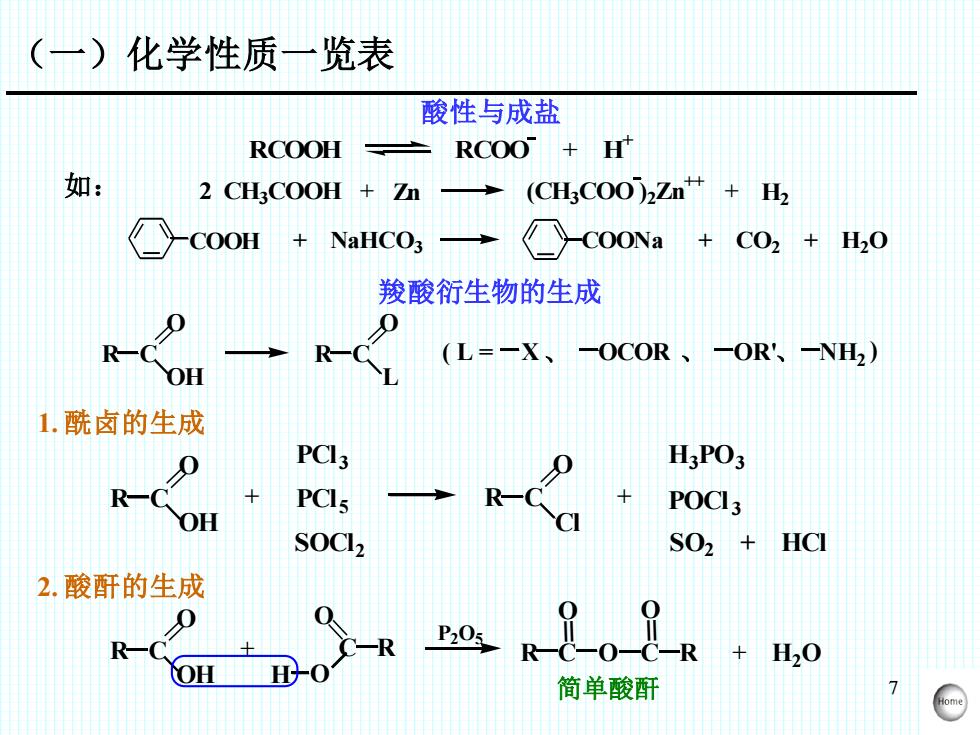
7 RCOOH RCOO + H + 2 CH3COOH + Zn (CH3COO ) 2Zn ++ + H2 COOH + NaHCO3 COONa + CO2 + H2O 如: 羧酸衍生物的生成 R C = O OH L R C = O ( L = X、 OCOR 、 OR' 、 NH2 ) 1. 酰卤的生成 R C = O OH + PCl 3 PCl 5 SOCl 2 R C = O Cl + H3 PO3 POCl 3 SO2 + HCl 2. 酸酐的生成 R C = O OH = O + C R O H O P2O5 R C = O C = O R + H2O 简单酸酐 酸性与成盐 (一)化学性质一览表
7 RCOOH RCOO + H + 2 CH3COOH + Zn (CH3COO ) 2Zn ++ + H2 COOH + NaHCO3 COONa + CO2 + H2O 如: 羧酸衍生物的生成 R C = O OH L R C = O ( L = X、 OCOR 、 OR' 、 NH2 ) 1. 酰卤的生成 R C = O OH + PCl 3 PCl 5 SOCl 2 R C = O Cl + H3 PO3 POCl 3 SO2 + HCl 2. 酸酐的生成 R C = O OH = O + C R O H O P2O5 R C = O C = O R + H2O 简单酸酐 酸性与成盐 (一)化学性质一览表
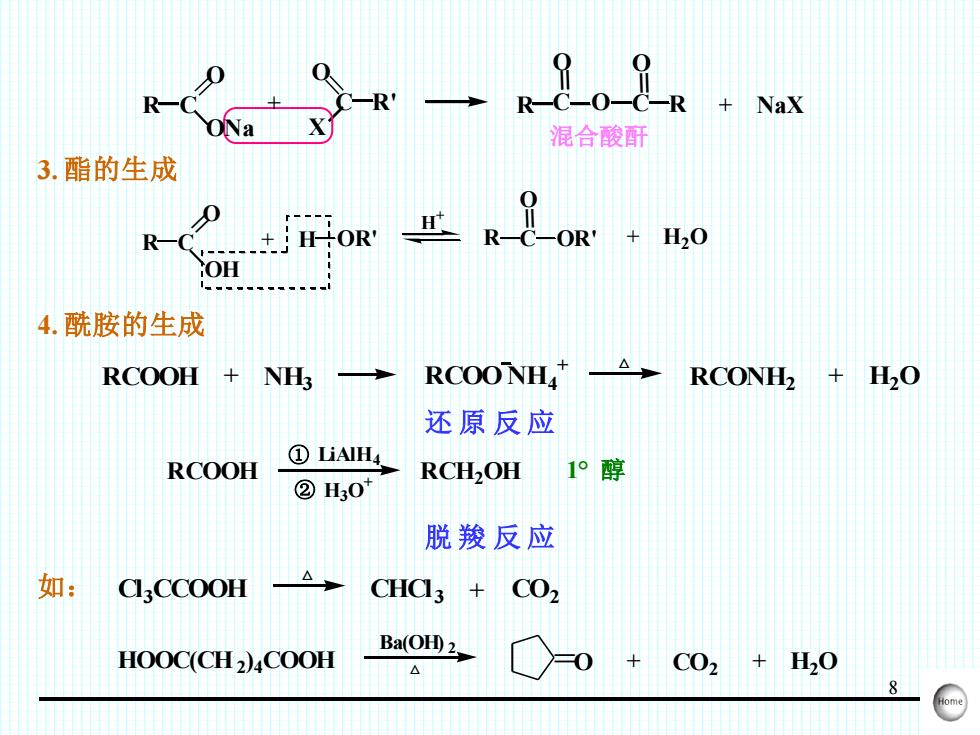
8 R C = O ONa = + C R' O X O R C = O C = O R 混合酸酐 + NaX 3. 酯的生成 R C = O OH O + R C = H OR' OR' + H2O H + 4. 酰胺的生成 RCOOH + NH3 RCOO NH4 + △ RCONH2 + H2O 还 原 反 应 RCOOH ① ② LiAlH4 H3O + RCH2OH 1°醇 脱 羧 反 应 如: △ Cl 3CCOOH CHCl 3 + CO2 HOOC(CH2 ) 4COOH + CO2 + H2O Ba(OH) 2 △ =O
8 R C = O ONa = + C R' O X O R C = O C = O R 混合酸酐 + NaX 3. 酯的生成 R C = O OH O + R C = H OR' OR' + H2O H + 4. 酰胺的生成 RCOOH + NH3 RCOO NH4 + △ RCONH2 + H2O 还 原 反 应 RCOOH ① ② LiAlH4 H3O + RCH2OH 1°醇 脱 羧 反 应 如: △ Cl 3CCOOH CHCl 3 + CO2 HOOC(CH2 ) 4COOH + CO2 + H2O Ba(OH) 2 △ =O
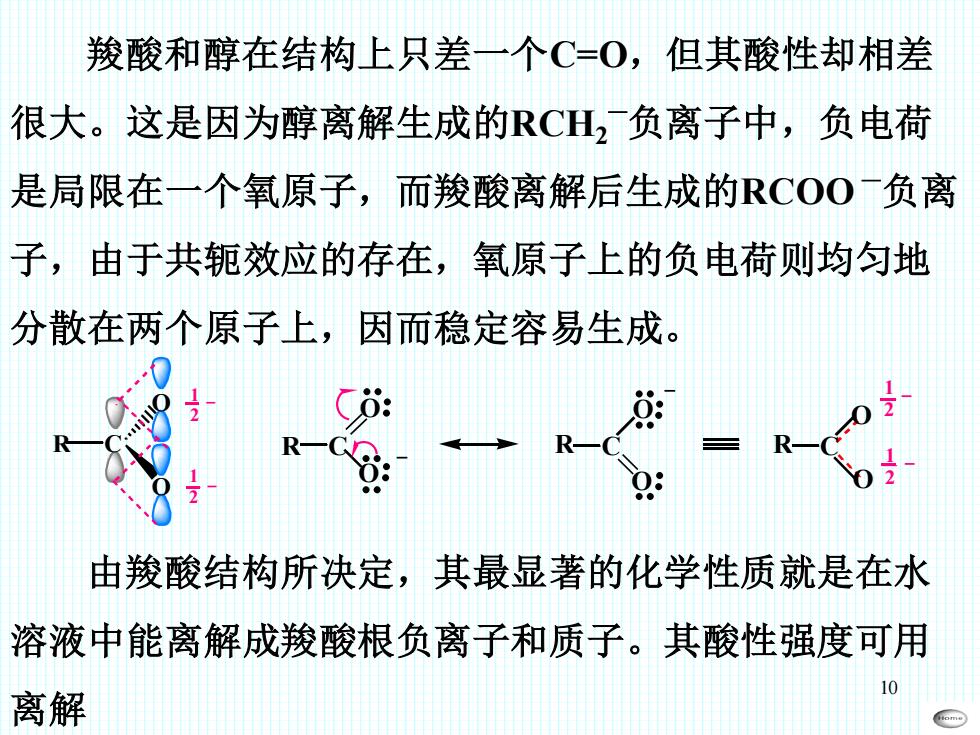
10 羧酸和醇在结构上只差一个C=O,但其酸性却相差 很大。这是因为醇离解生成的RCH2  ̄负离子中,负电荷 是局限在一个氧原子,而羧酸离解后生成的RCOO  ̄负离 子,由于共轭效应的存在,氧原子上的负电荷则均匀地 分散在两个原子上,因而稳定容易生成。 R C O O 1 2 1 2 R C = O O R C O O = R C O O 1 2 1 2 由羧酸结构所决定,其最显著的化学性质就是在水 溶液中能离解成羧酸根负离子和质子。其酸性强度可用 离解
10 羧酸和醇在结构上只差一个C=O,但其酸性却相差 很大。这是因为醇离解生成的RCH2  ̄负离子中,负电荷 是局限在一个氧原子,而羧酸离解后生成的RCOO  ̄负离 子,由于共轭效应的存在,氧原子上的负电荷则均匀地 分散在两个原子上,因而稳定容易生成。 R C O O 1 2 1 2 R C = O O R C O O = R C O O 1 2 1 2 由羧酸结构所决定,其最显著的化学性质就是在水 溶液中能离解成羧酸根负离子和质子。其酸性强度可用 离解

11 常数Ka或它的负对数pKa表示。一些化合物的酸碱性强弱 次序如下: 相对酸性: RCOOH > HOH > ROH > HC CH > NH3 > RH 相对碱性: RCOO < HO < RO < HC C < NH2 < R 2. 影响酸性强度的因素 吸电子诱导效应(-I效应)使酸性↑,其相对强度: 同族元素——从上到下原子序数依次↑,电负性依次 ↓。故: F > Cl > Br > I ; OR > SR CH2COOH > CH2COOH > CH2COOH F Cl Br pKa 2.66 2.86 2.90 如:
11 常数Ka或它的负对数pKa表示。一些化合物的酸碱性强弱 次序如下: 相对酸性: RCOOH > HOH > ROH > HC CH > NH3 > RH 相对碱性: RCOO < HO < RO < HC C < NH2 < R 2. 影响酸性强度的因素 吸电子诱导效应(-I效应)使酸性↑,其相对强度: 同族元素——从上到下原子序数依次↑,电负性依次 ↓。故: F > Cl > Br > I ; OR > SR CH2COOH > CH2COOH > CH2COOH F Cl Br pKa 2.66 2.86 2.90 如:
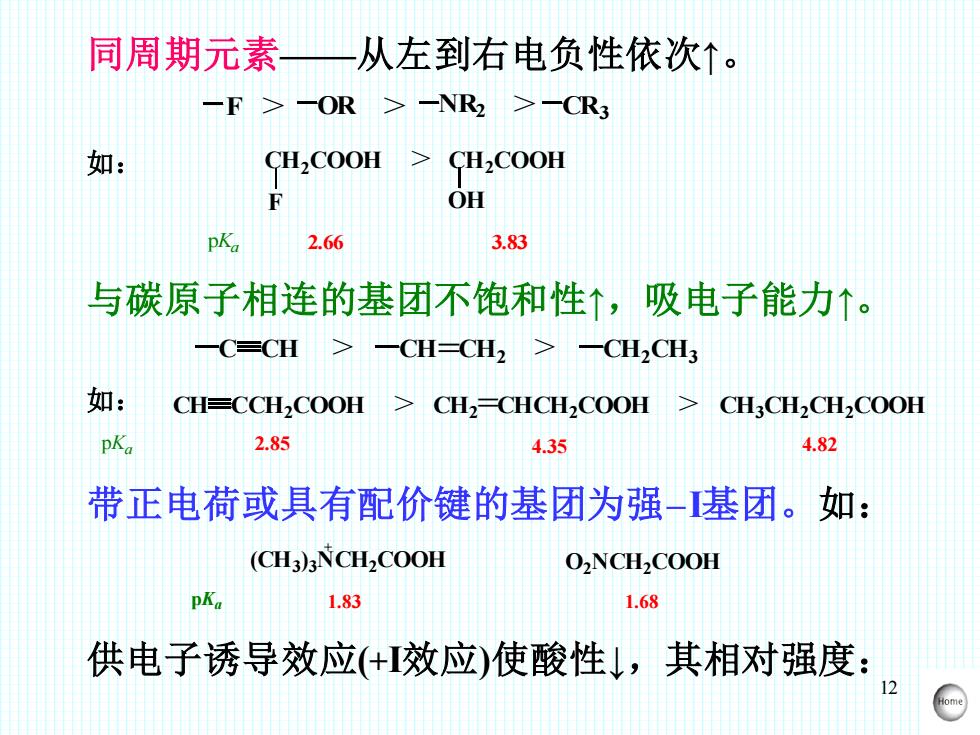
12 同周期元素——从左到右电负性依次↑。 F > OR > NR2 > CR3 CH2COOH > CH2COOH F OH pKa 2.66 3.83 如: 与碳原子相连的基团不饱和性↑,吸电子能力↑。 C CH > CH=CH2 > CH2CH3 pKa CH CCH2COOH CH2 =CHCH2COOH CH3CH2CH2COOH 2.85 > > 4.35 4.82 如: 带正电荷或具有配价键的基团为强-I基团。如: (CH3 ) 3NCH2COOH O2NCH2COOH + pKa 1.83 1.68 供电子诱导效应(+I效应)使酸性↓,其相对强度:
12 同周期元素——从左到右电负性依次↑。 F > OR > NR2 > CR3 CH2COOH > CH2COOH F OH pKa 2.66 3.83 如: 与碳原子相连的基团不饱和性↑,吸电子能力↑。 C CH > CH=CH2 > CH2CH3 pKa CH CCH2COOH CH2 =CHCH2COOH CH3CH2CH2COOH 2.85 > > 4.35 4.82 如: 带正电荷或具有配价键的基团为强-I基团。如: (CH3 ) 3NCH2COOH O2NCH2COOH + pKa 1.83 1.68 供电子诱导效应(+I效应)使酸性↓,其相对强度: