
D0:CNK:23-1480/S20110701.1325.008网络出版时间:2011G7-d1125 植物研究201,315):558-562 Bulletin of Botanical Research 网络出版地址:httpp///wwwrikniet6 losdisfdi(a/2Q.803.20UWD1025.D885h0n8.html 大花蕙兰多倍体的高效诱导 季必霞陈达伟张晨晨1闵笛黄文静王钰23· (1.安徽大学生命科学学院,合肥230039:2.安徽大学资源与环境工程学院,合肥230039:3.安徽省中药材产业研发中心,合肥230039) 摘要以大花蕙兰“红瀑布'无菌苗丛芽为材料、秋水仙素为诱变剂,采用不同的处理浓度、时间诱导大花蕙兰体 细胞加倍。通过形态学和细胞学观察、统计等方法对其进行倍性鉴定。结果表明:秋水仙素浓度0.05%,处理时间 24h的条件下,诱导率高达28.2%:多倍体苗外部形态、叶绿体数目、气孔数目和大小与二倍体差异大,加倍后的细 胞核明显变大,染色体倍数增加。 关键词大花蕙兰:秋水仙素:化学诱变:多倍体 中图分类号:S682.29文献标识码:A文章编号:1673-5102(2011)05-0558-05 High Efficient Polyploid Induction of Cymbidium hybridium JI Bi-Xia'CHEN Da-Wei ZHANG Chen-Chen'MIN Di'HUANG Wen-Jing'WANG Yu2.3* (1.College of Life Science,Anhui University,Hefei 230039:2.College of Resources and Environmental Engineering,Anhui University,Hefei 230039:3.Anhui Research Centre of Chinese Medicinal Materials industry,Hefei 230039) Abstract The shoots of Cymbidium hybridium were soaked in colchicine solutions at different concentrations and treatment times to induce doubling of body cell chromosome.Ploidy levels were identified by morphological and cytological traits.The results showed that the treated shoots of C.hybridium with 0.05%colchicine for 24 h had a higher inducing rate which was up to 28.2%.The external morphology,the number of chloroplast as well as the number and size of stomata were obviously different between the diploid and polyploid.The nucleus of pol- yploid cell was obviously bigger and the number of chromosome was increased. Key words Cymbidium hybridium:colchicine:chemical induction:polyploid 大花蕙兰(Cymbidium hybridium)是兰科(Or- 性强、株型奇特等特征,更有观赏价值。近年来很 chidaceae)兰属(Cymbidium)中的一部分大花附生 多研究机构先后对春兰[s)、三色董6]、菊花脑]及 种类及其杂交种,是世界上栽培较为普及的“祥 地锦]等观赏植物进行了染色体加倍与新品种选 兰”之一,具有重要的观赏价值、经济价值和广阔 育的研究,并取得了一定进展。 的市场前景。 目前对大花蕙兰组培快繁进行了研究,一些品 目前国内大花蕙兰的育种研究仍是以杂交方法 种已建立了脱毒快繁体系91],但在多倍体育种 为主。使用传统的育种技术所需周期较长,同时受到 方面研究较少。杨丽娟等山对大花蕙兰‘红宝石' 自然、季节等环境因素限制。常规的杂交方法难以打 进行了秋水仙素处理,获得了大量变异植株。王木 破生物物种的限制,某些优良性状难以得以利用】。 桂等]对大花蕙兰新品种日出'进行了秋水仙素 应用组织培养技术结合秋水仙素诱变处理,是 处理,建立了该品种的多倍体诱导和倍性鉴定技术 植物新品种选育的一条重要的育种途径,具独特的 体系。本试验以大花蕙兰无菌苗丛芽为材料,采用 优势和发展潜力2-1。秋水仙素在诱导植物产生 秋水仙素浸泡法,以获取大花蕙兰多倍体,旨在探 多倍体方面的研究成果较多,将加倍技术应用于靠 索大花蕙兰多倍体高效诱导和鉴定的方法,为大花 无性繁殖的花卉所产生的多倍体具有器官巨大、抗 蕙兰多倍体育种提供科学依据和技术基础。 基金项目:安徽省外专局项目(S20093400190) 第一作者简介:季必霞(1984一),女,硕士研究生,主要从事细胞工程研究。 ·通讯作者 收稿日期:2011-04-17
书 !"#$ "#$$,%$(&):&&’ ( &)" !"##$%&’ () !(%*’&+*# ,$-$*.+/ %&’(:)*+,-.’((*"##+%,##$+#) /01234:567($+’,—),8,9:#$;,?@ABC#$。 ! DE12 FGHI:"#$$ - #, - $. !"#$%&’()*+, !"#$ $%&$ ’(($ ) *$ +,-$ . /",%! (!/ )*JK;LMKKN,OP "%##%+;"/ )*JKQRSTUBCKN,OP "%##%+;#/ )*+VWXYZ#[V\,OP "%##%+) - . ]J^_‘‘abc’defghiXj、klmniopq,rstuvwxyz、{|o}J^_‘~ @A。DK@AK 、。:klmnyz #/ #&0 ,wx{| ", 1 v,o} "’/ "0 ;~f,、 ~¡(、¢£¡(J¤S¥~¦§J,¨v@ A©ªpJ,«¬~¡。 /01 J^_‘;klmn;®Kop;~ 23456:*)’"/ " 2 + 789:;:3 7 ?:8@A7 $ BC ;1AD8;1AD$ E5> ?7 $ C @AD847DG $ @3>C HI",%! (!/ ;JKKAGA JL M7LA *N7ADNA,3D1I7 FD7OAPQ7RS,?[’] Ä!"@«¬~Sóô³õ Ñv#$,ABí@0û。 (ÍJ^_‘ð¼C%@#$,0éô ³DEF@GHC%~I[+ ( $#] ,Jþ~ѳ ÿ#$½K。LMN[$$] J^_‘‘aOP’ @klmnwx,Qí@JRp§!-。ST U[$"] J^_‘óô³‘HV’@klmn wx,EF@Wô³v~o}ÕÖ ~I。XYZ]J^_‘defghiXj,rs klmn[\,]QBJ^_‘~,]þ^ _J^_‘~‘o}v,iJ^ _‘~ѳabMKcdÕÖ%e。 DOI:CNKI:23-1480/S.20110701.1325.008 网络出版时间:2011-07-01 13:25 网络出版地址: http://www.cnki.net/kcms/detail/23.1480.S.20110701.1325.008.html 2011-7-1 13:25 http://www.cnki.net/kcms/detail/23.1480.s.20110701.1325.008.html���������
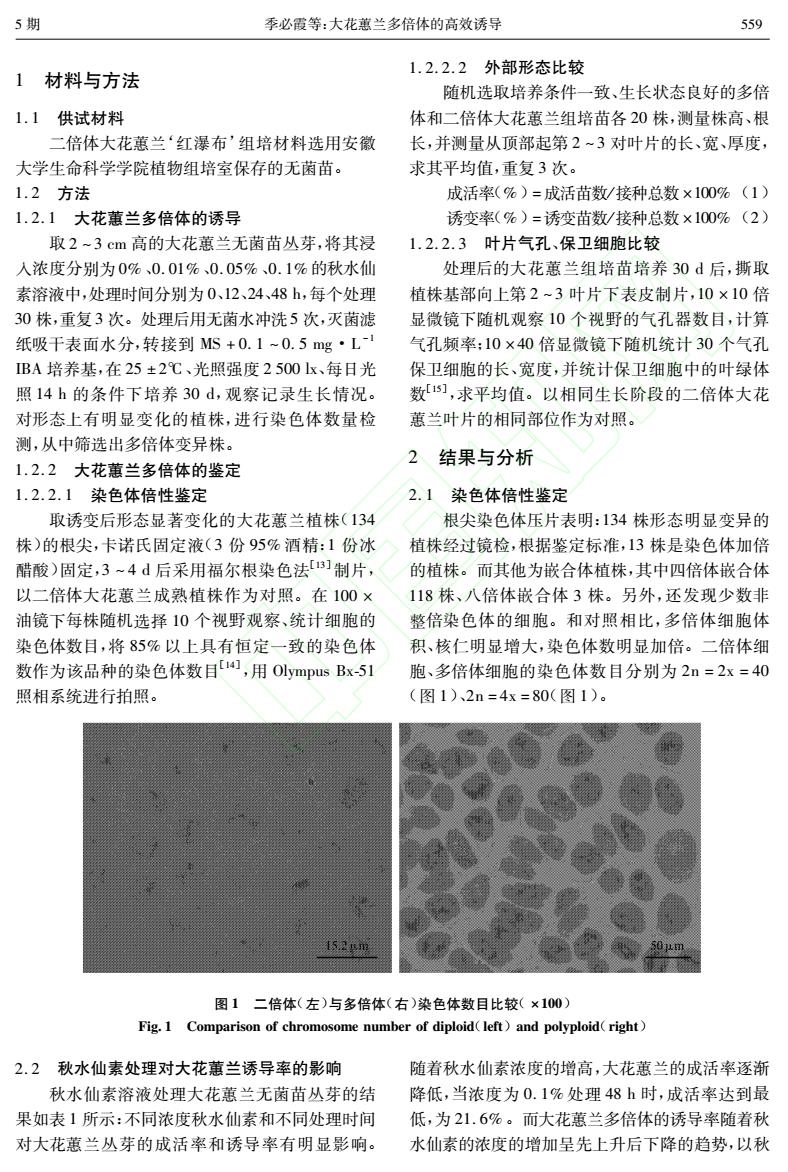
5期 季必霞等:大花蕙兰多倍体的高效诱导 559 1.2.2.2外部形态比较 1材料与方法 随机选取培养条件一致、生长状态良好的多倍 1.1供试材料 体和二倍体大花蕙兰组培苗各20株,测量株高、根 二倍体大花蕙兰‘红瀑布'组培材料选用安徽 长,并测量从顶部起第2~3对叶片的长、宽、厚度, 大学生命科学学院植物组培室保存的无菌苗。 求其平均值,重复3次。 1.2方法 成活率(%)=成活苗数/接种总数×100%(1) 1.2.1大花蕙兰多倍体的诱导 诱变率(%)=诱变苗数/接种总数×100%(2) 取2~3cm高的大花蕙兰无菌苗丛芽,将其浸 1.2.2.3叶片气孔、保卫细胞比较 人浓度分别为0%、0.01%、0.05%、0.1%的秋水仙 处理后的大花蕙兰组培苗培养30d后,撕取 素溶液中,处理时间分别为0、12、24、48h,每个处理 植株基部向上第2~3叶片下表皮制片,10×10倍 30株,重复3次。处理后用无菌水冲洗5次,灭菌滤 显微镜下随机观察10个视野的气孔器数目,计算 纸吸干表面水分,转接到MS+0.1~0.5mg·L-1 气孔频率:10×40倍显微镜下随机统计30个气孔 BA培养基,在25±2℃、光照强度2500K、每日光 保卫细胞的长、宽度,并统计保卫细胞中的叶绿体 照14h的条件下培养30d,观察记录生长情况。 数[),求平均值。以相同生长阶段的二倍体大花 对形态上有明显变化的植株,进行染色体数量检 蕙兰叶片的相同部位作为对照。 测,从中筛选出多倍体变异株。 2结果与分析 1.2.2大花蕙兰多倍体的鉴定 1.2.2.1染色体倍性鉴定 2.1染色体倍性鉴定 取诱变后形态显著变化的大花蕙兰植株(134 根尖染色体压片表明:134株形态明显变异的 株)的根尖,卡诺氏固定液(3份95%酒精:1份冰 植株经过镜检,根据鉴定标准,13株是染色体加倍 醋酸)固定,3~4d后采用福尔根染色法]制片, 的植株。而其他为嵌合体植株,其中四倍体嵌合体 以二倍体大花蕙兰成熟植株作为对照。在100× 118株、八倍体嵌合体3株。另外,还发现少数非 油镜下每株随机选择10个视野观察、统计细胞的 整倍染色体的细胞。和对照相比,多倍体细胞体 染色体数目,将85%以上具有恒定一致的染色体 积、核仁明显增大,染色体数明显加倍。二倍体细 数作为该品种的染色体数目[,用Olympus Bx-51 胞、多倍体细胞的染色体数目分别为2n=2x=40 照相系统进行拍照。 (图1)、2n=4x=80(图1)。 152m 0 图1二倍体(左)与多倍体(右)染色体数目比较(×100) Fig.1 Comparison of chromosome number of diploid(left)and polyploid(right) 2.2秋水仙素处理对大花蕙兰诱导率的影响 随着秋水仙素浓度的增高,大花蕙兰的成活率逐渐 秋水仙素溶液处理大花蕙兰无菌苗丛芽的结 降低,当浓度为0.1%处理48h时,成活率达到最 果如表1所示:不同浓度秋水仙素和不同处理时间 低,为21.6%。而大花蕙兰多倍体的诱导率随着秋 对大花蕙兰丛芽的成活率和诱导率有明显影响。 水仙素的浓度的增加呈先上升后下降的趋势,以秋
! >?@AB !# ! CD>? ¥~J^_‘‘abc’ð¼Xjõs)* JK;LMKKN!"ð¼fghvdef。 !# $ AB !# $# ! !"#$%&’(+, B $ % & ’( vJ^_‘defgh,"[ iyz±ji)* 、)# )!* 、)# )+* 、)# !* vklm nklV,wx{|±ji )、!$、$,、,- .,mnwx &) -,Ão& p。wx¨sdelqr+ p,set uvwÿl±,xyÜ /0 1 )# ! % )# + (2·3 4 ! 567 ¼ò%,þ $+ 8 $9、z{,z $ +)) :;、mHz { !, . v¼ò &) VõV~p§-。 !# $# $ !"#$%&’(EF !# $# $# ! GH’&IEF Bop¨ªp®vJ^_‘!-(!&, -)v ,l(& =+* :! ),& % , m-6õ !) n 、@Av «¬~¡(," -+* ]ºÁÂ0v«¬~ ¡1iWô³v«¬~¡([!,] ,s ?:@(ABC 6;D+! {I{。 !# $# $# $ JKLMNO 6õB¼ò0、;Úìëv ~¥~J^_‘ð¼f $) -,R-、 Ú,AR> ¡/ $ % & vÚ、¢、£z, ¤¥¦Æ,Ão & p。 !§(*)E!§f¡F y³¨¡ >!))* (!) op(*)Eopf¡F y³¨¡ >!))* ($) !# $# $# & PQRS、TUVWNO wx¨vJ^_‘ð¼f¼ò &) !) ª¬6 !) nv¢£(¡(, ¢£®;!) > ,) ª¬6 &) n¢£ g¯@AvÚ、¢z,Ag¯@AVv ~ ¡[!+] ,¤¥¦Æ。]u;Ú°±v¥~J^ _‘vu²1i{。 $ XY@4Z $# ! GH’&IEF «¬~³:!&, -ªp§v !-Ç,d´µ,!& -¯«¬~ v!-。¶·i¸O~!-,V¹~¸O~ !!- -、º~¸O~ & -。»,,¼[½K¡¾ ¿«¬~v@A。{À,~@A~ Á、©ÂªJ,«¬~¡ª。¥~@ A、~@Av«¬~¡(±ji $G E $; E ,) (à !)、$G E ,; E -)(à !)。 3 ! [&’(\)@%&’(])GH’^_NO( # !$$) %&’( ! )*+,-.&/*0 *1 23.*+*/*+4 05+64. *1 7&,8*&7(8419)-07 ,*8:,8*&7(.&’39) $# $ ‘abcdef!"#$+,g(hi klmnklwxJ^_‘defghv Ä ! ×Å:tuyzklmntuwx{| J^_‘ghv!§o}ªÆÇ。 Èklmnyzv,J^_‘v!§ÉÊ ËÌ,Íyzi )# !* wx ,- . {,!§ÜÎ Ì,i $!# H* 。¶J^_‘~vo}Èk lmnvyzvÏ8ºÐ¨ËvÑú,]k + I 567:J^_‘~v‘o} ++=�����������������������
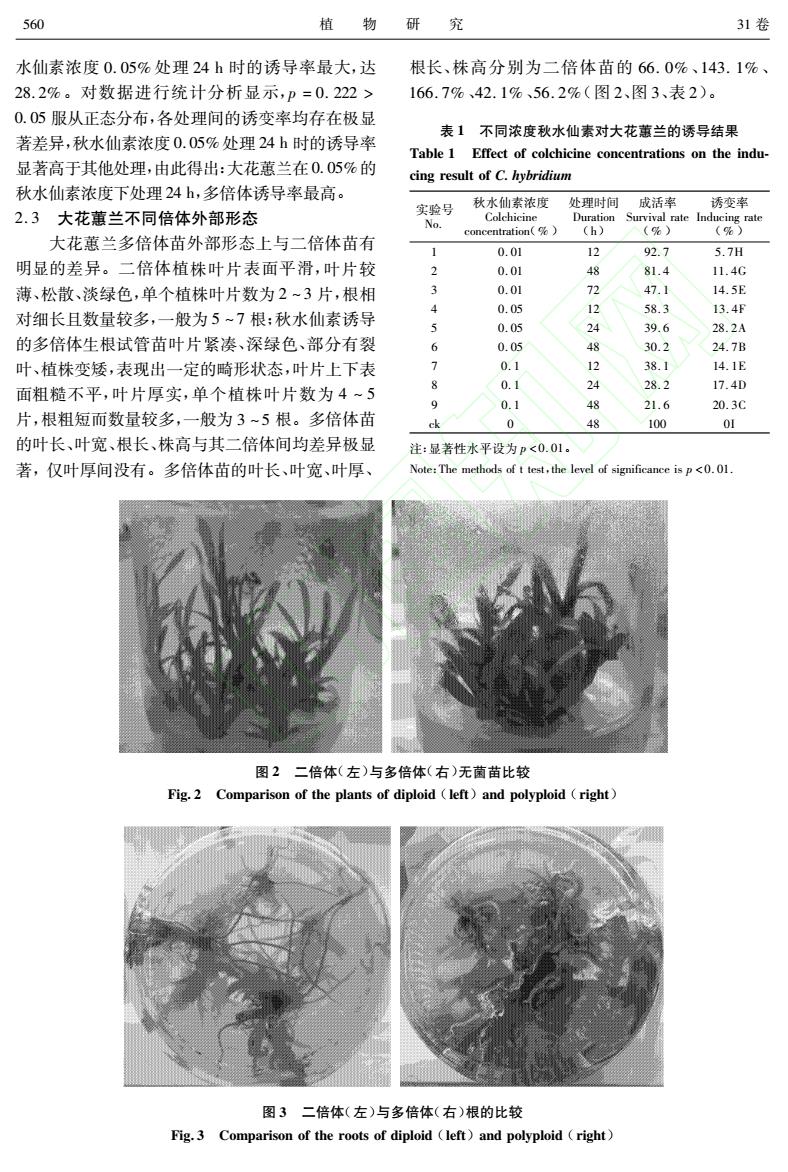
560 植 物研 究 31卷 水仙素浓度0.05%处理24h时的诱导率最大,达 根长、株高分别为二倍体苗的66.0%、143.1%、 28.2%。对数据进行统计分析显示,p=0.222> 166.7%、42.1%、56.2%(图2、图3、表2)。 0.O5服从正态分布,各处理间的诱变率均存在极显 表1不同浓度秋水仙素对大花蕙兰的诱导结果 著差异,秋水仙素浓度0.05%处理24h时的诱导率 Table 1 Effect of colchicine concentrations on the indu- 显著高于其他处理,由此得出:大花蕙兰在0.05%的 cing result of C.hybridium 秋水仙素浓度下处理24h,多倍体诱导率最高。 秋水仙素浓度 处理时间 成活率 诱变率 2.3大花蕙兰不同倍体外部形态 实验号 Colchicine Duration No. Survival rate Inducing rate concentration(%) (h) (%) (%) 大花蕙兰多倍体苗外部形态上与二倍体苗有 1 0.01 12 92.7 5.7H 明显的差异。二倍体植株叶片表面平滑,叶片较 2 0.01 81.4 11.4G 薄、松散、淡绿色,单个植株叶片数为2~3片,根相 3 0.01 47.1 14.5E 对细长且数量较多,一般为5~7根:秋水仙素诱导 4 0.05 58.3 13.4F 5 0.05 24 39.6 28.2A 的多倍体生根试管苗叶片紧凑、深绿色、部分有裂 6 0.05 30.2 24.7B 叶、植株变矮,表现出一定的畸形状态,叶片上下表 7 0.1 12 38.1 14.1E 面粗糙不平,叶片厚实,单个植株叶片数为4~5 8 0.1 28.2 17.4D 9 0.1 21.6 20.3C 片,根粗短而数量较多,一般为3~5根。多倍体苗 ck 0 48 100 01 的叶长、叶宽、根长、株高与其二倍体间均差异极显 注:显著性水平设为p<0.01。 著,仅叶厚间没有。多倍体苗的叶长、叶宽、叶厚、 Note:The methods of t test,the level of significance is p<0.01. 图2二倍体(左)与多倍体(右)无菌苗比较 Fig.2 Comparison of the plants of diploid (left)and polyploid (right) 图3二倍体(左)与多倍体(右)根的比较 Fig.3 Comparison of the roots of diploid (left)and polyploid (right)
lmnyz !" !#$ wx %& ’ {vo}ÎJ, %(" %$。¡d±ÒªÅ,! ) !" %%% * !+ !# Ó>Ô±c,wx|vop¦hþÕª ¦§,klmnyz !" !#$ wx %& ’ {vo} ª#·wx,Ö×íV:J^_‘þ !+ !#$v klmnyzwx %& ’,~o}Î。 %" , !"#$jk&’JKLM J^_‘~f,ºS¥~f ªv¦§。¥~!-ÿ¥Ø,½ Ù、ÚÛ、Ü ¬,Ýn!-¡i % . , , @ÚÞ¡R½,0ßi # . / ;klmno} v~;Yàfáâ、ã ¬、±Âä 、!-på,½V0væì,º ÿçèt¥,£é,Ýn!-¡i & . # ,ç궡R½,0ßi , . # 。~f vÚ、¢、Ú、-S¥~|¦¦§Õª ,ë£|ìÂ。~fvÚ、¢、£、 Ú、-±ji¥~fv 00" !$ 、1&," 1$ 、 100" /$ 、&%" 1$ 、#0" %$(à %、à ,、 %)。 l ! jkmn‘abcf!"#$(+,XY #$%&’ ! ())’*+ ,) *,&*-.*./’ *,/*’/+0$+.,/1 ,/ +-’ ./234 *./5 0’13&+ ,) !" #$%&’(’)* éZí 23" klmnyz 4356’76789 638698:;;;@7@678C ;<:9 ($ ) 1 !" !1 1% D%" / #" /E % !" !1 &( (1" & 11" &F , !" !1 /% &/" 1 1&" #G & !" !# 1% #(" , 1," &H # !" !# %& ,D" 0 %(" %I 0 !" !# &( ,!" % %&" /J / !" 1 1% ,(" 1 1&" 1G ( !" 1 %& %(" % 1/" &= D !" 1 &( %1" 0 %!" ,4 6K ! &( 1!! !A î:ªl¥ïi ! L !" !1。 23:9:M’9 N9:’3BO 3P : :9O:,:’9 59@95 3P O7C87P76<869 7O ! L !" !1" 3 6 [&’(\)@%&’(])opqNO 7.58 6 9,:;$0.1,/ ,) +-’ ;&$/+1 ,) 2.;&,.2(&’)+)$/2 ;,&<;&,.2(0.5-+) 3 = [&’(\)@%&’(])r(NO 7.58 = 9,:;$0.1,/ ,) +-’ 0,,+1 ,) 2.;&,.2(&’)+)$/2 ;,&<;&,.2(0.5-+) #0! ! " # $ ,1 ð�
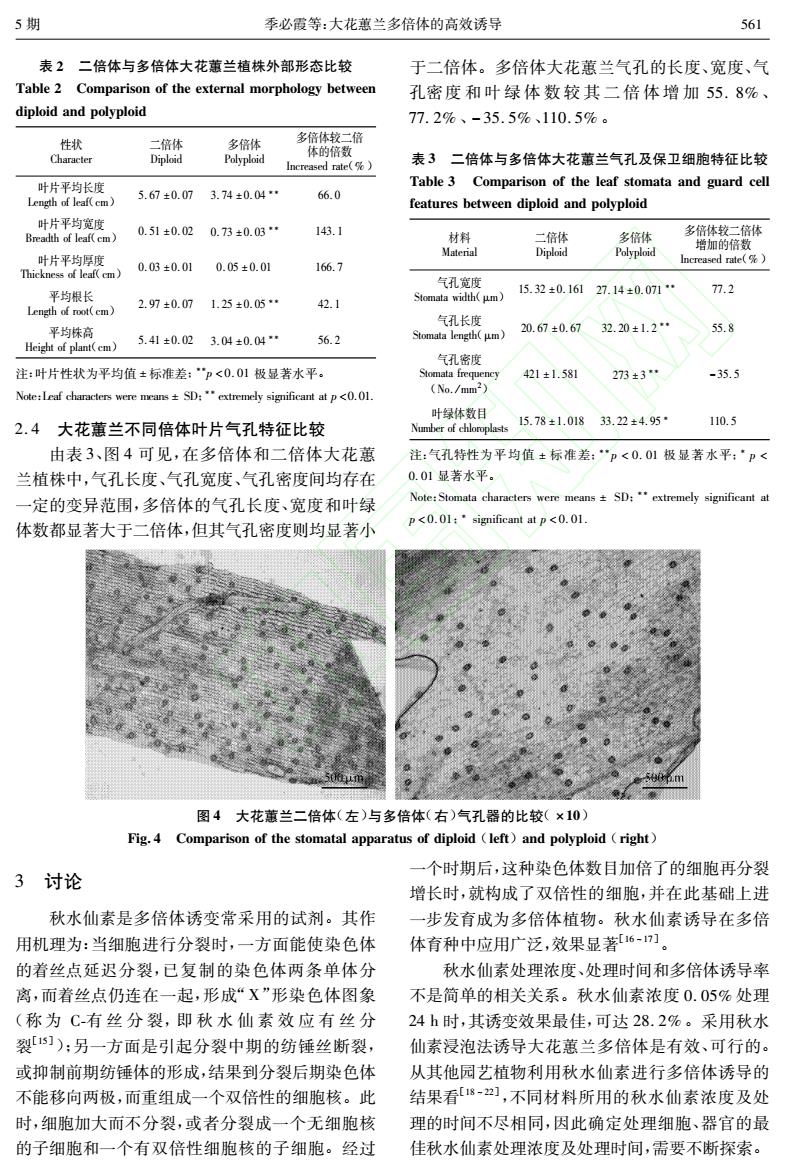
5期 季必霞等:大花蕙兰多倍体的高效诱导 561 表2二倍体与多倍体大花蕙兰植株外部形态比较 于二倍体。多倍体大花蕙兰气孔的长度、宽度、气 Table 2 Comparison of the external morphology between 孔密度和叶绿体数较其二倍体增加55.8%、 diploid and polyploid 77.2%、-35.5%、110.5%。 性状 二倍体 多倍体 多倍体较二倍 Character Diploid Polyploid 体的倍数 Increased rate(%) 表3二倍体与多倍体大花蕙兰气孔及保卫细胞特征比较 叶片平均长度 Table 3 Comparison of the leaf stomata and guard cell 5.67±0.07 Length of leaf(cm) 3.74±0.04 66.0 features between diploid and polyploid 叶片平均宽度 Breadth of leaf(cm> 0.51±0.02 0.73±0.03 143.1 材料 二倍体 多倍体 多倍体较二倍体 Material Diploid Polyploid 增加的倍数 叶片平均厚度 0.03±0.01 0.05±0.01 166.7 Increased rate(%) Thickness of leaf(cm) 气孔宽度 平均根长 Stomata width(μm) 15.32±0.161 27.14±0.071 77.2 Length of root(cm) 2.97±0.07 1.25±0.05* 42.1 气孔长度 平均株高 Stomata length(μm) 20.67±0.67 32.20±1.2* 55.8 Height of plant(cm) 5.41±0.02 3.04±0.04 56.2 气孔密度 注:叶片性状为平均值±标准差:”p<0.01极显著水平。 Stomata frequency 421±1.581 273±3 -35.5 Note:Leaf characters were means+SD:extremely significant at p<0.01. No./mm2) 叶绿体数目 110.5 2.4大花蕙兰不同倍体叶片气孔特征比较 Number of chloroplasts 15.78±1.01833.22±4.95 由表3、图4可见,在多倍体和二倍体大花蕙 注:气孔特性为平均值±标准差:“p<0.01极显著水平:·p< 兰植株中,气孔长度、气孔宽度、气孔密度间均存在 0.01显著水平。 一定的变异范围,多倍体的气孔长度、宽度和叶绿 Note:Stomata characters were means SD:extremely significant at p<0.01:significant at p<0.01. 体数都显著大于二倍体,但其气孔密度则均显著小 图4大花蕙兰二倍体(左)与多倍体(右)气孔器的比较(×10) Fig.4 Comparison of the stomatal apparatus of diploid left)and polyploid (right) 一个时期后,这种染色体数目加倍了的细胞再分裂 3讨论 增长时,就构成了双倍性的细胞,并在此基础上进 秋水仙素是多倍体诱变常采用的试剂。其作 一步发育成为多倍体植物。秋水仙素诱导在多倍 用机理为:当细胞进行分裂时,一方面能使染色体 体育种中应用广泛,效果显著6-]。 的着丝点延迟分裂,已复制的染色体两条单体分 秋水仙素处理浓度、处理时间和多倍体诱导率 离,而着丝点仍连在一起,形成“X”形染色体图象 不是简单的相关关系。秋水仙素浓度0.05%处理 (称为C-有丝分裂,即秋水仙素效应有丝分 24h时,其诱变效果最佳,可达28.2%。采用秋水 裂1]):另一方面是引起分裂中期的纺锤丝断裂, 仙素浸泡法诱导大花蕙兰多倍体是有效、可行的。 或抑制前期纺锤体的形成,结果到分裂后期染色体 从其他园艺植物利用秋水仙素进行多倍体诱导的 不能移向两极,而重组成一个双倍性的细胞核。此 结果看[18],不同材料所用的秋水仙素浓度及处 时,细胞加大而不分裂,或者分裂成一个无细胞核 理的时间不尽相同,因此确定处理细胞、器官的最 的子细胞和一个有双倍性细胞核的子细胞。经过 佳秋水仙素处理浓度及处理时间,需要不断探索
l ! [&’@%&’!"#$stJKLMNO #$%&’ ! ()*+$,-.)/ )0 12’ ’31’,/$& *),+2)&)45 %’16’’/ 7-+&)-7 $/7 +)&5+&)-7 ì !"#$#%&’$ ¥~ ()*+,)- ~ .,+/*+,)- ~½¥ ~v¡ 01%$’#2’- $#&(’ 3 ) ¥¦Úz 4’15&" ,6 +’#(6 %7) 89 :; 9 ;? !! A?>9 A ¥¦£z C")%D1’22 ,6 +’#(6 %7) =9 => 9 =? 、à ? ñò,þ~¥~J^_ ‘!-V,¢£Úz、¢£¢z、¢£óz|¦hþ 0vp§ôõ,~v¢£Úz、¢z ~¡öªJ#¥~,J¢£óz÷¦ª¤ #¥~。~J^_‘¢£vÚz、¢z、¢ £óz ~ ¡ ½ ¥ ~ 889 M3 、 ;;N B3 、O >89 83 、AA=9 83 。 l 8 [&’@%&’!"#$RSwTUVWuvNO #$%&’ 8 ()*+$,-.)/ )0 12’ &’$0 .1)*$1$ $/7 49$,7 :’&& 0’$19,’. %’16’’/ 7-+&)-7 $/7 +)&5+&)-7 Xj P#&’$)#+ ¥~ ()*+,)- ~ .,+/*+,)- ~½¥~ v¡ 01%$’#2’- $#&(’ 3 ) ¢£¢z J&,7#&# I)-&"(!7) A89 >B B9 B= !! O >89 8 ~¡( HR7T’$ ,6 %"+,$,*+#2&2 A89 ;M >9 BB ) ?-4@ ; ()*+$,-.)/ )0 12’ .1)*$1$& $++$,$19. )0 7-+&)-7(&’01)$/7 +)&5+&)-7(,-421) > yz klmn¯~opãrsvYq。1 s6xi:Í@A±ä{,0ÿøÓ«¬~ vÈùúûü±ä,Doâv«¬~ýÝ~± þ,¶ÈùúÒÿþ0¡,!“U”«¬~Ã! (" i !V ù ± ä,# k l m n ‘ ï  ù ± ä[A8] );»0ÿ¯$¡±äVIv%&ù’ä, ()âÍI%&~v!,ܱä¨I«¬~ tø*ªýÕ,¶Ãð!0n+v@A©。× {,@AJ¶t±ä,(2±ä!0nd@A© v,@A0nÂ+@A©v,@A。Ç 0n{I¨,-³«¬~¡(@v@A.±ä Ú{,/7!@+v@A,Aþ×%eº 00[Ñ!i~!"。klmno}þ ~ѳVïsÉ1,‘ª[A: W A;] 。 klmnwxyz、wx{|~o} t¯3Ýv22I。klmnyz =9 =83 wx B? " {,op‘Î3,ñ BM9 B3 。rskl mn[\o}J^_‘~¯Â‘、ñv。 >·45!"îsklmn~o}v 6[AM W BB] ,tuXj×svklmnyzµw xv{|t7u,à×8wx@A、()vÎ 3klmnwxyzµwx{|,Ø=t’^_。 8 I 567:J^_‘~v‘o} 8:A�������

562 植 物 研 究 31卷 染色体计数是现阶段多倍体鉴定的最常用方 学报,1997,23(4):336-339 法,该方法直观、准确、快捷。染色体制片的成功与 6.郑思乡,胡秀,雷小云,等.离体培养条件下三色革多倍体诱 否与采样时期、试材染色体的多少、制片方法及制 导研究[J].云南农业大学学报,2003,18(4):43-146. 片者的技术等方面有着很大关系。因为大花蕙兰 7.陈发棣,蒋甲福,房伟民.秋水仙素诱导菊花脑多倍体的 研究[J].上海农业学报,2002,18(1):46-50 染色体数目较多,难以拍到清晰的染色体图片,其 8.李正红,孙振元,彭镇华.秋水仙素诱导地锦多倍体研究 制片方法还不成熟,故本研究在大花蕙兰的染色体 [J].核农学报,2005,19(6):430-435. 制片方法上进行了一定的摸索,在常规压片的方法 9.张晨晨,余家平,蒋琳,等.大花蕙兰高频再生体系研究 上增加了低渗的操作,大大提高了染色体制片的质 [J].植物生理通讯,2007,43(6):1101-1104 量。也对其他染色体数目较多的物种的染色体制 10.徐大成,刘晓,砚曹伟,等.几种植物生长调节物质对大 片有一定的借鉴作用。但对再生植株进行染色体 花蕙兰组培原球茎增殖的影响[J].植物研究,2004,24 (1):76-79. 鉴定的过程中也发现:除对照外,各秋水仙素处理 11.杨丽娟,高素萍,邹宗兰,等.秋水仙素离体诱导大花蕙 均产生一定比例的嵌合体,需要进一步的研究。 兰多倍体试验[J].北方园艺,2009(6):51-53. 气孔的特性(气孔大小,气孔密度,叶绿体数 12.王木桂,曾瑞珍,谢利,等.大花蕙兰四倍体的离体诱导 目)与植物的倍性水平在遗传上是相关的2]。在 和鉴定[J].西北植物学报,2010,30(1):0056-0062. 染色体鉴定之前,气孔的特性作为一种简单而有效 13.李进华,周忠泽.染色体标本制备、显带及组型分析 的方法被用于大花蕙兰的倍性水平分析。但刘 [M].合肥:安徽大学出版,2005:384-386. 芳2]对不同倍性蝴蝶兰资源的研究表明,由于不 14.朱根发,吕复兵,王碧青,等.大花蕙兰品种的染色体数 同倍性间蝴蝶兰的气孔长度和密度存在重叠,所以 目分析J].园艺学报,2006,33(2):417-421. 15.杨小青.高中生物教材中秋水仙素作用机理简介[J] 利用气孔长度和密度不能准确地鉴定蝴蝶兰的倍 中学生物学,2004,4:9-10. 性。本研究结果表明:二倍体和多倍体植株的气孔 16.Kermani M J,Sarasan V,Roberts A V,et al.Oryzalin-in- 特性存在极显著差异,即多倍体苗气孔的长度、宽 duced chromosome doubling in Rosa and its effect on plant 度和叶绿体数目均大于二倍体苗,但其气孔密度小 morphology and pollen viability[J].TAG Theoretical and 于二倍体苗,因此利用气孔的大小、密度及叶绿体 Applied Genetics,2004,107(7):1195-1200. 数目鉴定其倍性是可靠的。 17.Kunitake H,Nakashima T,Mori K,et al.Somaclonal and 化学诱变育种技术与植物组织和细胞离体培 chromosomal effects of genotype,ploidy and culture dura- tion in Asparagus officinalis L.[J].Euphytica,1998,102: 养技术相结合可以改良花卉品种、具有不受环境条 309-316. 件限制、节省大量人工和时间、扩大变异谱和提高 18.王小华,熊丽,曲云慧,等.中国桔梗多倍体诱导与鉴定 变异率等优点[5]。多倍体大花蕙兰‘红瀑布' [J].云南植物研究,2006,28(6):593-598. 与对照相比,生长势旺,主茎增粗,叶片加厚,加宽: 19.张志胜,黎扬辉,姜蕾,等.红掌四倍体的离体诱导及其 同时多倍体大花蕙兰株型变得紧凑,对改良其二倍 鉴定[J].园艺学报,2007,34(3):729-734. 体植株株型分散的缺陷是有效的,和王木桂等] 20.Kim M S,Won J Y,Song C H,et al.Polyploidy induction of 对大花蕙兰‘日出'多倍体的报道一致。但作为花 Cymbidium kanran by treatment of colchicines in vi tro[J]. Journal of Horticulture Science,1997,39(1):73-76. 卉明显改善品质,尚有待于进一步研究。 21.Kadota M,Niimi Y.In vitro induction of tetrapoid plants 参考文献 from a diploid Japanese pear cultivar(Pyrus pyr-folia N.cv. Hosui)[J].Plant Cell Reports,2002,21(3):282-286. 1.王利民.大花蕙兰的杂交育种研究[D].北京:北京林业 22.张振超,张蜀宁,张伟,等.四倍体不结球白菜的诱导及染 大学,2007. 色体倍性鉴定[J].西北植物学报,2007,27(1):28-32. 2.刘进平,郑成木.诱变结合植物组织培养在植物育种中 23.Gu X F,Yang A F,Meng H,et al.In vitro induction of 的应用[J].上海农业学报,2004,20(1):19-22. tetraploid plants from diploid Zizyphus jujuba Mill.cv. 3.Stefano P.Mutation induction and tissue culture in impro- Zhanhua[J].Plant Cell Rep,2005,24:671-676. ving fruits[J].Plant Cell,Tissue and Organ Culture,2001, 24.刘芳.蝴蝶兰种质资源遗传多样性研究[D].广州:华南 64:185-210 农业大学,2008 4.崔广荣,张子学,张从宇,等.文心兰多倍体诱导及其鉴 25.夏英武.作物诱变有种[M].北京:中国农业出版社,1997. 定[J].草业学报,2010,19(1):183-190. 26.董颖苹,连勇,何庆才,等.植物化学诱变技术在育种中 5.林芬,邓国础.春兰人工诱变的研究[J].湖南农业大学 的运用及其进展[J].种子,2005,24(7):54-58
«¬~¡¯½°±~vÎãs ,W9 、µ8、C:。«¬~âv!;S ?v«¬~Ã, â¼t!,@X#$þJ^_‘v«¬~ âº@0vA_,þãä³v º@ÌBvC1,JJa@«¬~âvD R。E·«¬~¡(½v"³v«¬~â Â0vF1s。J.;!-«¬~ vCVE[½:G{,,klmnwx ¦Y;0ÀHv¸O~,Ø=00v#$。 ¢£vù(¢£J¤,¢£óz, ~¡ ()S!"vl¥þIÔº¯2v[!"] 。þ «¬~ÀÍ,¢£vù1i0³3ݶ‘ vJs#J^_‘vl¥±Ò。JK L[!#] tuMN‘QRv#$,Ö#t u|MN‘v¢£ÚzózhþÃO,×] îs¢£Úzóztøµ8>MN‘v 。X#$:¥~~!-v¢£ ùhþÕª¦§,#~f¢£vÚz、¢ z ~¡(¦J#¥~f,J¢£óz¤ #¥~f,à×îs¢£vJ¤、ózµ ~ ¡(¯ñ$v。 ®KopѳÕÖS!"ðñ@Aþ~¼ òÕÖOñ]Pë^’ô³、ÁÂtÛTU áâ、ß+JRQB{|、RJp§Sa p§êú[!$ % !&] 。~J^_‘‘abc’ S{À,;ÚúT,19?2 :5 :@A?6B C:5D 3?9:1[= -]) 7>451 E2>>,F:==92 45; G?D45 E9>19?2,!++’, &#:’H$ / !’+) #) dÉe,f,K,f>g,) h\‘~o}µ [-]) iZKX,!+’+,’.(’):’H" / ’.+) $) ‘j,kÏe) 9‘QBopv#$[-]) lmcZJK KX,’..,,!"(#):""& / "".) &) ano,pq,r¤s,) þ~¼ò:¬;~o }#$[-]) smcZJKKX,!++",’H(#):#" / ’#&) ,) t[u,vw,xy]) klmno}?~#$ [-]) ©cKX,!++$,’.(&):#"+ / #"$) .) f,¥,v,) J^_‘®.;~I#$ [-]) !";xDE,!++,,#"(&):’’+’ / ’’+#) ’+) J!,K,y,) ³!";Úß"DJ ^_‘ð¼U&vÆÇ[-]) !"#$,!++#,!# (’):,& / ,.) ’’) LMN,n,‘,) klmnþ~o}J^_ ‘~YZ[-]) ^45,!++.(&):$’ / $") ’!) STU,,î,) J^_‘¹~vþ~o} [-]) ^!"KX,!+’+,"+(’):++$& / ++&!) ’") z,Ù) «¬~´Xâ、ªµð.±Ò [8]) OP:)*JKV,!++$:"H# / "H&) ’#) [,o,S,) J^_‘ô³v«¬~¡ (±Ò[-]) 45KX,!++&,""(!):#’, / #!’) ’$) L¤) V;"XVklmn1s6x34[-]) VK;"K,!++#,#:. / ’+) ’&) I2?@45: 8 -,04?4=45 J,K6L2?1= M J,21 4>) G?NO4>:5B:5B ;9:5D :5 !"#$ 45; :1= 2332451 @6?AP6>6DN 45; A6>>25 C:4L:>:1N[-]) FMQ FP26?21: 45; MAA>:2; Q2521:) 06@4<>654> 45; 23326:;N 45; 19?2 ;9?4B 1:65 :5 %#&$’$()# "**+,+-$.+# U)[-]) V9APN1:) 76>NA>6:;N :5;9 63 S6?1:19?2 0451= 3?6@ 4 ;:A>6:; -4A452=2 A24? 1:C4(? 7N?9= AN?B36>:4 T) 451 E2>> K2A6?1=,!++!,!’("):!H! / !H&) !!) f|,f®¯,fy,) ¹~t°±vo}µ« ¬~[-]) ^!"KX,!++,,!,(’):!H / "!) !") Q9 Z [,X45D M [,825D S,21 4>) Y5 C:1?6 :5;96:; A>451= 3?6@ ;:A>6:; /+01&2)# 3)3)4$ 8:>>) 451 E2>> K2A,!++$,!#:&,’ / &,&) !#) KL) MN‘³DQRIÔ=#$[*]) ɲ:m cZJK,!++H) !$) ³´µ) 1"opѳ[8]) ^_:VÏcZV¶,’..,) !&) ·¸¹,ÿº,»¼½,) !"®KopÕÖþѳV v¾sµû[-]) ³,,!++$,!#(,):$# / $H) $&! ! " # $ "’ ð�������������������