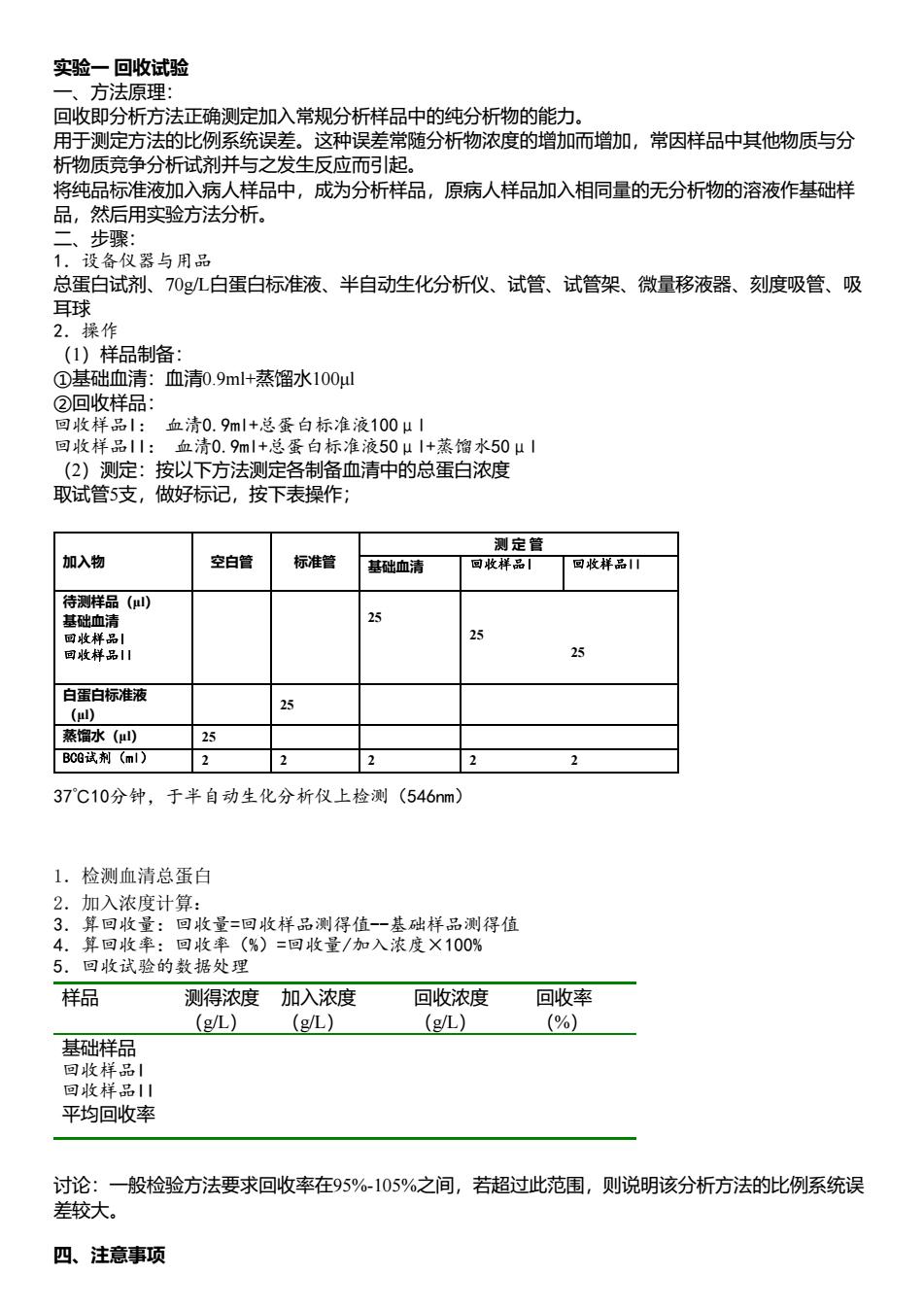
实验一回收试验 、方法原理: 回收即分析方法正确测定加入常规分析样品中的纯分析物的能力 用于测定方法的比例系统误差。这种误差常随分析物浓度的增加而增加,常因样品中其他物质与分 析物质竞争分析试剂并与之发生反应而引起。 将纯品标准液加入病人样品中,成为分析样品,原病人样品加入相同量的无分析物的溶液作基础样 品,然后用实验方法分析, 设各仪器与用品 总蛋白试剂、70gL白蛋白标准液、半自动生化分析仪、试管、试管架、微量移液器、刻度吸管、吸 操作 (1)样品制备: ①基础血清:血清0.9ml+蒸馏水100ul ②回收样品 回收样 血清0.9ml+总蛋白标准液100u1 回收样品11:血清0.9ml+,总蛋白标准液50μ1+蒸馏水50μ1 (2)测定:按以下方法测定各制备血清中的总蛋白浓度 取试管5支,做好标记,按下表操作 测定营 加入物 空白管 标准管 基础血清 回收样品 回牧样品 待测样品() 25 四收样品山 25 25 蒸馏水() 35 B06试剂(m) 2 2 2 37℃10分钟,于半自动生化分析仪上检测(546m 1.检测血清总蛋白 2.加入浓度计算: 3.算回收量:回收量=回收样品测得值-一基础样品测得值 4.算回收率:回收率(%)=回收量/加入浓度×100% 5.回收试验的数据处理 样品 测得浓度加入浓度 回收浓度 回收率 (g/L) (g/L) (9/L) (%) 基础样品 回你 回收样已1 平均回收率 讨论:一股检验方法要求回收率在95-105%之间,若超过此范围,则说明该分析方法的比例系统误 差较大。 四、注意事项
实验一 回收试验 一、方法原理: 回收即分析方法正确测定加入常规分析样品中的纯分析物的能力。 用于测定方法的比例系统误差。这种误差常随分析物浓度的增加而增加,常因样品中其他物质与分 析物质竞争分析试剂并与之发生反应而引起。 将纯品标准液加入病人样品中,成为分析样品,原病人样品加入相同量的无分析物的溶液作基础样 品,然后用实验方法分析。 二、步骤: 1.设备仪器与用品 总蛋白试剂、70g/L白蛋白标准液、半自动生化分析仪、试管、试管架、微量移液器、刻度吸管、吸 耳球 2.操作 (1)样品制备: ①基础血清:血清0.9ml+蒸馏水100μl ②回收样品: 回收样品I: 血清0.9ml+总蛋白标准液100μl 回收样品II: 血清0.9ml+总蛋白标准液50μl+蒸馏水50μl (2)测定:按以下方法测定各制备血清中的总蛋白浓度 取试管5支,做好标记,按下表操作; 加入物 空白管 标准管 测 定 管 基础血清 回收样品I 回收样品II 待测样品(μl) 基础血清 回收样品I 回收样品II 25 25 25 白蛋白标准液 (μl) 25 蒸馏水(μl) 25 BCG试剂(ml) 2 2 2 2 2 37℃10分钟,于半自动生化分析仪上检测(546nm) 1.检测血清总蛋白 2.加入浓度计算: 3.算回收量:回收量=回收样品测得值--基础样品测得值 4.算回收率:回收率(%)=回收量/加入浓度×100% 5.回收试验的数据处理 样品 测得浓度 (g/L) 加入浓度 (g/L) 回收浓度 (g/L) 回收率 (%) 基础样品 回收样品I 回收样品II 平均回收率 讨论:一般检验方法要求回收率在95%-105%之间,若超过此范围,则说明该分析方法的比例系统误 差较大。 四、注意事项

1、准确加样是最主要的关健技术。 2、纯标准品溶液的加入体积不得超过血清样品的10%,避免将血液稀释过度,引起误差的改变或消 失。 实验二蛋白质检验 一原理: 血清中各种蛋白质的等电点大都低于7.0,在pH8.6的缓冲液中,他们都电离成负离子,在电场 中向正极移动。因各种蛋白质等电点不同,在同一pH下带电荷量有差异,同时各蛋白质的分子大小 与分子形状也不相同,因此在同一电场中泳动速度也不同。带电荷多,分子量小者,泳动较快;反 之由较慢 CAM电泳可将血清蛋白分离为5条区带,从正极端起依次为白蛋白、 α1-球蛋白、2球蛋白、阝球蛋白、Y-球蛋白。由于染色时染料与蛋白质的结合与蛋白质的量成正 比,因此将各蛋白区带剪下,经脱色、比色或经透明驳处理后直接用光密度计扫描,即可计算出血清 蛋白组分的相对百分数。如同时测定出血清总蛋白浓度,带可计算出各蛋白组分的绝对浓度。 二操作步骤 1.准备: ()电泳槽的准备:将电泳槽置于水平平台上,两侧注入等量的巴比妥缓冲液,使其在同一水平 面,液面与支架距离约2-2.5cm,支架宽度调节在5.5-6cm,用三层滤纸或双层纱布搭桥。 (2)CAM的准备:选择厚薄一致,透水性能好的CAM,在无光泽面一端1.5cm处用铅笔轻划一横线 作点样标记。然后将CAM无光泽面朝下,漂浮于盛有巴比妥缓冲的平皿中,使之自然浸湿下沉,待 充分浸透后(约20分钟)用镊子取出。 2.点样 (1)将薄膜条置于洁净滤纸中间,无光泽面朝上,用滤纸轻按吸去CAM上多余的缓冲液。 品空铁高票,均与涂布于点群用香片上,重直c无光男面处待 3.电泳 (1)将加样后的薄膜平直架于支架两端,无光泽面朝下,点样侧置于阴极端,用滤纸或纱布将膜的 两端与缓冲液连通,平衡5分钟。 (2)将电泳槽的正极和负极分别与电泳仪的正极和负极联结,打开电源,调电压为8-15Vcm膜长或 电流0.3-0.5mA/cm膜宽。通电50分钟左右,待电泳区带展开约3.5-4.0cm,即可关闭电源。 4.染色 用镊子取出薄膜条直接投入氨基黑10B染色液中染色5-10分钟。染色过程中不时轻轻晃动染色皿,使 染色充分。薄膜条较多时,应避免彼此紧贴致染色不良
1、准确加样是最主要的关键技术。 2、纯标准品溶液的加入体积不得超过血清样品的10%,避免将血液稀释过度,引起误差的改变或消 失。 实验二 蛋白质检验 一 原理: 血清中各种蛋白质的等电点大都低于7.0,在pH8.6的缓冲液中,他们都电离成负离子,在电场 中向正极移动。因各种蛋白质等电点不同,在同一pH下带电荷量有差异,同时各蛋白质的分子大小 与分子形状也不相同,因此在同一电场中泳动速度也不同。带电荷多,分子量小者,泳动较快;反 之由较慢。 CAM电泳可将血清蛋白分离为5条区带,从正极端起依次为白蛋白、 α1 -球蛋白、α2 -球蛋白、β-球蛋白、γ-球蛋白。由于染色时染料与蛋白质的结合与蛋白质的量成正 比,因此将各蛋白区带剪下,经脱色、比色或经透明处理后直接用光密度计扫描,即可计算出血清 蛋白组分的相对百分数。如同时测定出血清总蛋白浓度,带可计算出各蛋白组分的绝对浓度。 二 操作步骤: 1.准备: (1)电泳槽的准备:将电泳槽置于水平平台上,两侧注入等量的巴比妥缓冲液,使其在同一水平 面,液面与支架距离约2-2.5cm,支架宽度调节在5.5-6cm,用三层滤纸或双层纱布搭桥。 (2)CAM的准备:选择厚薄一致,透水性能好的CAM,在无光泽面一端1.5cm处用铅笔轻划一横线 作点样标记。然后将CAM无光泽面朝下,漂浮于盛有巴比妥缓冲的平皿中,使之自然浸湿下沉,待 充分浸透后(约20分钟)用镊子取出。 2.点样 (1)将薄膜条置于洁净滤纸中间,无光泽面朝上,用滤纸轻按吸去CAM上多余的缓冲液。 (2)用加样枪吸取待测血清3-5μL,均匀涂布于点样用薄片上,垂直印在CAM无光滑面划线处,待 血清完全渗入薄膜后移开。 3.电泳 (1)将加样后的薄膜平直架于支架两端,无光泽面朝下,点样侧置于阴极端,用滤纸或纱布将膜的 两端与缓冲液连通,平衡5分钟。 (2)将电泳槽的正极和负极分别与电泳仪的正极和负极联结,打开电源,调电压为8-15V/cm膜长或 电流0.3-0.5mA/cm膜宽。通电50分钟左右,待电泳区带展开约3.5-4.0cm,即可关闭电源。 4.染色 用镊子取出薄膜条直接投入氨基黑10B染色液中染色5-10分钟。染色过程中不时轻轻晃动染色皿,使 染色充分。薄膜条较多时,应避免彼此紧贴致染色不良

5.漂洗 准备漂洗皿,装入漂洗液,从染色液中取出薄膜条并尽量沥去染色液,直至背景无色为止。 6.定量:洗脱比色法 氨基黑10B染色法:将各蛋白区带仔细剪下,分别置于各试管中,另从空白背景剪一块平均大小的膜 条置于空白管中,在白蛋白管内加入0.4mol/LNaOH溶液6ml(计算时吸光度乘以2),其余各管中加 入3ml,于37℃水浴20分钟,并不断摇动,待颜色脱净后,取出冷却。用620nm处比色,以空白管调 零,读取各管吸光度。 三参考范围 白蛋白:57.45-71.73% α1-球蛋白:1.76-4.48% 2-球蛋白:4.04-8.28% B-球蛋白:6.79-11.39% Y-球蛋白:11.18-22.97% 四注意事项 1.通电时,不得接触槽内缓冲液或CAM,以防触电。 2.CAM在电泳前,必须浸泡在巴比妥缓冲液中,使薄膜浸泡透彻。 3.缓冲液液面要保证一定高度,同时电泳槽两侧的液面应保持同一水平,否则通过薄膜时有虹 吸现象,会影响蛋白质分子的泳动速度。 4.电泳常见的缓冲液为巴比妥液。 5.电泳后区带应无拖尾,各区带明显分开,如果电泳图谱分离不清或不整齐,最常见的原因 有 (1)点样过多 (2)点样不均匀,不整齐,样品触及薄膜边缘 (3)薄膜过湿,样品扩散 (4)薄膜未完全浸透或温度过高导致局干燥或水分蒸发 (5)薄膜与滤纸桥接触不良 (6)薄膜位置歪斜,弯曲,与电流方向不平行 (7)缓冲液变质 (8)样品不新鲜 (9)CAM质量不高等。 6.染料问题:在血清蛋白浓度范围内,氨基黑10对白蛋白染色过深,导致白蛋白结果偏高,球 蛋白偏低。 7.血清加量:标本应新鲜,不得溶血
5.漂洗 准备漂洗皿,装入漂洗液,从染色液中取出薄膜条并尽量沥去染色液,直至背景无色为止。 6.定量:洗脱比色法 氨基黑10B染色法:将各蛋白区带仔细剪下,分别置于各试管中,另从空白背景剪一块平均大小的膜 条置于空白管中,在白蛋白管内加入0.4mol/LNaOH溶液6ml(计算时吸光度乘以2),其余各管中加 入3ml,于37℃ 水浴20分钟,并不断摇动,待颜色脱净后,取出冷却。用620nm处比色,以空白管调 零,读取各管吸光度。 三 参考范围 白蛋白:57.45-71.73% α1 -球蛋白:1.76-4.48% α2 -球蛋白:4.04-8.28% β-球蛋白:6.79-11.39% γ-球蛋白:11.18-22.97% 四 注意事项 1.通电时,不得接触槽内缓冲液或CAM,以防触电。 2.CAM在电泳前,必须浸泡在巴比妥缓冲液中,使薄膜浸泡透彻。 3.缓冲液液面要保证一定高度,同时电泳槽两侧的液面应保持同一水平,否则通过薄膜时有虹 吸现象,会影响蛋白质分子的泳动速度。 4.电泳常见的缓冲液为巴比妥液。 5.电泳后区带应无拖尾,各区带明显分开,如果电泳图谱分离不清或不整齐,最常见的原因 有: (1)点样过多 (2)点样不均匀,不整齐,样品触及薄膜边缘 (3)薄膜过湿,样品扩散 (4)薄膜未完全浸透或温度过高导致局干燥或水分蒸发 (5)薄膜与滤纸桥接触不良 (6)薄膜位置歪斜,弯曲,与电流方向不平行 (7)缓冲液变质 (8)样品不新鲜 (9)CAM质量不高等。 6.染料问题:在血清蛋白浓度范围内,氨基黑10B对白蛋白染色过深,导致白蛋白结果偏高,球 蛋白偏低。 7.血清加量:标本应新鲜,不得溶血